Лекция Культивирование. Лекция Субботин В. В., доцент Конопаткин А. А., профессор Тема биотехнология культивирования микроорганизмов план лекции Введение
 Скачать 90.15 Kb. Скачать 90.15 Kb.
|
1 2 Лекция Субботин В. В., доцент Конопаткин А. А., профессор Тема 3. БИОТЕХНОЛОГИЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ План лекции
3.2.1 Параметры кривой роста микроорганизмов и получения целевого продукта. 3.2.2. Влияние концентрации питательных веществ на скорость роста. 3.2.3. Влияние синхронизации клеточного деления на микробную популяцию. 4. Непрерывное (проточное) культивирование микроорганизмов. 4.1. Технология полного вытеснения. 4.2. Технология полного смешения. 4.3. Биотехнологическая реализация способов непрерывного культивирования микроорганизмов. 4.3.1. Хемостатный способ культивирования. 4.3.2. Турбидостатный способ культивирования. 5. Контроль за постоянством абиотических факторов при непрерывном культивировании микроорганизмов в ферментерах и биореакторах. 5.1. Аэрация питательной среды. 5.2. Непрерывное культивирование в анаэробных условиях. 5.3. Контроль и регулирование температуры. 5.4. Контроль и регулирование pH. 5.5. Автоматическое пеногашение. 5.6. Стерилизация ферментеров и способы предотвращения микробной контаминации. 6. Заключение.
Организация биотехнологического процесса, будь то синтез микробных метаболитов или получение микробной биомассы, начинается с изучения физиологии культивируемого микроорганизма. Цель любой биотехнологии – на базе понимания биохимических и физиологических процессов в пределах генетически детерминированных свойств конкретного вакцинного штамма или патогенного производственного штамма возбудителя инфекционной болезни максимально обеспечить накопление в питательной среде конечного целевого продукта. Микробиологические манипуляции с биологическим агентом и питательной средой осуществляются в соответствии с конкретным биотехнологическим процессом, разработанным для промышленного культивирования вакцинного (аттенуированного) или производственного (вирулентного) штамма микроорганизма. Основные технологические операции при этом можно систематизировать в виде некоторой иерархии уровней обеспечения параметров культивирования микроорганизма и управления процессом метаболизма созданной биотехнологической системы путем контролирующих операций. Таким образом, биотехнологическое управление процессом метобализма в микробной популяции при широкомасштабном производстве ветеринарно-медецинских биопрепоратов на этапе получения биомассы должно быть направлено на обеспечение оптимальных условий для роста и размножения конкретного микроорганизма. При всем разнообразии микробиологических подходов (способов) и биотехнологических решений, эффективность биопроизводства на этапе промышленного получения биомассы или продуктов метаболизма микрообганизмов в современных условиях в основном зависит:
Лишь на основе знания теории питания микроорганизмов, закономерностей их роста и накопления в питательной среде можно обеспечить микробиологический контроль за процессами метаболизм в микробной популяции (культуре) и таким образом обеспечить максимальную эффективность этого этапа работы в биотехнологическом процессе производства биопрепаратов. 2.Питательные среды и условия роста микробов. Питательные вещества – это растворенные в воде соединения, из которых микроорганизмы строят свои клетки и получают энергию. Требования, предъявляемые различными микроорганизмами в отношении состава питательной среды и прочих условий весьма разнообразны. В связи с этим было предложено очень много рекомендаций по составлению питательных сред для различных микроорганизмов. В принципе питательные среды должны отвечать следующим минимальным требованиям: в них должны присутствовать все элементы, из которых строится клетка, в такой форме, в которой микроорганизмы способны их усваивать. Потребность в химических элементах. По количественному вкладу в построении клетки различают макро- и микроэлементы. К первым относятся 10 элементов, содержащихся во всех организмах /C,O,H,N,S,P,K,Ca,Mg,Fe /. Микроэлементы или следовые элементы - это Mn, Mb, Zn, Cu, Co, Ni, Wu, Bor, Cl, Селен, Kr, Wf и др. в которых нуждаются не все организмы. Они содержатся чаще в качестве примесей в солях макроэлементов. Большинство химических элементов вносят в питательную среду в виде солей /пример: состав простой синтетической среды/. Источники углерода и энергии. Все патогенные микроорганизмы получают клеточный углерод главным образом из органических веществ. Последние, как правило, служат источником как энергии, так и углерода; частично они ассимилируются для построения клеток, частично окисляются для получения энергии. Из природных органических соединений количественно преобладают полисахариды – целлюлоза и крахмал. Структурные элементы этих полимерных соединений – молекулы глюкозы – могут использоваться многими микроорганизмами. Микроорганизмы способны также использовать и все другие органические соединения, образующиеся естественным путем. Добавочные вещества. Помимо элементов минерального питания и источников углерода и энергии многие организмы нуждаются еще в некоторых дополнительных веществах, называемых факторами роста. Эти вещества входят в основной состав клетки, но некоторые организмы не способны их синтезировать сами. Такие факторы роста относятся к трем группам соединений – к аминокислотам, пуринам и пиримидинам, а также к витаминам. За исключением витаминов, первые три соединения – составные части белков и НК, поэтому клетка нуждается в достаточных количествах этих соединений. Витамины входят в состав коферментов или простотетических групп, и таким образом необходимы только в очень малых количествах. Организмы, нуждающиеся в факторах роста, называют ауксотрофными и противопоставляют их прототрофным организмам, которым такие факторы не нужны. Сера и азот. Оба элемента содержатся в клетке главным образом в восстановленной форме / сульфгидрильные группы, аминогруппы/. Большинство микроорганизмов способно поглощать эти элементы в их окисленной форме, в виде сульфата и нитрата, которые они могут восстанавливать. Наиболее обычный источник азота для микроорганизмов – соли аммония и аминокислоты. Кислород. Многим микроорганизмам, помимо кислорода воды, СО2 и органических веществ, необходим молекулярный кислород /О2/. Главная функция О2 состоит в том, что он служит конечным акцептором электронов при аэробном дыхании, восстанавливаясь при этом до воды. По отношению к молекулярному кислороду можно выделить три группы микроорганизмов: а) Облигатные аэробы – способны получать энергию только путем дыхания и поэтому нуждаются в О2 ; б) Облигатные анаэробы – могут расти только в среде, лишенной О2; в) Факультативные анаэробы растут как в присутствии, так и в отсуствии О2; среди них следует различать два типа: - аэротолерантные молочнокислые бактерии могут расти в присуствии атмосферного О2 , но не способные его использовать – они получают энергию с помощью брожения; - другие факультативно-анаэробные бактерии (Enterobacteriaceae) и многие дрожжи могут переключаться с дыхания (в присутствии О2) на брожение (в отстуствии О2). Многие аэробные бактерии – микроаэрофилы, хотя они и нуждаются в кислороде для получения энергии, однако не переносят того парциального давления О2, которое существует в воздухе (0.20 бар) – им нужно от 0.01 до 0.03 бар. Таким образом, обозначив потребность микроорганизмов в питательных веществах, было установлено, что очень многие нетребовательные микроорганизмы, например, большинство эшерихий, псевдомонад, хорошо растут на простых синтетических средах (глюкоза + соли). Но многим микроорганизмам, в особенности патогенным, сверх того нужны еще какие-то из перечисленных выше микроэлементов, витаминов или других добавок. Если питательный раствор составлен из определенных химических соединений, то говорят о синтетической среде. Исследователи стремятся определить для каждого микроорганизма оптимальные потребности в питательных веществах и составить минимальную среду, содержащую лишь те инградиенты, которые необходимы для роста. Более требовательные виды нуждаются в большом числе добавочных веществ ( >40 компонентов). Сложные среды. У многих, особенно требовательных микроорганизмов, потребности в питательных веществах изучены пока недостаточно. Их культивируют на средах, содержащих дрожжевой экстракт, дрожжевой автолизат, пептон или мясной бульон. Для уменьшения стоимости к питательным растворам часто добавляют вместо чистых соединений весьма сложные смеси, нередко их получают из субпродуктов, вторичного сырья и пр. Такого рода питательные среды называют сложными. Такого рода питательные среды называют сложными. Твердые среды. Для приготовления твердых сред к жидким питательным растворам добавляют особые вещества, которые придают им желеобразную консистенцию. Желатину применяют для этой цели лишь в отдельных случаях из-за слишком низкой точки плавления (26-30*) и, кроме того, разжижается многими микроорганизмами. Почти идеальным средством для получения твердых сред служит агар (полисахарид из морских водорослей) в концентрации 15-20 г/л. Плавится агар только при 100*, но при охлаждении остается жидким вплоть до 45*. Разлагать его способны лишь немногие микроорганизмы. В тех случаях, когда требуются твердые среды, не содержащие органических компонентов, применяют силикагель. Изготовление универсальной среды с одинаковой питательной ценностью для всех патогенных микробов практически неосуществимо, так как индивидуальные потребности отдельных видов крайне разнообразны. Учитывая эти особенности, питательные среды обычно делят на три группы:
В биологической промышленности культивирование микроорганизма осуществляют на специальных средах, основой приготовления которых нередко служат простые питательные среды. Более того, их применяют и самостоятельно для этой цели. Существуют руководства с описанием приготовления простых питательных сред, применяемых для изготовления биоприпаратов. Здесь заслуживает внимания лишь перечисление их названий: 1. Мясная вода; 2 Мясопептонный бульон (МПБ); 3. Мясопептонный печеночный бульон (МППБ); 4. Мясопептонный агар (МПА); 5. Полужидкий агар; 6. Питательная желатина; 7. Основной мясокислотный гидролизат; 8. Гидролизатная среда для культивирования сибиреязвенных микробов; 9. Печеночный бульон на мясном гидролизате для культивирования бацилл эмкара; 10. Печеночный агар на кислотном гидролизате из сгустков крови для культивирования бруцелл. 11. Среды для культивирования микобактерий; 1.2 Основной перевар по Хоттингеру; 13. Питательная среда из свиней; 14. Среды из перевара по Хоттингеру для культивирования сальмонелл; 14. Среды из перевара по Хоттингеру для культивирования микобактерий; 15. Ферментативный перевар мяса по Герману; 16. Пептон Мартена; 17. Среда Китт-Тароцци; 18. Казеиновый гидролизат; 19. Казеиново-мясная среда. В современном биопроизводстве имеется множество модификаций приготовления перечисленных питательных сред, обеспечивающих более интенсивный рост и накопление микробов в процессе промышленного культивирования. 3.Физиология роста и фазы развития микробной популяции в питательной среде. Под ростом понимают необратимое увеличение количества живого вещества, обычно связанное с увеличением с делением клеток. У многоклеточных организмов увеличиваются размеры тела, у одноклеточных растет число клеток. Однако и у одноклеточных следует отличать увеличение числа клеток от увеличения клеточной массы. При определении числа или массы бактерий пользуются обычно гомогенной суспензией клеток в какой-либо жидкой среде и определяют концентрацию бактерий (число клеток на 1мл) или плотность бактерий (в мг/мл). На основе данных об увеличении этих показателей в растущей бактериальной культуре можно вычислить константу скорости деления клеток (ее выражают числом удвоений концентрации бактерий за 1 час) и обратную ей величину – время генерации (интервал времени, за который число клеток удваивается). 3.1 Методы определения числа бактерий и бактериальной массы. Во время роста периодической (статической, без смены среды) бактериальной культуры может не быть строгой пропорциональности между увеличением числа клеток и увеличением бакмассы. Поэтому показатели эти необходимо различать. Определение числа бактерий. В популяции бактерий не все клетки жизнеспособны. Живыми считаются те клетки, которые могут образовывать колонии на/или в/ агаризированной среде, либо суспензию в питательном растворе. Эти жизнесособные клетки выявляют специальными методами, предназначенными для определения числа живых клеток. В общее же число клеток, входят также мертвые или поврежденные клетки. Общее число клеток. Самыми распространенными методами определения общего числа клеток являются: подсчет под микроскопом в тонком слое «счетной камеры», применение электронного счетчика («счетчик Каултера»), нефелометрия (спектрофотометрия) и использование оптических стандартов мутности. Число живых клеток. Обычно подсчитывают число колоний, образуемых жизнеспособными клетками в благоприятных для роста условиях. Существует несколько вариантов метода посева микробов в агар и подсчета числа колоний: а) посев в расплавленный агар на чашки Петри; б) посев на поверхность агара; в) посев в тонком слое агара; г) посев в многослойный агар. Для этой цели можно использовать и метод мембранных фильтров. Профильтровав определенный объем разбавленной культуры через стерильный мембранный фильтр, затем его перегонят на агар или фильтровальную бумагу, пропитанную питательной средой, инкубируют их и подсчитывают число взросших колоний. Определение бактериальной массы. Для оценки урожая обычно взвешивают сырые или сухие отцентрифугированные клетки. При определении интенсивности обмена или ферментативной активности исходят из содержания в клетках белка или азота. Часто выбор метода диктуется такими соображениями как простота или быстрота работы. В повседневной практике предпочтение отдается не прямым, а косвенным методам. Прямые методы. Основаны на определении сырой или сухой биомассы, общего азота (метод микро-Кьельдаля и микродиффузионный). Общего содержания углерода, бактериального белка. Хорошие результаты дают модификации биуретового метода и другие колориметрические методы. Микрометоды основаны на измерении количества характерных компонентов белка: тирозина, триптофана (по Лоури или Фолину). Косвенные методы определения бактериальной массы основаны либо на измерении мутности клеточной суспензии (измерение экстинции, турбидиметрия, нефелометрия), либо на определении показателей интенсивности метаболизма, непосредственно связанное с ростом (поглощение О2, образование СО2, или кислот), которые могут служить адекватной мерой бактериальной массы. К такого рода определениям прибегают в тех случаях, когда другие методы оказываются непригодными, например, при очень малой плотности клеточной суспензии. Для измерения можно применять титрометрические, электрохимические и другие методы. Выбор метода определения числа бактерий и бактериальной массы нередко зависит от того, с какой целью это определение производится и насколько точную характеристику роста микробной популяции необходимо получить. 3.2 Рост бактерий в приодической культуре. В этой части лекции рассмотрим фазы развития микробной популяции в питательных средах в условиях периодической системы их культивирования. Периодической системой культивирования называют систему, в которой после внесения бактерий (засева) в питательную среду не производится ни добавления, ни удаления каких-либо компонентов, кроме газовой фазы. Отсюда следует, что периодическая система может поддерживать размножение клеток в течение ограниченного времени, на протяжении которого состав питательной среды изменяется от благоприятного (оптимального) для их роста до неблагоприятного, вплоть до полного прекращения процесса размножения. Рост в такой «закрытой системе» подчиняется определенным закономерностям. Общую закономерность роста и размножения бактериальной популяции принято показывать графически в виде кривой, отражающей зависимость логарифма числа живых клеток от времени культивирования. Типичная кривая (рис. 1) имеет S-обзразную форму и позваляет различать несколько фаз роста, сменяющих друг друга в определенной последовательности: начальную (или лаг-)фазу, экспоненциальную (или логарифметическую, лог-)фазу, стационарную и фазу отмирания. 1 2 3 4 5 6 7 8 log t(час) 1 2 3 4 5 6 7 8 log Рис. 1 Начальная фаза. Эта фаза охватывает промежуток времени между инокуляцией (момент посева) и достижением максимальной скорости деления микробов. Продолжительность этой фазы зависит главным образом от предшествующих условий культивирования и возраста инокулята,а так же от степени пригодности питательной среды для роста данного микроба. Если инокулят взят из старой культуры, то клеткам приходится сначала адаптироваться к новым условиям путем синтеза РНК, образования рибосом и синтеза ферментов. Если источники энергии и углерода в новой среде отличаются от таковых предшествующей культуры, приспособление к новым условиям может быть связано с синтезом новых ферментов, которые ранее не были нужны и поэтому не синтезировались. Образование новых ферментов индуцируется новым субстратом. Хорошим примером влияния субстрата на синтез ферментов служит так называемая диауксия – явление двуфазного роста или двойного цикла роста наблюдаемое при культивировании Е.coli на средах, содержащих смесь питательных веществ, в частности глюкозы и сорбита (рис.2). Рис. 2
При более глубоком исследовании физиологического состояния микроорганизма в лаг-фазе представляется возможным и целесообразным выделить две стадии: а) Стадия покоя – время от момента посева микробов до начала их роста. Число клеток при этом не увеличивается, а в некоторых случаях - даже уменьшается. Продолжительность её – 1-2 часа; б) Стадия задержки размножения длительностью около 2 час. Клетки в течение этой стадии интенсивно растут, но слабо размножаются. Количественные изменения состава бактериальной клетки во время лаг-фазы сильнее всего затрагивают РНК, содержание которой повышается в 8-12 раз, что указывает на участие РНК в синтезе ферментных белков. Экспоненциальная фаза, или фаза логарифмического роста характеризируется постоянной максимальной скоростью деления клеток. Период генерализации (лат. Generatio – рождение, воспроизведение) – это время между двумя последовательными делениями бактерий – в этой стадии будет постоянным для данного вида, а количество бактерий будет увеличиваться в геометрической прогрессии. Следовательно, после “n” генерации количество клеток в культуре будет равно “2n”. Длительность лог-фазы – обычно 5-6 часов. Величина клеток и количество содержания в них белка у многих бактерий в лог-фазе то же остаются постоянными и в целом микробная популяция состоит из «стандартных клеток». Если увеличение биомассы бактерий, включая белки, РНК, липиды и другие макромолекулы, происходит пропорционально увеличение численности бактериальных клеток, то такое состояние определяют понятием «сбалансированный рост». Поэтому за ростом культуры в стадии «сбалансированного роста» лог-фазы можно следить, пользуясь каким-нибудь одним из этих показателей. За стадией сбалансированного роста уже в лог-фазе наступает стадия отрицательного ускорения, при которой скорость размножения бактерий перестает быть максимальной. В результате число делящихся особей – уменьшается, а число погибших – увеличивается. Ее длительность около 2-х часов. Причина замедления размножения: истощение питательной среды, накопление продуктов метаболизма, увеличение плотности клеточной суспензии и мн.др. В связи с тем, что в экспоненциальной фазе скорость деления клеток относительно постоянна, эта фаза наиболее удобна для определения скорости деления (и скорости роста). Стационарная фаза максимума. В ней число новых живых бактерий почти равно числу отмерших (равновесие). Переход от лог-фазы к стационарной происходит постепенно. Причины замедления роста нами обозначены при описании стадии отрицательного ускорения (нехватка питательной среды, большая плотность бактериальной популяции, низкое порциальное давление О2, накопление токсических продуктов обмена). Все эти факторы вызывают переход к стационарной фазе. Но и в стационарной фазе могут еще происходить такие процессы, как использование запасных веществ, распад части рибосом и синтез ферментов. Наблюдаемая картина зависит от того, какой именно фактор лимитирует рост. Быстро гибнут лишь очень чувствительные клетки, другие – еще долго сохраняют жизнеспособность – до тех пор, пока еще есть возможность получать необходимую для этого энергию в процессе окисления каких-либо запасных веществ или клеточных белков. Количество биомассы, достигнутое в стационарной фазе, называют выходом или урожаем. Урожай зависит от природы и количества используемых питательных веществ, а так же от условий культивировании. Фаза отмирания. В этой фазе можно выделить три стадии? а) стадия ускорения, гибели, характеризующаяся превышением числа отмирающих клеток над количеством вновь образующихся (около 3 часов); б) стадия логарифметической гибели – отмирание клеток происходит с постоянной скоростью ( 5 часов); в) стадия уменьшения скорости отмирании, во время которой оставшиеся в живых клетки переходят в стадию покоя. 3.2.1 Параметры кривой роста микроорганизмов и получение целевого продукта Определение фаз и стадий развития микробной популяции в питательной среде в условиях периодичной культуры имеет не только теоретическое но и большое практическое значение. Так, определяя режимы хранения микробов, рекомендуется использовать культуры в конце фазы логарифмического роста, поскольку они обладают наибольшей жизнеспособностью. Для изготовления вакцин, диагностикумов и любых антигенов используют микробные культуры на определенной фазе кривой роста. Изучение процесса развития микробной популяции в периодической системе культивирования фактически является началом научно-практической работы по микробиологическому синтезу тех или иных продуктов. С этой целью определяется динамика накопления биомассы, или целевого продукта метаболизма, а так же потребление исходного основного сырья (субстрата). Для этого периодически берут пробы из развивающейся культуры с частотой, обеспечивающей возможность установления основных фаз развития микробной популяции. Заканчивают исследования после прекращения роста микробной культуры и максимального накопления целевого продукта. Если при сравнении параметров кривых роста число микроорганизмов (или их биомассы) и накоплением целевого продукта имеется прямая связ, то это свидетельствует о результате биосинтеза его в экспоненционную фазу. Такой продукт микробного метаболизма называют первичным. При отсутствии такой корреляции целевой продукт обычно синтезируется в стационарной фазе и фазе отмирания, т.е. рост микробов заторможен и выросшая биомасса может еще перерабатывать оставшийся неиспользованный субстрат. Этот продукт относят ко второй фазе, а сам процесс синтеза его нередко имеет катаболитический характер и связан с возникновением экстремальных условий для микробной популяции. Но иногда целевой продукт второй фазы начинает синтезироваться еще в лог-фазе, так что подразделение процессов на одно- и двухфазные не носит абсолютного характера. Наличие вторичных продуктов (метаболитов) в отличие от первичных в большинстве своем для жизни микроба-продуцента необязательно. Типичными продуктами второй фазы роста культур являются антибиотики. Вторичными могут быть и продукты энергетического метаболизма. Например, у некоторых бродильных микроорганизмов продуктами первичного метаболизма углеводов часто являются органические кислоты, но при ингибировании роста, создающимися условиями среды, вместо них образуются нейтральные вещества – спирты, кетоны, являщиеся часто целевыми продуктами. Такая двухразность брожения была открыта В.Н.Шапошниковым и распространена затем на другие процессы микробного биосинтеза. Во вторую фазу может осуществляться и сверхсинтез продуктов первой фазы (например, витаминов). При культивировании микроорганизмов, с какой бы целью оно не проводилось, важным является определение таких характеристик, как эффективность или скорость роста, и экономический коэффициент культивирования, или выход биомассы. Скорость роста характеризуется чаще всего удельной скоростью роста, обозначаемой М. Удельная скорость роста (µ) – отношение числа или веса (в граммах) образовавшихся за единицу времени клеток к общему числу или весу (в граммах) клеток. Обычно µ выражают в доле прироста за 1 час. Таким образом, µ = 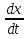 * *  где dx – прирост биомассы за единицу времени = Х2-Х1 dt – промежуток времени, за который определяется dx; х – общее число клеток на момент времени T2. Удельная скорость роста микроорганизмов, когда это необходимо рассчитывается для любой фазы развития периодической культуры, но чаще всего она определяется для фазы логарифмического роста, в которой кривая роста имеет линейный характер. Максимально возможную скорость роста культуры в данных условиях обозначают µ ш. Очевидно, что µ, определенная в фазу логарифмического роста стремится к µ м. Иногда бывает необходимым определять валовую (общую) скорость роста V, которая характеризует абсолютный прирост биомассы за единицу времени: V= 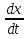 Как µ так и V характеризуют данную культуру в данных условиях культивирования и не являются количественной характеристикой штамма. Скорость роста может характеризоваться также временем удвоения количества биомассы или числа клеток – g (или временем генерации): g = tудв. =  = =  где ln – натуральный логарифм. Экономический коэффициент культивирования или выхода биомассы обозначают «Y» и определяют как отношение веса (в граммах) или числа образованных клеток к весу (в граммах) или концентрации потребленного питательного субстрата. Y= 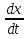 где  - увеличение количества биомассы, соответствующее потреблению субстрата в количестве - увеличение количества биомассы, соответствующее потреблению субстрата в количестве  . .У периодических культур определяется средняя величина за период роста. Вычтя из количества выросшей биомассы «Х» количество посевного материала «Х0» и поделив количество потребленного питательного вещества, получим: Yср. =  где S0 – концентрация питательного вещества в исходной среде; S – остаточная концентрация питательного вещества. Экономический коэффициент может определяться за резные сроки культивирования. Обычно конкретный штамм характеризуют по Yср. =  в период фазы логарифмического роста. При замедлении скорости роста в лог – фазу вследствие недостатка какого – либо компонента питательной среды (лимитирования) или из-за накопления неблагоприятных для роста метаболитов в среде (ингибирования) экономический коэффициент снижается. Экономический коэффициент может рассчитываться в отношении потребления любого субстрата, прежде всего углеродного, а также и в отношении кислорода и вообще любого компонента питания. 3.2.2. Влияние концентрации питательных веществ на скорость роста. Рассмотренная нами кривая роста микробной популяции при периодической системе культивирования наиболее близка к реальному процессу асинхронного, или неоднородного деления клеток данной культуры. При этом, одновременно с ростом биомассы одних клеток, происходит увеличение числа клеток в популяции за счет деления других и постоянная утилизация субстратов питательной среды. Такой рост возможен лишь в том случае, если питательная среда сбалансирована по всем компонентам, необходимым бактериальной клетке для роста и размножения. Следовательно, нелимитированность питательной среды по какому-либо питательному компоненту – одно из основных обязательных условий максимального роста микробной популяции. Если же питательная среда лимитирована по какому-либо питательному компоненту, то скорость роста замедляется вплоть до полной остановки роста после полной утилизации этого компонента. Иногда в комплексной питательной среде бактериальные клетки используют имеющиеся субстраты последовательно. Это происходит тогда, когда присутствие одного субстрата в среде приводит к подавлению синтеза фермента, участвующего в метаболизме других питательных веществ. В этих условиях «подавляемые» ферменты начинают синтезироваться и осуществлять метаболизм лишь тогда, когда ингибирующий (подавляющий) их субстрат будет израсходован бактериальными клетками. Такая регуляция физиологии бактерий концентрацией питательных веществ в субстрате приводит к изменениям в скорости роста, а следовательно, и в кривой роста, на которой появляется одна или несколько переходных (т.е. временных) стационарных фаз. Классическим примером такого роста может служить рост E.coli в присутствии глюкозы и лактозы. Сначала происходит рост культуры за счет использования глюкозы. После расхода этого субстрата кривая роста резко меняет свой наклон. Во время этой лог-фазы происходит включение новой ферментной системы, участвующей в метаболизме лактозы, и накоплении биомассы продолжается за счет потребления этого сахара. 1 2 3 1.Использование глюкозы 2.Образование новой ферментной системы 3.Использование лактозы Концентрацией питательных веществ в среде можно влиять на только на скорость роста, но и на процессы биосинтеза тех или иных продуктов метаболизма. Такое изменение биосинтеза, как теперь известно, связанно с определенными фазами развития культуры (первичные и вторичные метаболиты). Если речь идет о первичных метаболитах, т.е. о веществах синтез которых связан сростом и размножением микробных клеток, то различными способами удлиняют фазу логарифмического роста, прибегая к полупрочному или проточному культивированию (вместо периодического). Если целевым продуктом являются вторичные метаболиты (вещества синтезируемые при замедлении размножения микробов), то меняя параметры культивирования, концентрацию тех или иных питательных веществ добиваются неоптимальных условий для роста, но оптимальных для биосинтеза определенного продукта. Для этого некоторые компоненты питательной среды должны быть в недостатке, чтобы основное сходное сырье перерабатывалось биомассой в целевой продукт. До недавнего времени лимитирующие рост факторы выявляли только путем эмпирического поиска и обнаруживались методом проб и ошибок. Так, установлено, что многие антибиотики, образуемые актиномицетами, синтезируются при лимитации роста продуцентов недостатком роста фосфора, для биосинтеза пенициллина – требуется лимитация роста культур глюкозой, а для грамицидина С – молекулярным кислородом. В последнее время для поиска лимитирующих компонентов питательной среды используют наборы синтетических сред с различными лимитирующими веществами, а также прибегают к математическому моделированию и планированию экспериментов. 3.2.3. Влияние синхронизации клеточного деления на микробную популяцию. Кривые роста, предоставленные в виде зависимости числа клеток от времени культивирования иногда показывают необычно быстрое увеличение числа клеток сразу после лаг-фазы, вслед за чем скорость накопления клеток понижается. Такое необычное значительное ускорение роста связанно с частичной или полной синхронизацией деления клеток в культуре. Синхронный рост может быть обусловлен приспособлением культуры к новому питательному субстрату, после чего происходит одновременное деление клеток, в результате одновременного прорастания спор в вегетативные клетки. Затем синхронность культуры быстро нарушается и через 2-3 генерации преобладает обычный асинхронный рост. В настоящее время разработаны специальные методы, с помощью которых можно синхронизировать деление клеток в растущей популяции, так что рост популяции соответствует росту отдельных клеток. К синхронизации роста в периодическом режиме культивирования чаще всего прибегают с целью изучения метаболических процессов, связанных с определенными этапами цикла развития индивидуальных клеток. Синхронизация культуры наступает в том случае, когда все клетки начинают делиться с почти одинаковой скоростью При этом зависимость логарифма числа клеток от длительности культивирования приобретает ступенчатый характер в отличии от линейного при обычном асинхронном росте в периодическом режиме культивирования. t(час) log 0 1 2 |
