лекция 1-2 по аналитической химии. Лекция Введение. Предмет Аналитической химии
 Скачать 123.37 Kb. Скачать 123.37 Kb.
|
|
Лекция 1. Введение. Предмет «Аналитической химии», ее значение и задачи. Объекты аналитического анализа. Методы химического анализа. Основные характеристики методов. Требования, предъявляемые к анализу веществ. Аналитическая химия - это раздел химической науки, разрабатывающий на основе фундаментальных законов химии и физики принципиальные методы и приёмы качественного и количественного анализа (наука о методах определения качественного и количественного состава вещества). Под химическим анализом понимают совокупность действий, которые имеют своей целью получение информации о химическом составе объекта. Предмет аналитической химии - разработка методов анализа, их практическое выполнение, определение состава веществ, изучение физических свойств веществ. Задачи: 1. развитие теории методов анализа. 2. разработка и совершенствование методов анализа. 3. обеспечение химико-аналитического контроля в процессе проведения научно-исследовательских работ. Предмет аналитической химии– разработка методов анализа и их практическое применение. Объекты анализа по происхождению (объекты окружающей среды и пром. производства, металлы, сплавы, руды, минералы) по агрегатному состоянию (ж, г, тв) по хим. природе (неорг., орган., биолог.) по степени распространенности и важности. Большое место отводится в АХ поиску новых современных методов анализа, с использованием новых достижений науки и техники. Анализ имеет большое значение для разных отраслей, в том числе и медицины. Химический анализ – это получение опытным путем данных о составе и свойствах объектов. Впервые это понятие научно обосновал Р. Бойль в книге «Химик-скептик» (1661 г.) и ввел термин «анализ». Аналитическая химия базируется на знаниях, полученных при изучении курсов неорганической, органической, физической химии, физики и математики. В зависимости от поставленной задачи определяют элементный, молекулярный, фазовый, изотопный, вещественный состав и т.д. В зависимости от вида идентифицируемых частиц различают: элементный, молекулярный, функциональный, изотопный и фазовый анализы. Элементный анализ – это качественный и (чаще всего) количественный химический анализ, в результате которого определяют, какие химические элементы и в каких количественных соотношениях входят в состав анализируемого вещества. Функциональный анализ – открытие и определение различных функциональных групп, например, аминогруппы NH2, нитрогруппы NO2, карбонильной С=О, карбоксильной СООН, гидроксильной ОН, нитрильной СN групп и др. Молекулярный анализ – открытие молекул и определение молекулярного состава анализируемого вещества, т.е. выяснение того, из каких молекул и в каких количественных соотношениях состоит данный анализируемый объект. Фазовый анализ – открытие и определение различных фаз (твердых, жидких, газообразных), входящих в данную анализируемую систему. В зависимости от массы сухого вещества или объема раствора анализируемого вещества методы анализа подразделяются на: макро-, полумикро-, микро- и т д. Для химической идентификации чаще всего используют реакции образования окрашенных соединений, выделение или растворение осадков, газов, образование кристаллов характерной формы, окрашивание пламени газовой горелки образование соединений, люминесцирующих в растворах. Окрашивание пламени газовой горелки соединениями металлов используется в качественном анализе для открытия катионов металлов, дающих излучение в видимой области спектра. Основные этапы анализа. обоснование и выбор метода (методики) анализа. Выбирают такой метод анализа, отвечающий требованиям точности, экспрессности и экономичности. отбор и усреднение пробы. Проба, поступающая на анализы должна быть представительной, т.е. реально отражать средний состав анализируемого вещества. взятие навески (используют аналитические весы). подготовка пробы к анализу (проведение таких операций, как растворение, концентрирование, сплавление, разделение, осаждение) при всем этом меняется состав пробы – желательно эту стадию избегать. Количественное измерение: измеряют величину аналитического сигнала – физическая величина, функционально связанная с содержанием определяемого компонента. Ас – масса вещества (гравиметр.а), объем реактива (титрим.а), скорость реакции, электрич. проводимость, сила тока. Про аналитическую химию говорят, что это наука о методах и средствах химического анализа и в известной мере установления химического строения. Под средствами подразумевают приборы, реактивы, стандартные образцы, программы для компьютеров и т.д. Методы и средства постоянно изменяются: привлекаются новые подходы, используются новые принципы явления из разных областей знаний. Аналитическая химия это сфера научного поиска, так за создание многих методов анализа присуждены Нобелевские премии (органический микроанализ, полярография, разные виды хроматографического анализа, фотоэлектронная спектроскопия и д. д.). Следует различать метод и методику анализа. Метод анализа вещества – это краткое определение принципов положенных в основу анализа вещества. Методика анализа – это подробное описание всех условий и операций, которые обеспечивают правильность, воспроизводимость и другие регламентированные характеристики результатов анализа. Правильность анализа характеризует качество анализа, отражающее близость к нулю систематической погрешности результатов. Под анализом подразумевают получение опытным путем данных о химическом составе и количестве вещества любыми методами – физическими, химическими, и физико-химическими. Современная аналитическая химия включает в себя три раздела: качественный химический анализ, количественный химический анализ и инструментальные, т.е. физические и физико-химические методы. Качественный химический анализ – это определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе. Количественный химический анализ – это определение количественного состава, т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе. При проведении качественного и количественного анализов используют аналитические признаки веществ и аналитические реакции. Аналитические признаки – это свойства анализируемого вещества или продуктов его превращения, которые позволяют судить о наличии в нём тех или иных компонентов. Характерные аналитические признаки – цвет, запах, угол вращения плоскости поляризации света, радиоактивность, способность к взаимодействию с электромагнитным излучением и др. Аналитическая реакция – это химическое превращение анализируемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками. Чаще всего используют реакции: Образования окрашенных соединений Выделение или растворение осадков Выделение газов Образование кристаллов характерной формы Окрашивание пламени газовой горелки Образование соединений, люминесцирующих в растворах. На результаты проведения аналитических реакций влияют температура, концентрация растворов, pH среды, присутствие других веществ (мешающих, маскирующих, катализирующих процессы). Методы анализа (совокупность принципов, положенных в основу анализа без относительно к конкретному объекту) группы методов: м. отбора и разложения пробы м. маскирования, разделения и концентрирования компонентов м. обнаружения (идентификации) м. определения – имеют наибольшее практическое значение Методы определения
ФХМА делятся на: электрохимические: изучает процессы на электродах и в межэлектродном пространстве (потенциометрия, кондуктометрия, вольтамперометрия) оптические: основаны на взаимодействии молекул вещества с электромагнитным излучением (фотометрия, спектрофотометрия, люминисцентный м.а) методы разделения (хроматография) ядернофизические (основаны на методе радиоактивности) спектроскопические (основан на поглощении или испускании света атомами определяемого вещества) - атомноадсорбционный, пламенная фотометрия, ИК-спектроскопия, рентгеновские методы, масс-спектроскопич. м, ЭПР, ЯМР. Характеристики методов анализа (требования): 1. Точность анализа определяется суммой правильности и воспроизводимости. Правильность – отклонение рез-та анализа от истинного значения измеряемой величины (погрешность - абсолютная и относительная), воспроизводимость – степень близости по рез-ту измерений, полученного в разн. условиях, т.е в разное время, разными методами, в разных лабораториях. 2. Избирательность, селективность – возможность определения какого-то вещества (иона) в присутствии других. 3. универсальность – возможность проводить анализ многокомпонентных систем 4. Чувствительность – минимальное кол-во компонента, которое можно обнаружить или определить данным методом. 5. экспрессность – быстрота проведения анализа Лекция 2. Растворы. Химическое равновесие. Закон действующих масс. Кислотно-основное равновесие. Равновесие в гетерогенной системе раствор – осадок. Большинство аналитических реакций протекает в растворах, поэтому основным фундаментом аналитической химии является теория растворов. Раствор – однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов. От механической смеси раствор отличается однородностью, от химического соединения – непостоянством состава. Растворителем называют вещество, частицы которого преобладают в растворе, при этом остальные компоненты раствора называют растворёнными веществами. В зависимости от агрегатного состояния раствор может быть газовым (то же, что смесь газов), жидким или твёрдым. Химическое взаимодействие растворенного вещества с растворителем в некоторых случаях приводит к диссоциации. Ионы, образовавшиеся в результате диссоциации, или недиссоциированные молекулы часто взаимодействуют с растворителем с образованием структур, которые называются сольватами (гидратами, если речь о водных растворах). Этот процесс называют сольватацией (гидратацией). Ионизация - превращение нейтральных атомов или молекул в ионы под влиянием химических процессов, под действием ионизирующих активных излучений, высоких температур и др. Растворение – переход молекул вещества из одной фазы в другую (растворенное состояние). Происходит в результате взаимодействия атомов или молекул растворителя и растворённого вещества. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда – цвет, и другие) меняются. Электролиты – вещества, проводящие в расплавах или водных растворах электрический ток. При растворении в полярных растворителях (к которым относится и вода) диссоциируют на ионы. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам – большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, то есть долей распавшихся молекул электролита.
Закон действующих масс открыли в 1864 году норвежские учёные. Данный закон устанавливает связь между скоростью и молярными концентрациями (действующими массами), участвующими в обратимой химической реакции. Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Скорость этой реакции прямо пропорциональна произведению концентраций реагирующих веществ. А+В→C+D V1=k1[A][B] где k1 – коэффициент пропорциональности, равный скорости реакции при концентрациях реагирующих веществ 1 моль/л и называемый константой скорости реакции; [A], [B] – молярные концентрации веществ А и В. В результате обратной реакции образуются исходные вещества C+D→A+B V2=k2[C][D] Скорость этой обратной реакции прямо пропорциональна произведению концентраций образовавшихся веществ при прямой химической реакции, то есть C и D. где k2 – константа скорости обратной реакции; [C] и [D] – молярные концентрации веществ C и D. При достижении определённых концентраций веществ A,B, C и D, скорости прямой и обратной реакций уравниваются – наступает химическое равновесие. A+B↔C+D При равновесии v1 = v2 поэтому k1[A][B] = k2[C][D]. Поскольку k1 и k2 для участвующих в реакции веществ при неизменной температуре ¬ постоянные величины, то и отношение их величина постоянная. Обычно ее обозначают К и называют константой равновесия химической реакции. 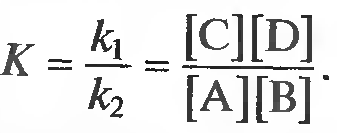 Закон можно сформулировать так: при обратимых реакциях равновесие наступает, когда отношение произведения концентраций образующихся веществ к произведению концентраций вступающих в реакцию веществ становится равным некоторой постоянной для данной химической реакции величине, называющейся константой химического равновесия При составлении уравнений для констант равновесия учитывают только вещества (атомы, ионы, молекулы, радикалы), которые находятся в реакционном объёме. Если реагирующие или образующиеся вещества уходят из реакционного объёма (выпадают в осадок, выделяются в виде газа), то их не учитывают в уравнении константы равновесия, подразумевая, что они эффективно входят в К. 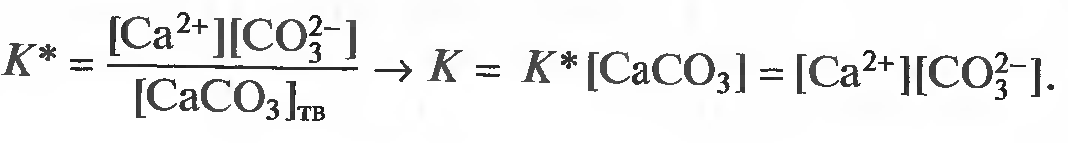 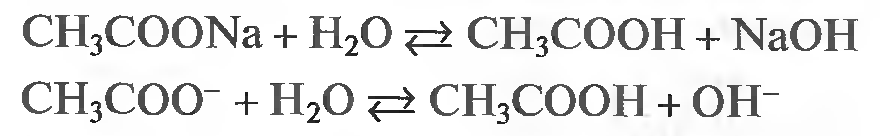 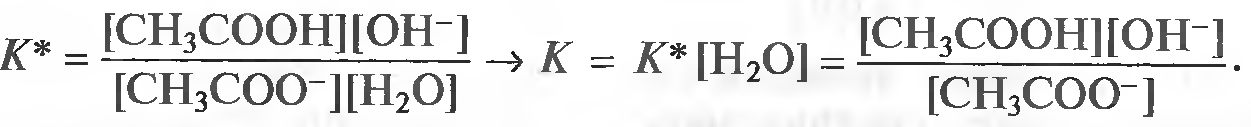 Знание константы равновесия химической реакции позволяет - предсказать направление ее протекания при существующих условиях, сделать вывод о преобладании прямой или обратной реакции в системе: при К > 1 числитель (произведение концентраций продуктов реакции) больше знаменателя (произведения концентраций исходных веществ) преобладает прямая реакция, при К < 1 - обратная; - рассчитать степень протекания (выход) реакции, найти отношение количества вещества, образовавшеrося в результате ее протекания в данных условиях, к количеству вещества, которое должно бьло бы образоваться при условии ее протекания до конца; - рассчитать концентрацию каждоrо из участников реакции в условиях равновесия при известных начальных концентрациях; - оценить влияние на равновесие изменения концентрации каждоrо из реаrирующих веществ, т.е. управлять направлением сдвиrа равновесия; - оценить применимость химической реакции для целей aнaлиза. Например, для количественного анализа применимы только реакции, константа равновесия которых К > 1 * 108. Пример. При некоторой температуре в системе 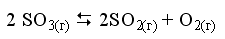 равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л. Рассчитать KС реакции. 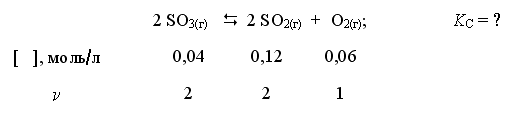 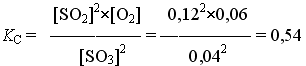 Ответ. Для данной реакции Kc = 0,54 Типы равновесий Гомогенная система – однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путём. В гомогенных смесях составные части нельзя обнаружить ни визуально, ни с помощью оптических приборов, поскольку вещества находятся в раздробленном состоянии на микроуровне. Гомогенными смесями являются смеси любых газов и истинные растворы, а также смеси некоторых жидкостей и твердых веществ, например сплавы. Гетерогенная система – неоднородная система, состоящая из двух и более однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам. Фазы гетерогенной системы можно отделить друг от друга механическими методами (отстаиванием, фильтрованием и т.п.). Примерами гетерогенных систем могут служить: жидкость – насыщенный пар; насыщенный раствор с осадком; многие сплавы Типы гетерогенных равновесий Гетерогенные системы применяются в операциях разделения, концентрирования и определения компонентов. В зависимости от того, какие две фазы используют при анализе, выделяют следующие гетерогенные системы: жидкая + твердая – Ж+Т (осаждение, адсорбция); Осаждение – это образование твердого осадка в растворе в ходе химической реакции при добавлении соответствующих реагентов. По окончании реакции, образовавшийся сухой остаток называют преципитатом (от лат. praecipitatio – стремительное падение), а жидкость выше него – супернатантом. жидкая + жидкая – Ж+Ж (экстракция, абсорбция); Экстракция (от лат. extraho – извлекаю) – это извлечение вещества из раствора с помощью растворителя (экстрагента), практически не смешивающегося с исходной смесью. газовая + твердая – Г+Т (сублимация, адсорбция); Сублимация (возгонка, от лат. sublimo – возносить) – переход вещества из твёрдого состояния сразу в газообразное, минуя стадию плавления (перехода в жидкое состояние). газовая + жидкая – Г+Ж (дистилляция, абсорбция). Дистилляция (лат. stillare – стекание каплями) – перегонка, испарение жидкости с последующим охлаждением и конденсацией паров. Рассмотрим гетерогенное равновесие раствор – осадок Важные замечания: 1) Для гетерогенных процессов при записи уравнений реакций необходимо указывать, к какой фазе относится каждый компонент; 2) Для гетерогенных процессов при записи уравнений реакций с участием ионов необходимо следить за тем, чтобы электронейтральность фаз не нарушалась. Гетерогенные системы раствор – осадок используются как для разделения и концентрирования компонентов, так и для их количественного определения (гравиметрия, осадительное титрование). Растворимость – свойство вещества растворяться в воде или другом растворителе. Выражается константой растворимости (KS ), которая показывает, какая масса вещества может раствориться в 100 г растворителя при данной температуре. Мерой растворимости (S) вещества при данных условиях является его содержание в насыщенном растворе. Вещества: Хорошо растворимые в воде (Р) - KS >10г/100г воды Малорастворимые в воде (М) - KS < 1г/100г воды Практически нерастворимые в воде (Н) - KS < 0,01г/100г воды Основные параметры для расчетов различных типов равновесий Равновесие раствор – труднорастворимый осадок (малорастворимый осадок) MnAm тв ⇄ MnAm раствор ⇄ nMm+ + mAn– n m KS = [Mm+ ] · [An– ] KS – произведение растворимости M – металл A – анион [Mm+ ] – равновесная концентрация ионов металла в растворе CM – общая (аналитическая) концентрация металла – сумма всех форм, присутствующих в растворе. Произведение растворимости (ПР, KS) – произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости – величина постоянная (константа для каждого малорастворимого соединения). При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Комплексообразование. Добавление лигандов (L) к раствору, содержащему ионы металла– комплексообразователя (1) M + L ⇄ ML β1= [ML] [M][L] (2) M + 2L ⇄ ML2 β2= [ML2] [M][L]² (n) M + nL ⇄ MLn βn= [MLn] [M][L]ⁿ – константа устойчивости (образования) комплекса Металл распределен в растворе по разным формам, при этом общая концентрация (аналитическая концентрация) равна CM. ФМ – функция Ледена (Функция закомплексованности металла) – это отношение общей концентрации иона металла к равновесной концентрации его незакомплексованной формы. Характеризует глубину закомплексованности металла СМ = [M] · ФМ ФМ 1 – всегда! ФМ = 1 – если закомплексованности нет, т.е. весь металл находится в растворе в виде ионов. Кислотно-основные равновесия Одноосновная кислота: HA ⇄ H+ + A– Константа диссоциации кислоты (Ka ) – константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. [H+][A-] Ka= [HA] Кислотно-основные равновесия Двухосновная кислота: (1) H2A ⇄ HА– + Н+ [H+][HA-] Ka1= [HA] (2) HA– ⇄ А²– + Н+ [H+][A²-] Ka2= [HA-] На практике часто возникает необходимость влияния на растворимость (S) осадков. Так, для увеличения полноты осаждения процесс следует вести в условиях, при которых растворимость осадка минимальна. В тех случаях, когда в растворе могут протекать конкурирующие равновесия, в частности для предотвращения выпадения осадка мешающего компонента, необходимо выбрать условия, при которых растворимость осадка мешающего иона максимальна и значение KS для него не достигается. Такой подход – маскирование мешающего иона – позволяет получить осадок нужного компонента в чистом виде. | |||||||||||||||||||||||
