Фотометрическое определение железа в питьевой воде. Литературный обзор. 1 Основные понятия фотометрии. 2 Классификация методов фотометрического анализа
 Скачать 7.78 Mb. Скачать 7.78 Mb.
|
1 2 Методы отбора проб- пробы воды отбирали по ГОСТ 2874 объем пробы воды для измерения массовой концентрации железа должен быть не менее 200 см3. способы консервирования, сроки и условия хранения проб воды, предназначенных для измерения массовой концентрации общего железа, - по ГОСТ 24481 [8]. Измерение массовой концентрации общего железа с сульфосалициловой кислотой. Фотометрический метод определения массовой концентрации общего железа основан на образовании сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа 3+ (красное окрашивание), а в слабощелочной среде с солями железа (2+) и (3+) (желтое окрашивание). Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны λ=425 нм, для железа (3+), при длине волны λ=500 нм. .2 Оборудование и реактивы спектрофотометр или фотоэлектроколориметр, позволяющий измерять оптическую плотность при длине волны λ=425 и λ=500 нм. кюветы с толщиной рабочего слоя 10-50 мм. весы аналитические лабораторные, класс точности 1, 2 по ГОСТ 24104 колбы мерные 2-го класса, вместимостью 50, 100, 1000 см3 по ГОСТ 1770 пипетки мерные без делений вместимостью 50 см3 и пипетки мерные с ценой наименьшего деления 0,1-0,05 см3, вместимостью 1, 5 и 10 см3 2-го класса по нормативно-техническому документу ГОСТ 29227. колбы стеклянные лабораторные конические номинальной вместимостью 100 см3, типа Кн по ГОСТ 25336. кислота азотная, ГОСТ 4461 кислота серная, ГОСТ 4204 аммоний хлористый по ГОСТ 3773. аммиак водный по ГОСТ 3760, 25 %-ный раствор. квасцы железоаммонийные по нормативно-техническому документу ТУ 6-09-5359 или ГОСТ 4205. кислота соляная по ГОСТ 3118. кислота сульфосалициловая по ГОСТ 4478. вода дистиллированная по ГОСТ 6709 настрий хлористый, ГОСТ 4233 бумага индикаторная универсальная, ТУ-6-09-1181 Все реактивы, используемые для анализа, должны быть квалификации химически чистые (х. ч.) или чистые для анализа (ч.д.а). .3 Методика проведения анализа Подготовка прибора Подготовку спектрофотометра или фотоэлектроколориметра к работе проводили в соответствии с рабочей инструкцией по эксплуатации прибора. Приготовление растворов Приготовление 20%-ного раствора сульфосалициловой кислоты. (20,0 г) сульфосалициловой кислоты растворили в мерной колбе вместимостью 100 см3 в небольшом количестве дистиллированной воды и довели этой водой до метки. Приготовление раствора аммиака (1:1) см3 25 %-ного раствора аммиака прилили к 100 см3 дистиллированной воды и перемешали. Приготовление раствора хлористого аммония молярной концентрации 2 моль/дм3 107 г NH4Cl растворили в мерной колбе вместимостью 1 дм3 в небольшом количестве дистиллированной воды и довели этой водой до метки. Срок хранения- 1 неделя. Приготовление основного стандартного раствора железа из ГСО с аттестованным содержанием Раствор готовили в соответствии с прилагаемой к образцу инструкцией 1 дм3 раствора должен содержать 100 мг железа. Срок и условия хранения раствора - по ГОСТ 4212 -один месяц. Приготовление рабочего стандартного раствора железа Рабочий раствор готовили в день проведения анализа разбавлением основного раствора в 10 раз дистиллированной водой. Построение градуировочного графика. Для построения градуировочного графика приготовили образцы для градуировки с массовой концентрацией железа от 0,1 до 10,00 мг/дм3. В мерные колбы на 100 см3 поместили рабочий раствор железа с концентрацией 0,00; 0,01; 0,02; 0,03; 0,04; 0 05 мг/см3 или аликвотная часть раствора (см3) 0,1,2,3,4,5, прилили 2,0 см3 аммония хлористого, 2,0 см3 сульфосалициловой кислоты, 2.0 см3 аммиака рН раствора должен составлять 7-8 (по индикаторной бумаге). Довели до метки дистиллированной водой. Тщательно перемешали и оставили на 5 мин до развития окраски. Оптическую плотность полученного раствора измеряли по длине волны λ=425 нм в кювете с длиной поглощающего слоя 50 мм по отношению к холостому раствору, проведенному с дистиллированной водой через весь ход анализа. По градуировочному графику находили содержание железа общего. Анализ образцов для градуировки провели в порядке возрастания их концентрации. Для построения градуировочного графика каждую искусственную смесь необходимо фотометрировать 3 раза с целью исключения случайных результатов и усреднения данных. При построении градуировочного графика по оси ординат откладывали значения оптической плотности, а по оси абсцисс - величину концентрации вещества в мл/дм3. Определение можно проводить только в тех случаях, когда пробу не обрабатывали, с целью разрушения органических компонентов, и не кипятили, т. к. при этом железо (2+) окисляется до железа (3+). Приготовление анализируемого раствора Пробу объемом 80,0 см3 и менее, в зависимости от концентрации, поместили в мерную колбу вместимостью 100 см3, нейтрализовали раствором аммиака до рН 3-5 по индикаторной бумаге, прибавили 2 см3 сульфосалициловой кислоты, довели до метки дистиллированной водой. Тщательно перемешали и оставили на 5 мин до полного развития окраски. Оптическую плотность полученного раствора измерили при длине волны λ=425 нмв кювете с длинной поглощающего слоя 10-50 мм по отношению к холостому раствору, проведенного таким же образом с дистиллированной водой. По градуировочному графику нашли содержание железа общего [10]. Глава 3. Результаты и их обсуждения Для определения железа общего и железа (III) в неокрашенных и слабоокрашенных поверхностных и очищенных сточных водах в диапазоне концентраций 0,4 - 9 мг/дм3 для Fe(III) и 0,2 - 9 мг/дм3 для Fe общего использовали фотометрический метод. Метод основан на том, что сульфосалициловая кислота или ее натриевая соль образуют с солями железа окрашенные комплексные соединения, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа (III) (красное окрашивание), а в слабощелочной среде с солями железа (III) и железа (II) (желтое окрашивание) [9]. Измерили оптическую плотность полученного (анализируемого) раствора при длине волны λ=425 нм в кювете с длинной поглощающего слоя 50 мм (т.к. окраска раствора более заметна) по отношению к холостому раствору, проведенного таким же образом с дистиллированной водой. А=0,193 Построение градуировочного графика (рисунок 3.1) 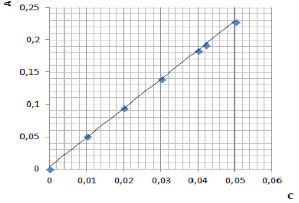 Рисунок 3.1 - Градуировочный график для определения концентрации По градуировочному графику нашли концентрацию железа С=0,042 мг/дм3; Содержание железа рассчитали по формуле (6): Fe(3+)= Fe(3+)=0,525 где Х - содержание железа, мг/дм3; С - концентрация железа, найденная по градуировочному графику, мг/дм3; - объем, до которого была разбавлена проба, см3;- объем, взятый для анализа, см3 [15]. Исходя из закона Бугера-Ламберта-Бера, основными оптимизируемыми параметрами фотометрического определения являются концентрационный диапазон, длина волны и толщина кюветы. Длину волны выбирали исходя из известного значения максимума поглощения окрашенного соединения и его близости к длине волны имеющегося светодиода на модуле «Фотоколориметр». Для оптимизации концентрационного диапазона определения загрязняющих веществ, соответствующего нормам ПДК, была выбрана кювета с l=5 см. При необходимости снижения или увеличения диапазона определяемых концентраций можно использовать кюветы толщиной 1 и 5 см [4, с. 20]. Качество выполнения фотометрического анализа характеризуется показателями повторяемости, точности, внутрилабораторной прецезионности. Указанные метрологические характеристики методик были рассчитаны по ГОСТ РИСО 5725 [7]. В нормативных документах, устанавливающих требования к природным источникам питьевого водоснабжения, приводится предельно допустимая концентрация «железа общего», которая составляет 0,3 мг/дм3. Содержание железа Fe(3+)=0,525 Выводы фотометрический железо кислота светопоглощение 1. Установлено, что фотометрические методы анализа применяются для определения многих элементов периодической системы, главным образом металлов и имеют большое значение в аналитическом контроле окружающей среды и решении экологических проблем [6]. Аппаратура, используемая в этих видах анализа, как правило, очень легка в эксплуатации, практически не требует особых навыков работы с ней, получаемые результаты достаточно хорошо воспроизводимы. В настоящее время, когда цена на новое оборудование, к сожалению, исчисляется в десятках тысяч (в лучшем случае рублей), на многих заводах, лабораториях, институтах используются фотоэлектроколориметры. . Рассмотрен фотометрический метод определения массовой концентрации общего железа. Он основан на образовании с сульфосалициловой кислотой или ее натриевой солью с солями железа окрашенных комплексных соединений, причем в слабокислой среде сульфосалициловая кислота реагирует только с солями железа 3+ (красное окрашивание), а в слабощелочной среде с солями железа (2+) и (3+) (желтое окрашивание). Оптическую плотность окрашенного комплекса для железа общего измеряют при длине волны λ=425 нм, для железа (3+), при длине волны λ=500 нм. 3. В работе проведен анализ питьевой воды- фотометрическим методом. По результатам определили содержание железа Fe3+= 0,525 мг/дм3, что не соответствует действующему законодательству, т. к. в соответствии с санитарными правилами и нормами СанПиН 2.1.4. 1074-01 Список использованных источников 1. Долгов, В.В., Ованесов, Е.Н., Щетникович, К.А., Фотометрия в лабораторной практике. М.: Высшая школа, 2004. . Бабко, А.К., Пилипенко, А.Т. Фотометрический анализ. М.: Химия, 1968.- с. . Чакчир, Б.А., Алексеева, Г.М. Фотометрические методы анализа: Методические указания.- СПб.: Изд-во СПХФА, 2002. - 44 с. . Морозова, В.В., Ларионова, Е.В., Апробация фотометрических методик определения некоторых загрязнителей окружающей среды / В.В. Морозова, Е.В. Ларионова // Вестник науки Сибири. - 2014. - № 1(11). - С. 17-24. . Бабаев, Ахмед Касум оглы. Фотометрическое определение железа (III) и некоторых сопутствующих элементов В-дикетонами и их азометиновыми производными: Дисс., канд. хим. наук. Баку, 1984. - 195 с. . Фотометрический метод анализа и применение его в лабораторной практике. http://www.bibliofond.ru/view.aspx?id=517577 . ГОСТ Р ИСО 5725-2002. Точность (правильность и прецизионность) методов и результатов измерений: в 6 ч. - Введ. 23.04.02. - М.: Госстандарт России, 2002. . Лурье, Ю.Ю. Справочник по аналитической химии. М.: «Химия», 1979. - 480 с. . Шарло, Г. Методы аналитической химии. М.: «Химия»,1969. - Ч.2. - 763 с. . Пат. 37223 Многофункциональный электрохимический комплекс / Бакибаев, А.А.; Мержа, А.Н. и др.; заявитель и патентообладатель Томский политехнический университет - № 2003136535/20(22); приоритет 17.12.2013. . Поляк, Л.Я. Фотометрический анализ / Поляк. Л.Я // Вестник науки Сибири. - 2012. - № 5(8). - С. 198-208. . Коренман, И.М. Фотометрический анализ. Методы определения органических веществ. М.: «Химия», 1970. - 342 с. . Булатов, М.И., Калинкин, И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам. М.: «Химия», . - 378 с. . Кеслер, И. Методы инфракрасной спектроскопии в химическом анализе. Пер. с нем. под ред. М.М. Кусанова. М.: «Мир», 1964. - 286 с. . Аналитическая химия. Лабораторная работа «Фотометрическое определение железа с сульфосалициловой кислотой». http://kit.chem.kemsu.ru/Posobiya/Analit1/paper/Praktikum/3.5.html . Марченко, 3. Фотометрическое определение элементов. М.: Мир, 1971. - с. 162. 1 2 |
