Фотометрическое определение железа в питьевой воде. Литературный обзор. 1 Основные понятия фотометрии. 2 Классификация методов фотометрического анализа
 Скачать 7.78 Mb. Скачать 7.78 Mb.
|
1 2
10-15 л · моль-1 · см-1. Переходами между d или f-орбиталями обусловлена окраска соединений.Содержание Введение Глава 1. Литературный обзор .1 Основные понятия фотометрии .2 Классификация методов фотометрического анализа .3 Спектры поглощения .3.1 Происхождение молекулярных спектров поглощения .3.2 Основные характеристики полосы поглощения .3.3 Основной закон светопоглощения .4 Аппаратура и техника фотометрических измерений .4.1 Основные узлы приборов для фотометрических измерений .4.2 Фотоэлектроколориметры .4.3 Спектрофотометры .5 Качественный и количественный анализ методом фотометрии Глава 2. Экспериментальная часть .1 Сущность и методика фотометрического определения железа с сульфосалициловой кислотой .2 Оборудование и реактивы .3 Методика проведения анализа Глава 3. Результаты и их обсуждение Выводы Список использованных источников Введение Актуальность работы. Проблема загрязнения природных вод в настоящее время становится все более актуальной. Одним из загрязнителей, ухудшающих их качество, является железо. Предельно допустимая концентрация (ПДК) суммарного железа в питьевой воде, согласно СанПиН, составляет 0,3 мг/дм3, третий класс опасности. По данным Росгидромета, в последние 3-5 лет в поверхностных водах [11, с. 198]. В природные воды железо поступает как естественным путем при разрушении и растворении горных пород, так и в результате антропогенного загрязнения сточными водами предприятий металлургической, металлообрабатывающей промышленности, сельского хозяйства и др. Содержание железа в поверхностной воде рек составляет десятые доли миллиграмма в 1 дм3, вблизи болот - единицы миллиграммов в 1 дм3. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм3) наблюдаются в подземных водах с низкими значениями рН. Вода с содержанием железа выше 1 мг/дм3 непригодна не только для питьевых, но и для технических нужд. Фотометрические методы анализа позволяют определять железо только в одной из степеней окисления (II) или (III) в пробе и не применимы для окрашенных и мутных растворов. Наиболее простыми экспрессными и экономичными методами определения железа в разных степенях окисления в мутных и цветных водных растворах различного происхождения являются вольтамперометрические методы [4, с. 198-199]. Актуальность определяется тем, что хотя в настоящее время для фотометрического определения железа предложено много различных методик, но все они, в том числе и ГОСТ, при определении железа в медных сплавах требуют или предварительного отделения его, или отделения основы меди и других веществ [5]. Цель работы. Фотометрическое определение железа в питьевой воде. Объектом исследования является питьевая вода, а предметом исследования - фотометрическое определение железа сульфосалициловым методом. Задачи, поставленные в данной курсовой работе: ) проработка литературного материала; ) рассмотрение метода фотометрического определения железа; ) определение содержания железа в питьевой воде фотометрическим методом. Структура и объем работы. Курсовая работа изложена на 34 страницах машинописного текста, состоит из введения, трех глав, выводов и списка использованных источников, который включает в себя 6 отечественных авторов, диссертацию, 15 ГОСТов, 1 патент, 2 интернет-ресурса. Глава 1. Литературный обзор .1 Основные понятия фотометрии Оптические методы исследования веществ основаны на способности этих веществ порождать оптическое излучение или взаимодействовать с ним. Фотометрия - совокупность оптических методов и средств измерения фотометрических величин светового потока. Основным понятием фотометрии является поток излучения, смысл которого в мощности переносимого электромагнитного (оптического) излучения. Спектрофотометрия - определение зависимости фотометрических величин от длины волны излучения. Спектроскопия или эмиссионный спектральный анализ - определение излучательной способности веществ в зависимости от длины волны излучения. В аналитической химии и клинической лабораторной диагностике широкое применение нашли фотометрические методы количественного анализа, основанные на переведении определяемых компонентов в поглощающие свет соединения с последующим определением их количеств путем измерения светопоглощения растворов [12]. По окраске растворов окрашенных веществ можно определять концентрацию компонентов при помощи фотоэлектрических приемников оптического излучения (фотоприемников) - приборов, превращающих световую энергию в электрическую. Если измерение ведется без выделения узкого диапазона длин волн, то есть измеряются характеристики всего светового потока, то такой метод анализа часто называется колориметрическим. Если же выделяется характерный для поглощения данным веществом оптический диапазон и измерение проводится на определенной длине волны, тогда говорят о собственно фотометрическом методе анализа. Фотометрический метод является более объективным методом, чем колориметрический, поскольку результаты его меньше зависят от поглощения света другими (интерферирующими) окрашенными веществами [16]. Фотометрический анализ - один из самых старых и распространенных физико-химических методов, для него требуется относительно простое оборудование, в то же время он характеризуется высокой чувствительностью и возможностью определения большого количества органических веществ. Открытие все новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, разработка принципов сопряженных реакций делает в настоящее время применение этого метода почти неограниченным. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных веществ, так и для определения микропримесей в объектах. Комбинирование с некоторыми методами разделения и обогащения - хроматографическим, экстракционным - позволяет на несколько порядков повысить чувствительность фотометрических методов. Фотометрические свойства растворенного вещества характеризуются коэффициентом пропускания T (τ), коэффициентом отражения R (ρ), и коэффициентом поглощения A (α), которые для одного и того же вещества связаны соотношением (1): T + R + A = 1 (1) Определение безразмерных величин T, R и A выполняется с помощью фотометров (приборов для измерения какой-либо фотометрической величины) путем регистрации реакций приемника оптического излучения на соответствующие потоки излучения. При этом в рутинной лабораторной практике принято обозначать приборы, регистрирующие поглощение света веществом, фотометрами, отражение - отражательными фотометрами. Фотометрические методы применяются также в тех случаях, когда изучается способность веществ рассеивать (нефелометрия) и пропускать излучение (турбидиметрия), переизлучать поглощенное излучение (флуориметрия), изменять степень поляризации излучения при прохождении его через оптически активные вещества (поляриметрия). Кроме того, одним из важных разделов физической оптики является рефрактометрия, изучающая показатели преломления оптического излучения твердых, жидких и газообразных веществ в зависимости от длины волны излучения. Названные оптические методы применяются для изучения состояния биологических систем и их изменения в процессах ассоциации-диссоциации, взаимодействия с другими молекулами, образования и распада комплексов фермент-субстрат, антиген-антитело, белок- липид, белок - нуклеиновая кислота; фотофизических и фотохимических процессов и т.д. Высокая чувствительностью, точность, быстродействие и удобство использования для рутинных исследований предопределяют широкое применение оптических методов в клинической лабораторной диагностике [1, с. 7-8]. .2 Классификация методов фотометрического анализа Метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путём измерения светопоглощения раствора полученного соединения, называется фотометрическим. По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов - приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометрический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов - собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя, в отличие от результатов колориметрического - субъективного метода. Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20-30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 10-3-10-4 %. Комбинирование фотометрических методов с некоторыми методами разделения - хромотографическим, экстракционным позволяет на 1-2 порядка повысить чувствительность определения, доведя его до 10- 5. В некоторых случаях фотометрический метод может быть применён для одновременного определения в растворе в растворе нескольких ионов, хотя его возможности ограничены. Очень ценно использование фотометрических методов для решения многих теоретических вопросов аналитической и физической химии [6]. Фотометрический метод количественного анализа основан на переведении определяемого компонента в поглощающее свет соединение; количество этого продукта реакции устанавливают путем измерения светопоглощения. В фотометрическом анализе применяют реакции различных типов. Для определения неорганических компонентов чаще всего используют реакции образования (иногда - разрушения) окрашенных комплексных соединений. Большинство металлов и неметаллов способны к образованию различных комплексных соединений, в том числе окрашенных, или во всяком случае способны к взаимодействию с окрашенными комплексами. Поэтому область применения фотометрических методов анализа практически не имеет ограничений; в настоящее время известны достаточно простые фотометрические методы определения почти всех элементов или их соединений. Для фотометрического определения органических компонентов чаще всего используют реакции синтеза окрашенных соединений. Реакции синтеза удобно применять и для определения некоторых неорганических компонентов, например сульфидов или нитритов. Значительно реже применяют в фотометрическом анализе реакции окисления - восстановления - при определении неорганических компонентов практически важное значение имеет только окисление хрома до хромата и марганца до перманганата. Несколько чаще используют реакции окисления - восстановления в качестве вспомогательных, например, при определении фосфора или кремния в виде синих гетерополикомплексов. Довольно часто реакциями окисления - восстановления пользуются в различных стадиях фотометрического определения органических веществ. Наконец, ряд фотометрических методов основан на каталитическом эффекте. Чувствительность фотометрических методов, основанных на обычных реакциях образования окрашенных соединений, имеет естественный предел. Поэтому если необходимо значительное повышение чувствительности, поступают следующим образом. Определяемый компонент вводят в некоторую систему в качестве катализатора. В результате каждая частица определяемого компонента приводит к образованию большого количества частиц продукта реакции. Количество продукта каталитической реакции определяется фотометрическим методом. Таким образом, центральное место в фотометрическом анализе занимает химическая реакция. Время, затрачиваемое на анализ, чувствительность метода, его точность и избирательность зависят в основном от выбора химической реакции и оптимальных условий образования окрашенного соединения. Правильное измерение светопоглощения, разумеется, имеет большое значение. Однако выбор того или другого способа измерения поглощения света обусловлен, как правило, не особенностями анализируемого материала или выбранной реакцией, а общими условиями работы той или другой лаборатории. Различают, по крайней мере, три следующие группы способов измерений концентрации окрашенного соединения в растворе. Визуальное сравнение. Глаз является весьма чувствительным устройством. Однако визуально нельзя установить количественно степень поглощения света или даже оценить, во сколько раз один раствор окрашен сильнее, чем другой. Глазом можно довольно хорошо установить равенство интенсивности окрасок или цвета двух растворов. Поэтому при каждом определении необходимо готовить стандартный раствор и добиваться одинаковой окраски испытуемого и стандартного растворов. Глаз наиболее чувствителен не к различию интенсивностей окрасок, а к различию цветов, оттенков. Поэтому такой способ установления содержания окрашенного продукта реакции называют колориметрическим анализом. Инструментальные методы: а) Поглощение света измеряют при помощи приборов с фотоэлементом. Такие приборы называют фотоэлектроколориметрами (ФЭК). В отличие от визуального способа, с помощью ФЭК можно непосредственно измерить ослабление интенсивности первоначального светового потока. Поэтому нет необходимости каждый раз готовить стандартный раствор. Обычно при работе с ФЭК перед выполнением анализов составляют калибровочный график по серии стандартных растворов. Калибровочным графиком, пользуются для многих определений, что очень удобно для массовых однотипных анализов. Если поглощение света измеряют с помощью ФЭК, такой способ называют фотоколориметрическим анализом. б) Наиболее совершенным, хотя и более сложным прибором является спектрофотометр. В спектрофотометре ослабление интенсивности светового потока измеряется также с помощью фотоэлементов. Однако в спектрофотометре имеется призма или дифракционная решетка, а также щель. Это позволяет выделить узкий участок спектра, именно тот, которым «оптически реагирует» окрашенное соединение. Известно очень мало «серых веществ», поглощающих свет равномерно во всех участках спектра. Большинство же окрашенных веществ поглощает преимущественно какой-нибудь один участок спектра. Поэтому измерение при длине волны, соответствующей максимуму спектра поглощения, увеличивает чувствительность. Кроме того, облегчается определение одного окрашенного соединения в присутствии другого, иначе окрашенного; в частности, при работе со спектрофотометром значительно улучшаются результаты фотометрического определения с применением окрашенных реактивов. Все названные выше способы измерения концентрации окрашенного соединения обычно называют фотометрическим анализом, независимо от того, выполняется ли измерение визуальным методом, фотоэлектроколориметром или спектрофотометром. Приведенное выше разделение способов измерения светопоглощения не имеет резких границ. Так, в фотометре Пульфриха сравнение двух световых потоков выполняется визуально; однако более интенсивный поток ослабляется измерительной диафрагмой. В результате можно установить численное значение ослабления интенсивности светового потока. Далее, как фотометр Пульфриха, так и ФЭК обычно снабжаются набором светофильтров, что в известной степени приближает эти приборы к спектрофотометрам. Существенным преимуществом спектрофотометров является возможность изучения светопоглощения в отдельных участках спектра, т. е. наблюдения всего спектра поглощения, что очень важно для правильного выбора оптических условий измерения, а также для физико-химических характеристик окрашенных соединений. Фотометрические, в особенности спектрофотометрические, методы имеют большое значение не только для химического анализа. Спектрофотометрия является одним из наиболее важных методов изучения реакций между веществами в растворе, а также изучения состава и строения соединений, влияния различных факторов на равновесия между реагирующими веществами С помощью спектрофотометрических методов сделан наиболее ценный вклад в химию комплексных соединений, являющуюся одной из важных теоретических основ фотометрического анализа неорганических соединений [2, с. 13-15]. Фотометрический анализ относится к молекулярному абсорбционному анализу, т.е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра. Спектрофотометрический метод анализа - основан на поглощении монохроматического излучения, т.е. излучения с одной длиной волны в видимой и УФ областях спектра. Фотоколориметрический метод анализа - основан на поглощении полихроматического (немонохроматического) излучения, т.е. пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов. Оба метода основаны на общем принципе - пропорциональной зависимости между светопоглощением и концентрацией определяемых веществ. С помощью фотометрического анализа можно определять малые количества вещества, например, содержание примесей не ниже 5*10-5% (спектрофометрически) и 1*10-4% (фотоколориметрически) при погрешности определения 1-3% [3, стр. 5]. .3 Спектры поглощения .3.1 Происхождение молекулярных спектров поглощения Как известно, внутренняя энергия молекулы складывается из трех основных составляющих: энергии движения электронов (Еэл.), энергии колебаний атомов молекулы (Екол.) и энергии вращения молекулы (Евр.). Формула для расчета внутренней энергии (2): Е = Еэл + Екол + Евр (2) При поглощении излучения в видимой и УФ областях спектра происходит изменение электронной составляющей общей энергии. Поэтому мы будем рассматривать энергию движения электронов. Если излучение определенной длины волны проходит через веществ и не поглощается, то энергическое состояние молекулы остается без изменения. Если же излучение поглощается, то молекулы вещества переходят из одного энергетического состояния с меньшей энергией (Е1) в другое энергетическое состояние с большей энергией (Е2). Этот процесс сопровождается поглощением кванта энергии (3): ∆Е = Е2 - Е1 = h v= где h - постоянная Планка (6,62 *10-34 Дж · с), v - частота излучения (с-1, Гц), с - скорость света (3 *1010 см/с), l- длина волны, нм (1 нм = 10-9 м или в микронах 1 мк = 1· 10-6 м), Формула для расчета волнового числа (4): 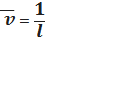 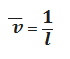 (4) (4)Энергия кванта определяет длину волны, а число поглощенных квантов - интенсивность излучения. Обычно энергию электронного перехода относят к молю вещества и выражают в кДж/моль. Зная длину волны и волновое число можно рассчитать энергию электронного перехода. В таблице 1.3.1.1 приведены основные области электромагнитного излучения. Таблица 1.3.1.1 - Основные области электромагнитного излучения
Изучая поглощение излучения веществом различных длин волн в видимой и УФ областях спектра можно получить электронный спектр поглощения. Спектром поглощения называют графическую зависимость интенсивности поглощения от длины волны (l) или волнового числа ( .3.2 Основные характеристики полосы поглощения К основным характеристикам полосы поглощения (рисунок 1) относятся: длина волны в максимуме поглощения (lмакс), интенсивность поглощения в максимуме Ɛ max, полуширина полосы (δ1/2), которая равна ширине полосы в единицах длин волн или волнового числа при значении интенсивности, составляющей половину интенсивности поглощения в максимуме [3, с. 7-8]. 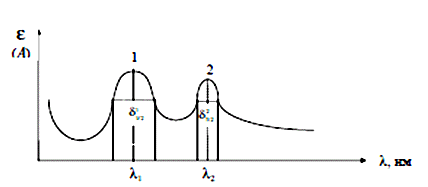 Рисунок 1 - Электронный спектр поглощения молекулы .3.3 Основной закон светопоглощения При прохождении электромагнитного излучения интенсивностью I0 через частично поглощающую среду, например, через раствор с концентрацией поглощающего вещества С (моль/л) и толщиной поглощающего слоя l, часть этого излучения будет поглощаться (In) (рисунок 2), небольшая часть излучения отражается от стенок кюветы (Iотр.), и часть проходит через раствор (I).  Рисунок 2 - Схема поглощения света раствором Таким образом, интенсивность падающего излучения равна сумме трех составляющих (5): 0 = I + Iотр + In (5) Значение Iотр очень мало, поэтому это значение можно не учитывать [3, с. 7-8]. На основании многочисленных экспериментов П. Бугером, а затем и И.Ламбертом был сформулирован закон, устанавливающий, что слои вещества одинаковой толщины, при прочих равных условиях, всегда поглощают одну и ту же часть падающего на них светового потока [6]. .4 Аппаратура и техника фотометрических измерений .4.1 Основные узлы приборов для фотометрических измерений Фотометрические методы определения концентрации веществ в растворах основаны на сравнении поглощения или пропускания света стандартными и исследуемыми растворами. Степень поглощения света фотометрируемых раствором измеряют с помощью фотоэлектроколориметров и спектрофотометров. Измерение оптической плотности производят по отношению к раствору сравнения (нулевого раствора). В качестве раствора сравнения чаще всего используют растворитель [3, с. 9]. Независимо от области спектра приборы для измерения пропускания или поглощения света раствором состоят из следующих пяти основных узлов (рисунок 3): 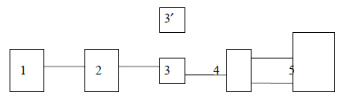 Рисунок 3 - Основные узлы приборов для абсорбционных измерений. Источника излучения (1), монохроматора (2), устройства, которое позволяет выделить ограниченную область длин волн, кювет с исследуемым раствором и раствором сравнения (3 и 3’) (приборы комплектуются набором кювет с l= 10 - 0,1 см), преобразователя (4), который превращает энергию излучения в электрический сигнал (фотоэлемент), индикатора сигнала (5) (регистрирующее устройство). Приборы, применяемые для измерения поглощения растворов, можно классифицировать следующим образом: . По способу монохроматизации лучевого потока: приборы с призменным или решетчатым монохроматорами, которые позволяют достигнуть высокой степени монохроматизации рабочего излучения называют спектрофотометрами; приборы, в которых монохроматизация достигается с помощью светофильтров, называют фотоэлектроколориметрами. . По способу измерения: однолучевые с прямой схемой измерения, и двулучевые с компенсационной схемой измерения. . По способу регистрации измерений: регистрирующие и нерегистрирующие [3, с. 9]. .4.2 Фотоэлектроколориметры Фотоэлектроколориметры предназначены для измерения пропускания или оптической плотности растворов в диапазоне 315-630 нм и определения концентрации растворов фотоколориметрическим методом. Все приборы снабжены набором узкополосных светофильтров, спектральные характеристики которых приведены в таблице 1.4.2.1, которые поглощают большую часть излучения и пропускают ограниченный участок длин волн. Таблица 1.4.2.1 - Характеристики светофильтров
Перед началом проведения измерений необходимо выбрать светофильтр. Светофильтры нужно выбирать так, чтобы максимум пропускания и минимум поглощения светофильтра совпадали бы с максимумом поглощения определяемого вещества (рисунок 4). 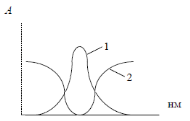 Рисунок 4 - Поглощение излучения: 1 - раствором, 2 - светофильтром Фотоколориметры применяют в основном для измерения поглощений в видимой области спектра. Если вещество не поглощает электромагнитное излучение в этой области, то его путем химической реакции можно перевести в окрашенный продукт. Кюветы, используемые в фтоколориметрии изготавливают из стекла. По чувствительности, селективности и точности фотоколориметрические измерения несколько уступают спектрофотометрическим, так как определяется поглощение не монохроматического света, а пучка лучей с определенным интервалом длин волн [3, с. 10-11]. 1.4.3 Спектрофотометры Спектрофотометры предназначены для измерения пропускания или оптической плотности в диапазоне 190-1100 нм. Источником УФ излучения служат водородная или дейтеривая лампа. Данные источники излучают сплошной спектр в интервале 180-375 нм. В одинаковых рабочих условиях дейтеривая лампа дает излучение большей интенсивности, чем водородная. Для измерения оптической плотности или пропускания в УФ области спектра требуются кюветы из кварцевого стекла, т. к. обычное стекло сильно поглощает это излучение [13]. Источником видимого излучения служит лампа накаливания с вольфрамовой нитью, излучающая сплошной спектр в области 315-1100 нм. В спектрофотометрах в качестве устройства для выделения части излучения применяют монохроматоры двух типов: призму и дифракционную решетку, которые позволяют непрерывно менять длину волны [14]. .5 Качественный и количественный анализ методом фотометрии Качественный фотометрический анализ. Молекулы различных веществ характеризуются своей системой энергетических уровней, поэтому спектры поглощения их будут различаться по числу полос поглощения, их положению в шкале длин волн и интенсивности. Этот факт используют для идентификации и проведения качественного анализа веществ, используя для этого значения lmax и Ɛmax, которые зависят от природы вещества. Ультрафиолетовые спектры поглощения обычно имеют две-три и более полос поглощения. Для идентификации исследуемого вещества записывают его спектр поглощения в различных растворителях и сравнивают полученные данные с соответствующими спектрами исходных веществ известного состава. Если спектры поглощения исследуемого вещества в разных растворителях совпадают со спектром известного вещества, то делают заключение об идентичности химического состава этих соединений. При идентификации вещества следует также обратить внимание на интенсивность поглощения. Очень многие органические вещества имеют полосы поглощения, максимумы которых расположены при одинаковой длине волны, но интенсивности их различны. Например, в спектре фенола наблюдается полоса поглощения при l= 255 нм, для которой Ɛ= 1450. При той же длине волны ацетон имеет полосу поглощения, для которой Ɛ= 17. Появление полос поглощения в электронных спектрах обусловлено переходами электронов в молекуле вещества между электронными уровнями из основного - в возбужденное состояние. Основные типы электронных переходов В молекуле различают: а) связывающие σ и π-электроны, которые находятся на связывающих σ и π-орбиталях; б) разрыхляющие σ* и π*-электроны, которые находятся на разрыхляющих орбиталях; в) несвязывающие n-электроны, которые находятся на несвязывающих п-орбиталях. На рисунке 5 изображены основные типы электронных переходов. 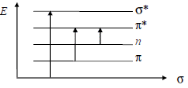 Риcунок 5 - Основные типы электронных переходов в молекуле Различные электронные переходы требуют неодинаковой энергии и поэтому могут наблюдаться при различных длинах волн и иметь различные значения молярного коэффициента поглощения. Для возбуждения σ→ σ* переходов требуется значительная энергия (УФ в вакуумной области, l = 100-150 нм), т.к. σ - электроны прочно связаны в молекуле. Такие переходы редко реализуются и характеризуются большой интенсивностью. Значительно меньше энергии требуется для осуществления π→π*- перехода. Они наблюдаются в области 200-250 нм и характерны для молекул ароматических соединений с сопряженными связями. Значение коэффициента молярного поглощения для этих переходов равно |