Лр и лрс содержащие горечи Понятие о горечах
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
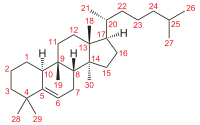
ЛР и ЛРС содержащие горечи Понятие о горечах Горечи (Amara)- безазотистые вещества растительного происхождения, обладающие резко выраженным горьким вкусом, возбуждающие аппетит, улучшающие пищеварение, но не оказывающего общего резорбтивного действия на организм. Классификация: 1.По химической структуре горечей 2. По химическому составу ЛРС. По хим.стуктуре: В основном в к терпеноидам. -монотерпеновые горечи (иридоиды) (С5Н10)2 -сексвитерпеновые горечи (С5Н10)3 А. Производные гваяна Б. Производные акорана В. Производные эвдесмана Г. Производные гермакрана - Дитерпеноидные (С5Н10)4 -тритерпеноидные (С5Н10)6 Монотерпеновые горечи (иридоиды). В основном гликозиды Иридоид- производные циклопентана – пираны 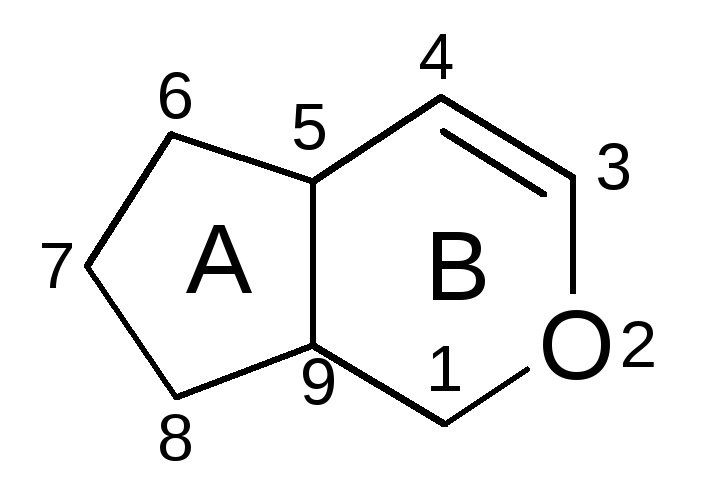
Иридоиды представляют собой бесцветные кристаллические или аморфные вещества. Большинство легко растворимы в воде, метиловом, этиловом спиртах и спирто-водных смесях; практически нерастворимы в эфире, хлороформе. Иридоиды широко распространены в семействах норичниковых, подорожниковых, губоцветных, горечавковых. Накапливаются они преимущественно в надземной части растений. Иридоиды проявляют антибиотическое, противовоспалительное, ранозаживляющее, желчегонное, гепатопротекторное, диуретическое свойства. Многие иридоиды оказывают слабительное действие. Имеются также данные о противоопухолевой активности иридоидных гликозидов. Сексвитерпеновые горечи (производные гваяна, азерина)
Чаще всего они встречаются у растений семейств астровые (тысячелистник обыкновенный, полынь горькая и др.) и ароидные (аир обыкновенный). Дитерпеноидные горечи встречаются у растений семейства симарубовые - квассия горькая, пикрасма высокая (квассин). Тритерпеноидные горечи
Одуванчик лекарственный Растения и сырье, содержащие горечи, в зависимости от сопутствующих веществ подразделяют на две товароведческие группы: 1) горько-ароматическое, или горько-пряное сырье (ароматные горечи - Amaraaromatica), включает траву и листья полыни горькой, корневища аира, траву и цветки тысячелистника. В этих видах сырья кроме горечей имеется эфирное масло; 2) сырье, содержащее «чистые» горечи (Amarapura), включает корни горечавки, корни одуванчика, листья вахты трехлистной, траву золототысячника. Эфирного масла в этих растениях нет. Особенности заготовки, сушки, хранения. Сырье, содержащее монотерпеноидные горечи (иридоиды), следует быстро доставлять к месту сушки, сушить быстро, в тонком слое, при температуре 50-60 °С. Сырье, содержащее ароматные горечи, сушат и хранят по правилам, принятым для эфирно-масличного сырья. Фармакологические свойства. Применение горечей основано на их рефлекторном действии на функцию желудочно-кишечного тракта. Горечи раздражают вкусовые рецепторы, рефлекторно возбуждают парасимпатические волокна блуждающего нерва, подходящие к желудку и слюнным железам. В результате повышается секреция желудочного сока, панкреатического сока, а также перистальтика кишечника. Применение в медицине. Применяют препараты, содержащие горечи, при расстройствах пищеварения, сопровождающихся отсутствием аппетита, диспепсическими явлениями1 и ахилией2. Кроме того, горечи оказывают антимикробное действие. Длительное применение препаратов, содержащих горечи, укрепляет центральную нервную систему. 1 Диспепсические явления - общее название симптомов нарушения пищеварения. 2 Ахилия - отсутствие соляной кислоты и фермента пепсина в желудочном соке. ЛР и ЛРС содержащие сердечные ( кардиотонические) гликозиды Кардиотонические гликозиды (кардиотонизирующие, или сердечные, гликозиды) - гетерозиды, агликоны которых являются стероидами - производными циклопентанпергидрофенантрена (ЦППГФ), имеющими у С17 ненасыщенное лактонное кольцо: пятичленное (карденолиды) или шестичленное (буфадиенолиды). 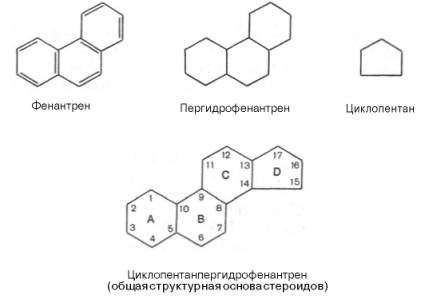 Название «карденолиды» происходит от греч. cardia - сердце, «енолид» - лактонное пятичленное кольцо, содержащее одну двойную связь; «буфадиенолиды» - от лат. bufo - жаба, «диенолид» - лактонное шестичленное кольцо с двумя ненасыщенными связями. -Стерины (природные спирты холестерин и β-ситостерин) 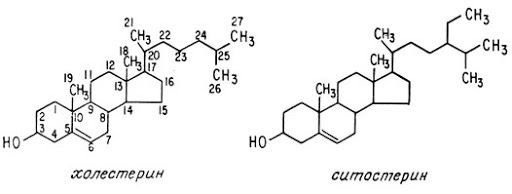 -Желчные кислоты -Стероидные гормоны В растениях: -Сердечные гликозиды -Стероидные сапонины -Стероидные алколоиды Сердечные гликозиды (СГ) обладают избирательным действием на сердечную мышцу, оказывают кардиотоническое действие. В больших дозах – яды. Синтетических заменителей не найдено. Строение СГ. Агликон и углеводная част, соединенные гликозидной связью обладают специфическим действием. Углеводная часть влияет на растворимость. В малых (терапевтических) дозах ускоряет и усиливает систолу, удлиняет диастолу, улучшает питание миокарда, снижает возбудимость проводящей системы, замедляет ритм сердечных сокращений.  R1= -CH3, -CH2OH, -CHO (возрастают гидрофильные свойства, увеличивают активность, но и токсичность), COOH. Влияет на свойства R2= -OH, также влияют на гидрофильность. В 16 положении – понижение активности. Свободные огликаны плохо удерживаются миокардом, т.е. действие непродолжительное. Более токсичны, чем гликозиды. Все СГ являются β-гликозидами. Углеводная часть присоединяется за счет гидроксила и ОН-группы у С3. ≈30 моносахаридов (глюкоза, галактоза, ксилоза(древесный сахар), арабиноза и др.). Специфичные углеводы объединяют кислород 6-дезикси сахара. 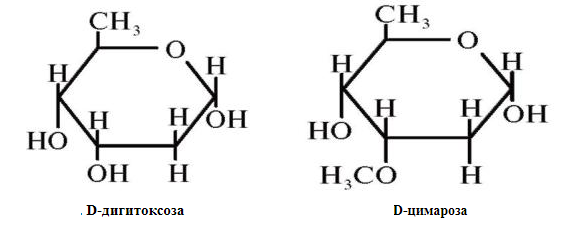 Дезокси сахара к агликону, а обычные сахара – в конце цепи. Содержащие 1-5 моносахаридных остатка – сахара соединяются линейно. Количество остатков влияет на скорость и время действия гликозида. С увеличением количества сахаров действие также становится более мягким. Наличие в углеводе остатка также увеличивает время действие гликозида. 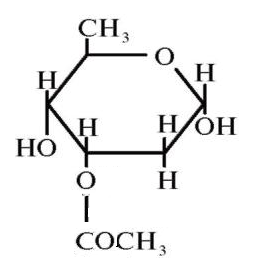 Ацетилдигитоксоза АцетилдигитоксозаКлассификация СГ  Буфадиенолиды. Bufо- жаба, у С17 – α-пироновый фрагмент (буфанолид) 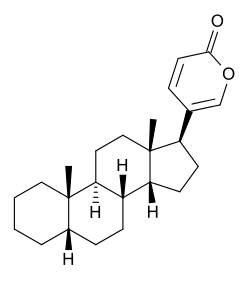 Углеродный скелет буфадиенолидов (буфа-20,22-диенолид) Углеродный скелет буфадиенолидов (буфа-20,22-диенолид)В растениях распространен незначительно. Морозник (Helleborus) – из-за высокой токсичности в настоящее время не используется. Карденолиды. Cardia – сердце, у С17 – 5-членное лактонное кольцо (енолид).  Гитоксигенин (C16- ОН) Физические и химические свойства СГ. 1. Сердечные гликозиды представляют собой кристаллические, реже аморфные вещества, бесцветные или беловатые, иногда с кремовым оттенком. 2. Без запаха, горького вкуса. Из-за ядовитости их вкус не определяют. 3. Имеют определенную температуру плавления. 4. Оптически активны, имеют определеннвый угол вращения 5. Способны флуоресцировать в УФ желтым, голубым и зеленым цветом. 6. СГ Хорошо растворимы в водных растворах метилового и этилового спиртов, в чистых спиртах при нагревании. Мало растворимы в воде и хлороформе. На растворимость в воде влияет длина сахарной цепочки. Чем она длинее, тем лучше растворяются сердечные гликозиды. Не растворимы в органических растворителях (диэтиловом и петролейном эфирах, в ССl4 и др.). В зависимости от растворимости в воде и липидах СГ делятся на 2 группы: - Гидрофильные (полярные) СГ. Полярность обусловлена наличием альдегидной группы в С10 агликона, а также присутствием дополнительных -ОН групп в агликоне. -Липофильные (неполярные) СГ. Неполярность обусловлена метильными группами в С10 агликона. Подгруппа наперстянки. Наличие ОН групп и ацетилированных моносахаров позволяет увеличивать гидрофильные свойства. Химические свойства. Все реакции на сердечные гликозиды можно разделить на 3 группы: 1. Реакции на углеводную часть молекулы. 2. Реакции на стероидное ядро. 3. Реакции на лактонное ненасыщенное кольцо. -Самые неустойчивое лактомное кольцо и гликозидная связь. -Лактамное кольцо изомеризуется под действием щелочей. -Гликозидная связь подвергается ферментативному гидролизу в присутствии воды – ступенчатый гидролиз СГ. Начнем с сердечных гликозидов наперстянки пурпурной (Digitalis purpurea). Поскольку Вы уже знаете, что агликоновая часть сердечных гликозидов иначе называется генином, а перешли мы к гликозидам наперстянки (лат. – дигиталис), то первый агликон, на котором мы строим сердечные гликозиды, будет носить название дигитоксигенин. Он, кроме уже известной Вам структуры циклопентанопергидрофенантрена, двух –СН3 групп и одной –ОН группы, содержит (кстати, как и все другие сердечные гликозиды, которые Вам нужно знать) еще одну –ОН группу – на противоположном конце от –СН3 в С13, то есть в положении С14. Если по –ОН группе при С3 присоединяются 3 молекулы дигитоксозы, получаем дигитоксин, а если еще и одна молекула бета–глюкозы, то – пурпуреагликозид А (все пурпуреагликозиды – из дигиталис пурпуреа). Гидролиз пурпуреагликозида А 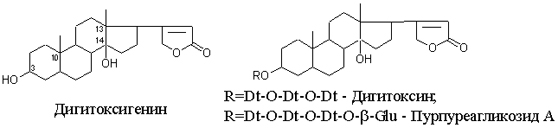 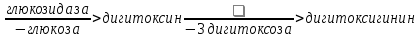 Пурпуреагликозид Б Теперь, если к молекуле дигитоксигенина присоединим еще одну –ОН группу (в положении при С16), получим гитоксигенин. Аналогично гликозидам дигитоксигенина строим гликозиды гитоксигенина – гитоксин и пурпуреагликозид Б. 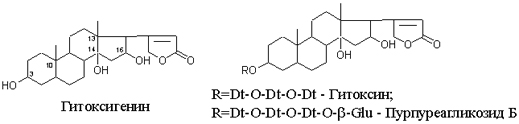 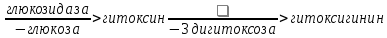 Гидролиз ланатозидов Карденолиды наперстянки шерстистой тоже строим на основе дигитоксигенина, гитоксигенина и дигоксигенина. Но при получении типичных гликозидов наперстянки шерстистой вместо трех молекул дигитоксозы добавляем к соответствующему агликону две молекулы дигитоксозы и одну – ацетилдигитоксозы. Таким образом, мы на основе дигитоксигенина получаем ацетилдигитоксин, на основе гитоксигенина – ацетилгитоксин, на основе дигоксигенина – ацетилдигоксин. И, в конечном счете, если к ацетилдигитоксину добавляем одну молекулу бета–глюкозы (как мы это делали при получении пурпуреагликозидов), получим ланатозид А (помним – это карденолиды дигиталис ланата); в случае ацетилгитоксина – ланатозид Б; для ацетилдигоксина – ланатозид С. Ланатозид А 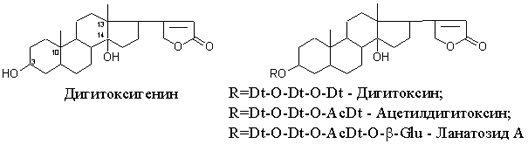 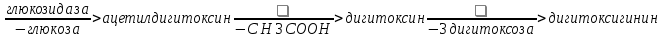 Ланатозид Б 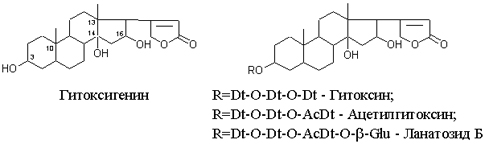 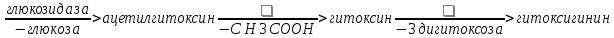 Ланатозид С 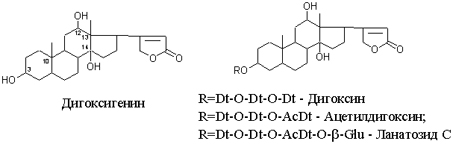 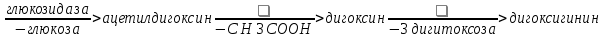 К-строфантазиды Сердечные гликозиды строфанта комбе (Strophanthus kombe) строятся на основе агликона, который называется К–строфантидин (К, то есть комбе). Он отличается от дигитоксигенина тем, что в его молекуле вместо –СН3 группы в положении С10 находится альдегидная группа –СОН и появляется еще одна –ОН группа – в положении С5 (на противоположном конце от альдегидной). 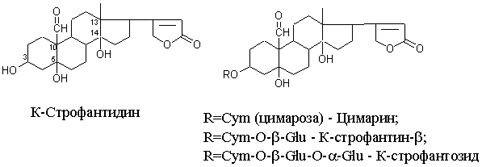 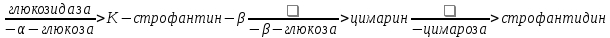 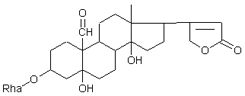 На основе К–строфантидина строим его гликозиды – цимарин (присоединяем в С3 положении вместо водорода одну молекулу цимарозы); К–строфантин–бета (к цимарозе добавляем одну молекулу бета–глюкозы) и К–строфантозид (к цимарозе и бета–глюкозе добавляем еще одну молекулу альфа–глюкозы). А если к молекуле К–строфантидина вместо цимарозы мы присоединим молекулу рамнозы, получим карденолид ландыша майского (Convallaria majalis) – конваллотоксин.  Конваллотоксин (Агликон – К–строфантидин (–ОН в С14, С5)) Строим дальше. В молекуле конваллотоксина заменяем рамнозу на дигитоксозу и получаем основной карденолид желтушника седеющего (Erysimum canescens) – эризимин. 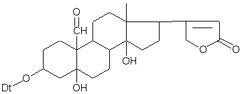 Эризимин (Агликон – К–строфантидин (–ОН в С14, С5)) И, в конце концов, к молекуле конваллотоксина добавляем –ОН группу при С16 (как в гитоксигенине, вспомним!). Полученное соединение, то есть тоже рамнозид (содержит остаток рамнозы при С3 агликона), называется адонитоксином, и является основным сердечным гликозидом Адониса, то есть горицвета весеннего (Adonis vernalis). 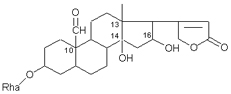 Адонитоксин (Агликон – адонитоксигенин (–ОН в С14, С16)) Из буфадиенолидов Вам следует запомнить один гликозид, применявшийся ранее в качестве лекарственного препарата – корельборин. Ныне он снят с производства в связи с недостаточной эффективностью и нехваткой сырья (содержится в корневищах с корнями некоторых видов морозника – Helleborus sp., семейство Ranunculaceae – морозника чернеющего, морозника красноватого, морозника кавказского и др.). Этот сердечный гликозид по структуре очень похож на конваллотоксин, только лактонное кольцо у него не 5–членное, как у конваллотоксина, а 6–членное, дважды ненасыщенное, что характерно для всех буфадиенолидов. 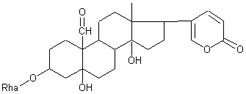 Корельборин (Агликон – геллебригенин (–ОН в С14, С5), как К–строфантидин) Химические свойства. Возможен кислотный и щелочной гидролиз (происходит расщепление до агликона и сахаров), некоторые при кипячении в воде. Оценка качества сырья. Методы анализа Качественное определение Качественные реакции проводят или с индивидуальными веществами, или с очищенным извлечением из ЛРС. Все реакции на сердечные гликозиды можно разделить на 3 группы: 1. Реакции на углеводную часть молекулы. 2. Реакции на стероидное ядро. 3. Реакции на лактонное ненасыщенное кольцо. 1. Реакции на сахарный компонент. В начале проводится кислотный гидролиз. Свободный сахар определяется Феллинговой жидкостью (идет образование красной закиси меди) или реакцией образования "серебряного зеркала". На дезоксисахара проводят: Реакцию Келлер-Килиани - к извлечению (сухому остатку) прибавляют: концентрированную СН3СООН со следами трехвалентного железа, осторожно наслаивают концентрированную Н2SO4 со следами трехвалентного железа. На границе двух слоев образуется коричневое или бурое кольцо, верхний слой окрашивается в сине-зеленый цвет. Реакция положительная в том случае, если дезоксисахар находится в свободном состоянии или занимает крайнее положение в молекуле гликозида. Если дезоксисахар связан с одной стороны с агликоном, а с другой - с другим сахаром (например, глюкозой), то реакция Келлер-Килиани не дает положительных результатов. Для обнаружения дезоксисахаров в таких случаях проводят гидролиз трихлоруксусной кислотой. Свободный дезоксисахар с нитрофенилгидразином и щелочью дает голубую окраску. Известна на дезоксисахара и ксантгидрольная реакция. К извлечению прибавляют ксантгидрол и ледяную уксусную кислоту, при нагревании и добавлении небольшого колическтва серной (или фосфорной) кислоты образуется красное окрашивание. 2. Реакции на стероидное ядро. Реакция Либермана-Бурхарда: сухой остаток растворяют в ледяной уксусной кислоте, прибавляют смесь уксусного ангидрида с концентрированной серной кислотой (50:1) - развивается окраска от красной до розовой, переходящей в зеленую или сине-зеленую. Реакция Розенгейма: сухой остаток растворяют в хлороформе, прибавляют 90%-ный водный раствор трихлоруксусной кислоты. Возникает розовая окраска, переходящая в лиловую. Реакция с SbCl3: в среде уксусного ангидрида – лиловое окрашивание. 3. Реакции на пятичленное лактонное кольцо. Все реакции проводятся со спиртовым очищенным извлечением из ЛРС в щелочной среде: реакция Легаля: с нитропруссидом натрия появляется быстро исчезающее красное окрашивание; реакция Раймонда: с м-динитробензолом - красно-фиолетовое окрашивание; реакция Кедде: с 3,5-динитробензойной кислотой - фиолетовое окрашивание; реакция Балье: с пикриновой кислотой - оранжевое окрашивание. 4. Реакции на шестичленный лактонный цикл: к спиртовому извлечению прибавляют насыщенный раствор треххлористой сурьмы в хлороформе - при нагревании возникает лиловая окраска; 20% раствор треххлористой сурьмы в хлороформе используется для обнаружения буфадиенолидов на хроматограммах. Кроме того сердечные гликозиды образуют нерастворимые комплексы с растворами ДВ, что используется при отравлениях сердечными гликозидами. Биологические и химические методы стандартизации ЛРС Количественную оценку качества сырья проводят методом биологической стандартизации (для всех видов) или с использованием физико-химических методов анализа (для сырья, из которого получают индивидуальные гликозиды). Биологические методы позволяют установить силу действия того или иного сырья на определенных животных, но не показывают содержания гликозидов в ЛРС. Принцип метода биологической стандартизации основан на способности сердечных гликозидов в токсической дозе вызывать остановку сердца животных в систоле. Активность ЛРС и препарартов определяют на лягушках, кошках, голубях и выражают в единицах действия (ЛЕД, КЕД, ГЕД). За 1 ЛЕД принята наименьшая доза препарата, которая в течение часа вызывает у стандартной лягушки остановку сердца в период систолы. Активность исследуемых препаратов оценивается в сравнении со стандартом. Отсюда и понятие "биологическая стандартизация". Разработка стандартов осуществляется специализированными научно-исследовательскими институтами. Затем расчитывают содержание единиц действия в 1 г исследуемого средства (если это ЛРС или сухие концентраты), в одной таблетке (при испытании таблеток), в 1 мл (для жидких лекарственных форм). В НД на ЛРС указывается валор. Валор сырья - это количество единиц действия в 1 г сырья. Физико-химические методы основаны на сочетании хроматографического разделения очищенного извлечения, полученного из сырья, элюировании индивидуальных гликозидов и их количественном определении различными методами: 1) фотоэлектроколориметрическим; 2) спектрофотометрическим; 3) хроматоспектрофотометрическим; 4) флуориметрическим; 5) полярографическим; 6) газожидкостной хроматографией. Заготовка, сушка и хранение ЛРС В процессе заготовки сырья, содержащего сердечные гликозиды, необходимо помнить, что энзиматический распад гликозидов начинается с момента отмирания растения. Поэтому необходимо собранное сырье как можно быстрее подвергнуть сушке. Недопустимо держать сырье в скученном виде, т.к. это приводит к самосогреванию в глубинных частях свежей массы и созданию оптимальных условий для действия ферментов. Сушка должна быть быстрой при температуре 50-60°С для инактивации ферментов. Медленная сушка может вызвать ступенчатый распад гликозидов. При хранении сырье следует оберегать от сырости, т.к. во влажной среде энзимы вновь активируются. Сырье хранят в сухих, хорошо проветриваемых помещениях, при температуре не выше 15°С по списку Б, кроме семян строфанта (список А) с обязательным ежегодным переконтролем биологической активности. Использование ЛРС и применение в медицине Сырье, содержащее сердечные гликозиды, не поступает в аптечную сеть, за исключением адониса и наперстянки пурпурной, а поступает на химико-фармацевтические заводы для производства экстрактов, настоек, препаратов. Сердечные гликозиды оказывают влияние на все функции миокарда. Они увеличивают силу и уменьшают частоту сердечных сокращений, улучшают тканевой обмен сердечной мышцы. Препараты, содержащие СГ, применяют при сердечной недостаточности и нарушениях ритма сердца. Препараты, содержащие сердечные гликозиды, применяют: 1). для профилактики и лечения хронической сердечной недостаточности любого происхождения; 2). для лечения острой сердечной недостаточности; 3). для снятия аритмий, особенно возникающих на фоне тахикардии; 4). при нарушениях каронарного кровотока; 5). при неврозах как седативное средство(препараты ландыша и горицвета). Химический состав, фармакологическая активность и использование ЛРС, содержащего сердечные гликозиды
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||







 ГЕРМАКРАН
ГЕРМАКРАН