Задачи 2. Масса вещества, окисленного на аноде
 Скачать 38 Kb. Скачать 38 Kb.
|
|
Задача 19 В течение какого времени ток силой 10 А должен проходить через электролитическую ячейку, содержащую расплавленный хлорид натрия, чтобы на катоде образовался металлический натрий массой 69 г? Определите массу хлора, выделившегося на аноде. Дано: I = 10А m1(Na) = 69г Найти: τ = ? m2(Cl) = ? Масса вещества, окисленного на аноде m = K·Q где Q – количество кулонов электричества, прошедшего через электролит, Кл; Q = Iτ где I – сила тока, А τ - продолжительность электролиза, с; Масса хлора Ответ: τ = 8ч3 мин; mCl = 160,5 г. Задача 16 Через три последовательно соединенных электролизера, каждый из которых содержал раствор различных солей, в течение 4000 с пропускали постоянный ток силой 1,93 А. В результате электролиза на катодах выделилось три различных металла в количествах 2,6150 г; 8,6296 г и 2,5424 г. Установите, какие это металлы. Дано: I = 1,93А τ = 4000 с m1 = 2,615 г. m2 = 8,6296 г. m3 = 2,5424 г. Найти: Мэ1 =? Мэ2 =? Мэ3 =? Решение По формуле объединенного закона электролиза: M(Э1) = 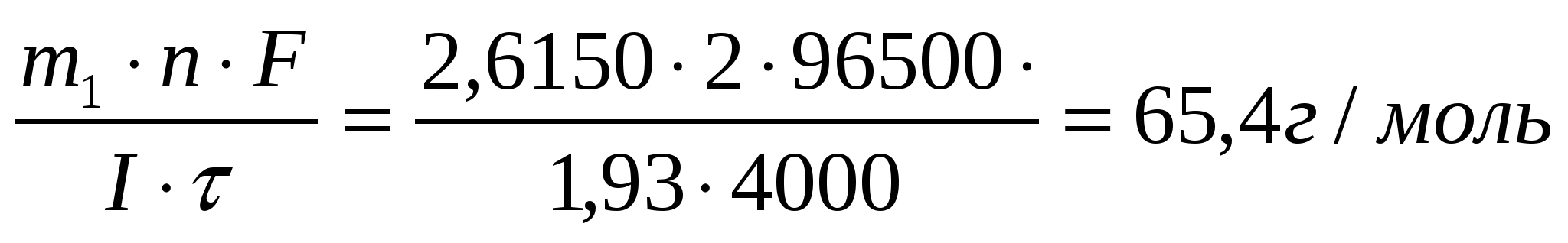 - цинк (Zn) - цинк (Zn)M(Э2) = 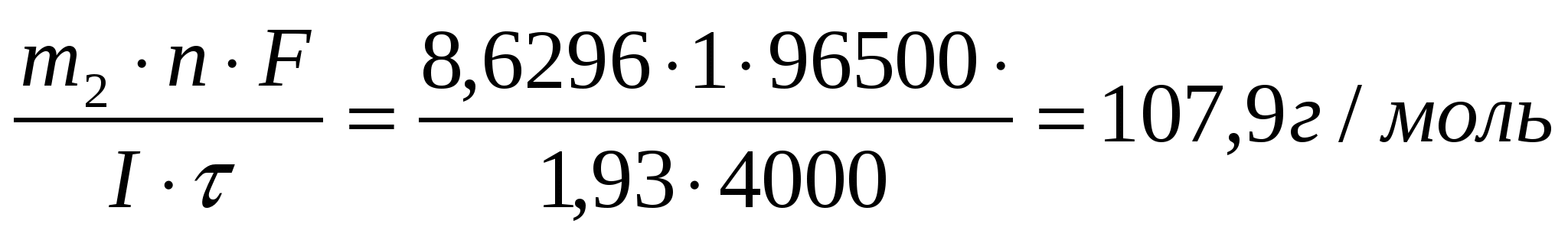 - серебро (Ag) - серебро (Ag)M(Э3) = 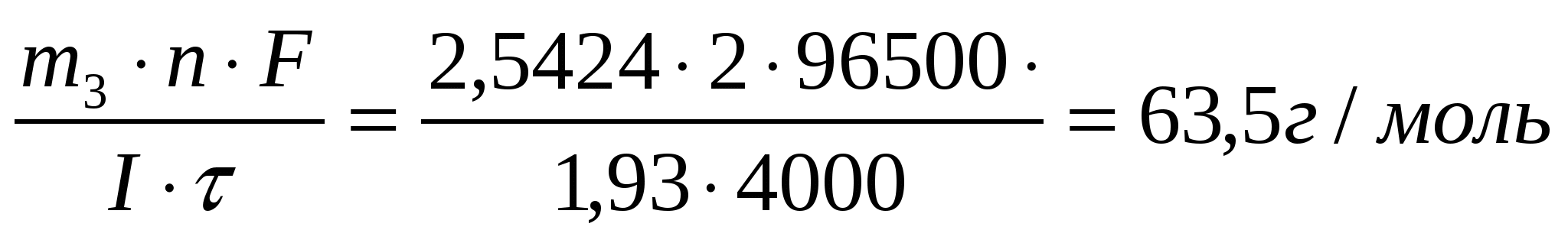 - медь (Cu) - медь (Cu)Ответ: Zn; Ag; Cu |
