Аквапорины. Материал из Википедии свободной энциклопедии Текущая версия страницы пока
 Скачать 94.65 Kb. Скачать 94.65 Kb.
|
 Аквапорины Аквапорины[править | править код] Материал из Википедии — свободной энциклопедии Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 февраля 2017; проверки требует 1 правка. Перейти к навигацииПерейти к поиску  Структура молекулы Аквапорина-1 Аквапорины — интегральные мембранные протеины, формирующие поры в мембранах клеток. Семейство аквапоринов входит в более крупное семейство основных внутренних белков (англ. major intrinsic proteins, MIP), наиболее типичный представитель которых — основной внутренний белок волокон хрусталика (MIP). Содержание
История открытия[править | править код] За открытие аквапоринов Питер Агре получил в 2003 году Нобелевскую премию по химии, совместно с Родриком Маккинноном, удостоившимся награды за изучение структуры и механизмов работы калиевых каналов. Функции[править | править код] Аквапорины, или "водные каналы", избирательно пропускают молекулы воды, позволяя ей поступать в клетку и покидать её, в то же время препятствуя протоку ионов и других растворимых веществ. Другие акваглицеропорины пропускают не только воду, но и глицерин, CO2, аммиак и мочевину, в зависимости от диаметра и формы образуемой поры, однако аквапорины совершенно непроницаемы для заряженных частиц, и это их свойство позволяет сохранять электрохимический мембранный потенциал. Аквапорины содержатся в мембранах множества клеток человека, а также бактерий и других организмов. Аквапорины выполняют незаменимую роль в системе водного транспорта растений. Аквапорины млекопитающих[править | править код] У млекопитающих описано 13 типов аквапоринов, из них 6 обнаруживаются в почках.[1] Возможно, некоторые аквапорины еще не описаны. В таблице приведены наиболее исследованные типы белка:
Аквапорины растений[править | править код] 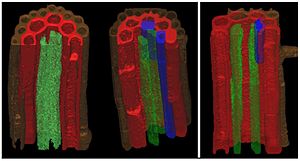 8-дневный корень арабидопсиса. Коричневый цвет - эпидермис, красный - осевой цилиндр, синий - эндодерма, зелёный - перицикл. Исследование экспрессии аквапоринов тонопласта (TIP) показывает разную локализацию различных подтипов белков этого семейства. Из статьи авт. Gattolin et al., 2009.[3] У растений описано пять групп аквапоринов:[4]
Данные пять групп аквапоринов на основе последовательностей, кодирующих их ДНК, были разделены на эволюционные подгруппы. Аквапорины плазматической мембраны (PIP) делятся на две подгруппы: PIP1 и PIP2. Аквапорины тонопласта (TIP) классифицируются на 5 подгрупп: TIP1, TIP2, TIP3, TIP4 и TIP5. В каждой подгруппе выделяют изоформы, например: PIP1;1, PIP1;2. Важно также отметить, что набор аквапоринов не только видоспецифичен, но также ткане- и цитоспецифичен; также следует учитывать, что паттерн экспрессии аквапоринов изменяется в ходе онтогенеза.[10] Функции аквапоринов в растениях[править | править код] У растений вода поглощается корнями, главным образом, в зоне всасывания, для которой характерно наличие корневых волосков - цитоплазматических выростов трихобластов. После поглощения вода проходит кору корня и поступает в проводящие ткани. Выделяют три пути латерального (от периферии корня к центральной его части)[11]:
Было показано, что при погружении корней в хлорид ртути (наиболее общеупотребительный ингибитор аквапоринов растений) поток воды значительно снижается, в то время как транспорт ионов не изменяется.[13] Данный факт подверждает наличие специализированных механизмов поглощения воды корнями растений, не связанных с транспортом ионов. Также важно отметить, что аквапорины играют важную роль в поддержании нормальной осмолярности цитоплазмы и принимают участие в росте растительных клеток растяжением, регулируя трансмембранный поток воды в клетку.[10] В частности, предполагается участие аквапоринов в регидратации обезвоженных пыльцевых зёрен на рыльце пестика и регуляция трансмембранного потока воды в растущую пыльцевую трубку. [14] Подавление экспрессии генов аквапоринов в растениях приводит к снижению гидравлической проводимости и снижению интенсивности фотосинтеза в листьях.[15] Регуляция работы аквапоринов у растений[править | править код] Регуляция работы аквапоринов позволяет контролировать их пропускающую способность, что может быть необходимо, например при засухе, когда необходимо ограничить потери воды клетками.[16] Закрывание/открывание аквапоринов достигается путем посттрансляционных модификаций, которые приводят к изменения конформации белка. В настоящее время у растений известно два механизма, контролирующих состояние аквапоринов:
Показано в частности, что фосфорилирование/дефосфорилирование аквапоринов играет важную роль в открывании и закрывании лепестков тюльпана в ответ на изменения температуры.[17][18] Генетика[править | править код] Мутации в гене аквапорина-2 вызывают у человека наследственный нефрогенный несахарный диабет.[19] |
