Эффект смачивания. Лекция 7 Эффект смацивания. Межфазные взаимодействия между конденсированными фазами
 Скачать 0.83 Mb. Скачать 0.83 Mb.
|
|
МЕЖФАЗНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОНДЕНСИРОВАННЫМИ ФАЗАМИ К межфазным взаимодействиям между конденсированными фазами относятся смачивание, растекание и адгезия. Как правило, адгезия и смачивание сопровождают друг друга. Эти явления широко распространены в природе и в различных отраслях промышленности (нанесение лакокрасочных покрытий, получение материалов на основе связующих и наполнителей - бетон, резина и т. д.) Смачивание— поверхностное явление, которое возникает при взаимодействии жидкости с твердым или другим жидким телом при одновременном контакте трех несмешивающихся фаз, одна из которых обычно является газом. При нанесении небольшого количества жидкости на поверхность другой жидкости или твердого тела можно наблюдать 2 процесса (если приводимые в контакт вещества взаимно не растворимы) — в одном случае растекание капли, в другом нет. 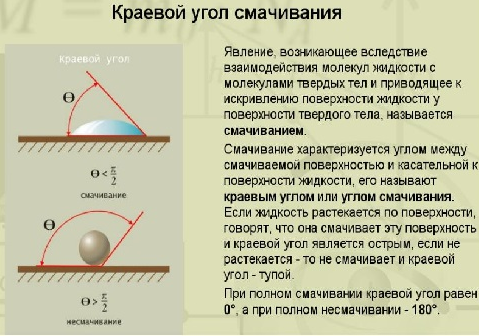 Смачивание можно оценить по значению этого угла или по cos θ: Чем меньше угол θ и больше cos θ, тем лучше смачивание. Граница смачивания — 90о или cosθ = 0. Приθ<90о — поверхность смачивается данной жидкостью, при θ>90о — поверхность не смачивается данной жидкостью. Приθ=180о — полное несмачивание (в природе не существует, т.к. всегда существует взаимодействие между жидкостью и твердым телом). Смачиваемость водой: кварц θ=0о малахит θ=17о графит θ=55о парафин θ=106о Из известных материалов хуже всего смачивается тефлон θ=108о. Нанесем на твердую поверхность раздела фаз каплю жидкости. Рассмотрим условия равновесия поверхностных сил в случае контакта трех фаз: 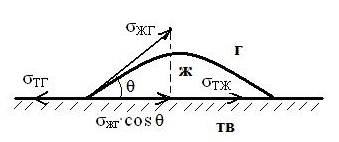 Рис.2. Условие равновесия капли при контакте трех фаз σт/г =σт/ж + σж/г cosθ cosθ= (σт/г — σт/ж) / σж/г – закон Юнга Рис.2 иллюстрирует состояние капли жидкости на поверхности твердого тела в условиях равновесия. Поверхностная энергия твердого тела, стремясь уменьшиться, вызывает растяжение капли по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом ϭ3,1. Межфазная энергия на границе твердого тела с жидкостью ϭ2,3 стремится сжать каплю. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между твердой, жидкой и газообразной фазами по касательной к сферической поверхности капли и равно ϭ2,1.Угол θ - краевой угол или угол смачивания. Чем меньше краевой угол , тем лучше смачивание поверхности. Если cos(θ)>0 , то поверхность хорошо смачиваемая, cos(θ)<0 - плохо смачиваемая поверхность. Когезия и адгезияКОГЕЗИОННЫЕ И ПОВЕРХНОСТНЫЕ СИЛЫКогезия - взаимодействие молекул, атомов, ионов внутри одной фазы. Работа когезии: Wк = 2σжг(1) т.к. определяется затратой энергии на обратимый разрыв тела по сечению равному единице площади. Точную информацию о когезии и поверхностном натяжении можно получить из термодинамических характеристик тел, связанных с парообразованием. В процессе испарения происходит полный разрыв межмолекулярных связей, поэтому работа когезии определяется энтальпией парообразования. H=Gп +TSп (2) При равновесии при р, Т = const Gп = 0 Н = Т Sп Отсюда следует, что, чем больше энтальпия парообразования (т.е. больше работа когезии, а значит и поверхностное натяжение), тем меньше давление насыщенного пара над веществом, т.к. Sп = So - R·ln (р/ратм) (3), где So - изменение энтропии парообразования при температуре кипения. При кипении р/ратм = 1 L =ТкипSo So= L /Ткип(4) L - энтальпия парообразования приТкип. Свойства поверхности отражают природу ионов, атомов и молекул в ней. Для жидкостей и твердых тел когезионные силы выражаются в межмолекулярном взаимодействии, обусловленном ван-дер-ваальсовыми и водородными связями. Оно отличается от химического взаимодействия отсутствующей специфичностью и насыщаемостью небольшими энергиями. АДГЕЗИЯАдгезия - межфазное взаимодействие, или взаимодействие между приведёнными в контакт поверхностями конденсированных тел разной природы (прилипание). Адгезия обеспечивает между двумя телами соединение определенной прочности, обусловленное межмолекулярными силами. Адгезия между - ж/ж, ж/т, т/т. Адгезия - результат стремления системы к уменьшению поверхностной энергии, поэтому это самопроизвольный процесс. Работа адгезии Wa, характеризующая прочность адгезионной связи, определяется работой обратного разрыва адгезионной связи, отнесённой к единице площади: Ws = WаS, где Ws - полная работа адгезии (5) Wa = [Дж/м2] Cоотношение между Wa и s:Предположим, что имеется контакт между 3 фазами - 1 - газ, 2 -жидкость, 3 - твердое тело, 2, 3 - конденсированные фазы. Введем следующие обозначения поверхностных натяжений: σ2,3 - поверхностное натяжение на границе раздела двух конденсированных фаз σ2,1 и σ3,1 - поверхностное натяжение на границе с воздухом Wa = σ2,1 +σ3,1 - σ2,3 - уравнение Дюпре (6) Уравнение Дюпре отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение. Уравнение 6 справедливо только для изобарно-изотермического процесса в отсутствии электрического и химического взаимодействия между контактирующими телами, его используют только для определения равновесной работы адгезии жидкости. Равновесную работу адгезии можно сопоставить с равновесной работой когезии. Когезия - определяет связь между молекулами внутри тела и в пределах одной фазы, характеризует прочность конденсированных тел и их способность противодействовать внешнему усилию. Механизм адгезииПервая стадия - транспортная, перемещение адгезива (клеящего вещества) к поверхности субстрата (тело, на которое наносят адгезив) и их определенное ориентирование в межфазном слое. Вторая стадия - взаимодействие адгезива и субстрата, обусловлено различными силами (от ван-дер-ваальсовых до химических). Завершается процесс адгезии межмолекулярным взаимодействием контактирующих фаз, что соответствует минимальной поверхностной энергии. Различают несколько механизмов (и, соответственно, теорий) в зависимости от природы взаимодействующих тел и условий, при которых происходит адгезия. 1.Механическая адгезия - осуществляется путем затекания в поры и трещины поверхности твердого тела жидкого адгезива., который потом затвердевает, обеспечивая механическое зацепление. 2.Молекулярная (адсорбционная) адгезия - возникает под действием межмолекулярных ван-дер-ваальсовых сил и водородных связей. 3.Электрическая теория - связана с образованием ДЭС на границе раздела между адгезивом и субстратом. 4.Диффузионный механизм - предусматривает взаимное проникновение молекул и атомов в поверхностные слои взаимодействующих фаз. Чаще всего механизм адгезии является смешанным. Теоретическая оценка адгезии очень приближённа, т. е., механизм её недостаточно изучен. Краевой угол смачивания и работа адгезииКраевой угол смачивания и работа адгезии Уравнение Дюпре самостоятельно почти не используется для расчета Wa из-за трудности определения σт/г и σт/ж. Удобную для расчета этой величины форму имеет соотношение, полученное в результате сочетания уравнения Дюпре с законом Юнга. Если разность (σт/г - σт/ж) в уравнении Дюпре заменить на σж/гcosθ уравнения Юнга, получим уравнение Дюпре — Юнга: Wa= σж/г+ σж/гcosθ= σж/г(1+cosθ), в котором обе величины определяются экспериментально. При рассмотрении смачивания поверхностей можно сделать следующие выводы: 1. Лиофильные поверхности (гидрофильные, олеофобные Полное смачивание:θ=0о;cosθ= 1,.Wa=Wк Смачивание: 0о<θ=90о; 0 2. Лиофобные поверхности (гидрофобные, олеофильные) Полное несмачивание: θ = 180о; cosθ = -1,. Wa = 0 Несмачивание: 90о<θ=180о; -1 Разберем, почему органические жидкости смачивают любые поверхности: а) работа когезии воды Wк = 2 σж/г≈ 144 мДж/м2 В когезионные силы воды входят все виды Ван—дер—Ваальсова взаимодействия, водородные связи, поэтому вода будет хорошо смачивать полярные поверхности (например, стекло), с которыми у нее будут сильные взаимодействия, в этом случае Wк ≈Wa.; с неполярными поверхностями (парафин) взаимодействие молекул воды ограничивается только теми силами, которые действуют внутри неполярной фазы, т.е. дисперсионными (+индукционными), поэтому Wa< б) для неполярной органической жидкости Wк = 2σж/г≈ 45 мДж/м2, поэтому для любой поверхности такая работа когезии одного порядка с работой адгезии между контактирующими фазами. Лучше смачивает данную поверхность та жидкость, которая ближе по полярности к смачивающему веществу. Чем выше полярность жидкости, тем слабее ее смачивающие свойства: ртуть смачивает только некоторые металлы, вода — полярные поверхности, органические жидкости — любые поверхности. Избирательное смачивание При нанесении на поверхность двух жидкостей, нерастворимых друг в друге, между ними образуется краевой угол, характеризующий относительную способность этих жидкостей смачивать данное тело. Т.е. проявляется избирательность смачивания. Для сравнительной оценки смачиваемости поверхности сопоставление проводят по сравнению с водой, если угол 0< θ<90о со стороны полярной жидкости (Н2О), то поверхность гидрофильна. Гидрофильные поверхности — оксиды, гидроксиды, соли и т.д. Если угол θ<90о со стороны углеводорода, то поверхность гидрофобна. 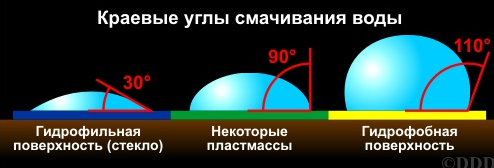 На избирательном смачивании основано явление флотации. Флотация — избирательное смачивание. Частицы не тонут, если они гидрофобны, т.е. испытывают влияние флотационной силы, направленной перпендикулярно поверхности жидкой фазы. Ее действие направлено вверх; если частицы смачиваются водным раствором, флотационная сила направлена вниз, поэтому частицы тонут. Инверсия смачиваемости поверхности Инверсия смачиваемости поверхности заключается в качественном ее изменении за счет адсорбции ПАВ на твердой поверхности. 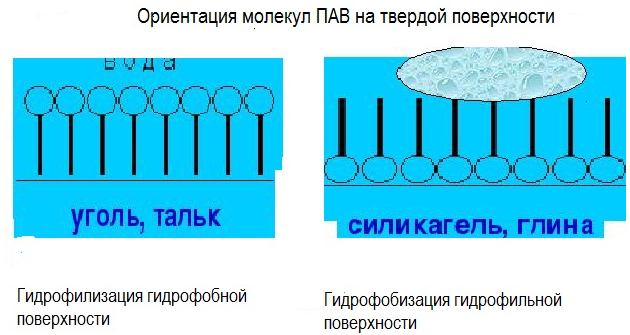 Природу поверхности твердого тела, а значит, и характер смачивания можно изменить путем модифицирования поверхности, например, проведя её химическую обработку. Адсорбция ПАВ влияет не только на величину, но даже на знак cosθ.Если в процессе обработки поверхности происходит изменение смачиваемости на противоположное, говорят об инверсии смачивания поверхности. Концентрация раствора ПАВ, при которой это происходит, называется точкой инверсии (т.А). 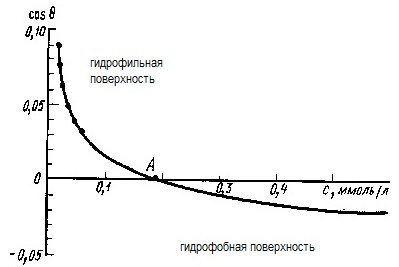 Количественные характеристики процесса смачивания поверхности. Среди этих характеристик можно назвать те, о которых мы уже говорили: а) угол смачивания θ и cosθ Различают равновесные и неравновесные краевые углы. Равновесные p определяются только значениями поверхностного натяжения (поверхностной энергии Гиббса) на границах раздела всех трех фаз. Равновесию отвечает минимум поверхностной энергии Гиббса, поэтому для каждой системы при данных внешних условиях p имеет только одно значение, определяемое по уравнению Юнга: 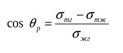 Неравновесных же краевых углов может быть множество. Следует однако отметить, что в зависимости от условий проведения экспериментов (шероховатость поверхности, наличие неорганических ионов или ПАВ в смачивающей жидкости) измеренный краевой угол может существенно отличаться от Р. Формирование капли жидкости на твёрдой поверхности в среде газа сопровождается наложением множества факторов: веса капли, шероховатости поверхности и т.п., учесть которые не представляется возможным. Поэтому истинные свойства поверхности можно установить лишь в условиях избирательного смачивания, когда капля исследуемой жидкости (1) помещена в фазу другой жидкости (2), несмешивающейся с первой. Уравнение Юнга в этом случае имеет вид: 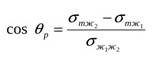 Проанализируем это уравнение: 1. Если = 00 происходит полное смачивание поверхности - растекание жидкости 1 по поверхности в виде тонкой пленки. 2. Если б) работа адгезии Wa.; в) теплота смачивания. Количественно теплоту смачивания используют для оценки смачивания поверхности порошков. Количественно оценивают эту величину калориметрическим методом по теплоте смачивания, которая выделяется при погружении порошка в жидкость. Смачивание приводит к образованию новой границы фаз: тв.т./ж вместо тв.т./г и сопровождается уменьшением поверхностной энергии. ∆Нсм= изменению полной поверхностной энергии 1 кг твердого вещества при перенесении его из воздуха в жидкость и связана с изменением Us уравнения Гиббса — Гельмгольца. Для гидрофильных поверхностей qсм водой больше qсм маслом (орг.ж.). Характеристикой смачиваемости в этом случае является коэффициент гидрофильности b: Для гидрофильных поверхностей b>1.Рассмотрим данные по смачиваемости некоторых порошков (табл.): Таблица qсм и b порошкообразных веществ
2.5.6. Измерение краевого угла смачивания 1. Непосредственное проецирование капли на экран, построение касательной к полученной капле из и точки контакта трех фаз и определение краевого угла смачивания геометрически с помощью транспортира либо расчет cosθ по диаметру и высоте капли по формуле: 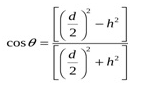 2. Для измерения краевого угла смачивания θ между двумя несмешивающимися жидкостями пластинку из исследуемого вещества погружают в стеклянную кювету с более легкой жидкостью и на поверхность наносят помощью пипетки более тяжелую. Для более точного определения исключают загрязнения, окислы на поверхности, адсорбции воздуха. Пластинку помещают в стеклянную кювету и после смачивания устанавливают в горизонтальное положение. Далее на пластинку вводят пузырек воздуха и далее определяют краевой угол смачивания θ. РАСТЕКАНИЕ Предельным (максимальным) случаем смачивания является растекание. Как правило, оно происходит в результате взаимодействия (соприкосновения) тел, строение молекул которых похоже. Например, на поверхности воды (тело с полярными молекулами) растекаются органические кислоты, растворы их солей, высшие спирты и другие вещества с полярными молекулами. Растекание возможно и при контакте двух взаимно нерастворимых тел (жидкостей), обладающих значительным различием поверхностных натяжений и достаточно большими силами адгезии, обуславливающими достаточно малое значение поверхностного натяжения на границе между жидкостью и смачиваемым телом. Капля жидкости, нанесенная на поверхность, может оставаться на ее определенном участке, и система будет находится в равновесии в соответствии с законом Юнга, или же растекаться по поверхности. В обоих случаях система переходит в состояние с минимальной энергией Гиббса. Условие растекания: ϭ3,1 > ϭ 2,3 + ϭ 2,1 Из этого соотношения следует, что уменьшение межфазного натяжения ϭ2,3 (увеличение работы адгезии) и поверхностного натяжения жидкости ϭ 2,1, способствует растеканию жидкости. Растекание происходит в том случае, если работа адгезии превышает работу когезии. Способность жидкости растекаться зависит от когезии наносимых на поверхность жидкостей. С повышением температуры увеличивается работа адгезии, поэтому нерастекающаяся жидкость с увеличением температуры может начать растекаться. При определении смачивания поверхности очень полезным выражением является коэффициент растекания f. Если жидкость растекается на поверхности твердого тела или жидкости, с которой она не смешивается, обе фазы притягиваются друг к другу. Cила притяжения направлена против сил когезии растекающейся жидкости. Таким образом, коэффициент растекания равен энергии адгезии минус энергия когезии растекающейся жидкости: f = Wa - Wk. f>0 - жидкость растекается по поверхности; f<0 - жидкость не растекается по поверхности.  | ||||||||||||||||||
