Курсовая работа Ферменты по Физ. Курсовая работа. Метаболическая биохимия
 Скачать 1.57 Mb. Скачать 1.57 Mb.
|
|
Санкт-Петербургский политехнический университет Петра Великого Институт физики, нанотехнологий и телекоммуникаций Высшая инженерно-физическая школа Курсовая работа Ферменты, основы ферментативной кинетики. Характеристика обратной транскриптазы, класс трансферазы и расчетное задание. по дисциплине: «Метаболическая биохимия» Выполнил студент гр. 3430302/80201 А.В. Храмцова <подпись> Преподаватель доцент., к.б.н. А.Н. Савельев <подпись> «30» марта 2022 г. ОглавлениеВведение 2 Историческое название фермента 3 Название по номенклатуре ферментов 3 Историческая справка 3 Распространенность в природе 4 Информация о гене 5 Строение белка 6 Строение активного центра 8 Предполагаемый механизм ферментативной реакции 10 Субстратная специфичность 11 Температурная стабильность + pH-оптимум 11 Методы выделения и очистки 12 Применение фермента 12 Литература 14 ВведениеЦелью работы является детальное рассмотрение выбранного фермента. В качестве объекта для описания была выбрана обратная транскриптаза, также известная как РНК-зависимая ДНК-полимераза или ревертаза. Обратная транскриптаза – фермент, катализирующий синтез ДНК на матрице РНК в процессе обратной транскрипции. Ферменты кодируются и используются вирусами, которые используют обратную транскрипцию в качестве шага в процессе репликации. Вирусы с обратной транскрипцией РНК, такие как ретровирусы, используют этот фермент для обратной транскрипции своих геномов РНК в ДНК, которая затем интегрируется в геном хозяина и реплицируется вместе с ним. Вирусы с обратной транскрипцией ДНК, такие как гепаднавирусы, могут позволить РНК служить в качестве матрицы при сборке и создании цепей ДНК. Без обратной транскриптазы вирусный геном не смог бы интегрироваться в клетку-хозяин, что привело бы к невозможности репликации. Историческое название ферментаРНК-направленная ДНК полимераза. Фермент был назван так Х. Теминым, и С. Музатани в 1970 году. Название по номенклатуре ферментовПринятое имя по номенклатуре ферментов – РНК-направленная ДНК полимераза (RNA-directed DNA polymerase). Систематическое название – 2'-дезоксирибонуклеозид-5'-трифосфат (ДНК-дезоксинуклеотидилтрансфераза (РНК-направленная)) К.Ф. 2.7.7.49 Историческая справкаОбратные транскриптазы были обнаружены Х. Темином в Университете Висконсин-Мэдисон в саркоме Рауса вирионов и независимо изолированы Д. Балтимором в 1970 г. в Массачусетском технологическом институте от двух опухолевых РНК-вирусов: вируса лейкемии мышей и снова вируса саркомы Рауса. За свои достижения они разделили Нобелевскую премию по физиологии и медицине 1975 года. Эксперименты Х. Темина и Д. Балтимора сводились к следующему: вирус саркомы Рауса (или вирус лейкемии мышей) подвергался обработке детергентами с целью разрушения поверхностных структур, а именно оболочек вирусов. Частично депротеинизированный вирус вносился в пробирку, в которую добавлялись 4 дезоксирибонуклеотида, активированные дезоксинуклеотидтрифосфаты, один из которых был мечен радиоктивным изотопом в присутствии магния. Смесь инкубировалась, и в результате инкубации образовывался кислотно нерастворимая фракция, что являлось показателем ДНК. Данная фракция была устойчива к щелочам и к РНК-полимеразе, но разрушалась под действием ДНК-полимеразы. Таким образом, было продемонстрировано, что в данных условиях на РНК-матрице синтезируется двунитевая ДНК за счет имеющихся ферментов. Распространенность в природеОбратные транскриптазы присутствуют во многих организмах, во всех эукариотах (животных и растениях), а также в археях, бактериях, ретротранспозонах, сплайсосомах, а также в иммунной системе человека и бактерий. В клетках млекопитающих также есть обратная транскриптаза, источником которой являются не ретровирусы, а их родственники, ретротранспозоны – предшественники или процессированные «деформированные» ретровирусы. Обратные транскриптазы используются некоторыми вирусами, такими как ВИЧ и вирусом гепатита B, для репликации своих геномов с помощью мобильных генетических элементов ретротранспозона для пролиферируют в геноме хозяина и эукариотическими клетками, удлиняя теломеры на концах их линейных хромосом. Обратная транскриптаза входит в состав нуклеопротеидного компонента онковирусов птиц и млекопитающих, в том числе приматов. Фермент со свойствами обратной транскриптазы ретровирусов обнаружен в медленных вирусах, в ретровирус-подобных частицах, выделенных из молока и плаценты человека. РНК-зависимая ДНК-полимеразная активность свойственна также препаратам ДНК-полимеразы кишечной палочки. РНК-направленная ДНК полимераза, главным образом, связана с ретровирусами. Однако неретровирусы также используют обратную транскриптазу (например, вирус DsDNA-RT, который является членом Hepadnaviridae, в то время как ретровирусы - ssRNA вирусы). Информация о генеБольшинство обратных транскриптаз, используемых в молекулярной биологии, получены из гена pol вируса миелобластоза птиц (AMV) или вируса лейкоза мышей Молони (MMLV). Хорошо изучены следующие обратные транскриптазы: Обратная транскриптаза ВИЧ-1 из вируса иммунодефицита человека типа 1. Данная обратная транскриптаза содержит две субъединицы, которые имеют соответствующие молекулярные массы 66 и 51 кДа. Обратная транскриптаза M-MLV вируса лейкемии мышей Молони. Она представляет собой единственный мономер 75 кДа. Обратная транскриптаза AMV из вируса миелобластоза птиц. Также имеет две субъединицы: субъединицу 63 кДа и субъединицу 95 кДа. Теломеразная обратная транскриптаза. Основная функция - поддержка теломер из эукариотических хромосом. Известно расположение гена теломеразной обратной транскриптазы для человека (рис.1), а также для мыши (рис.2). 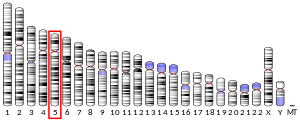 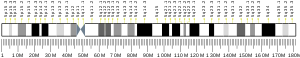 Рис.1. Расположение гена теломеразной обратной транскриптазы для человека: Хромосома 5, Группа 5п15.33. Начало - 1 253 147 п.н. Конец - 1,295,068 п.н.   Рис.2. Расположение гена теломеразной обратной транскриптазы для мыши. Хромосома 13. Группа 13 C1 | 13 40,12 см. Начало - 73 626 911 п.н. Конец - 73 649 843 п.н. Строение белкаОбратные транскриптазы включают в себя РНК-зависимую ДНК-полимеразу и ДНК-зависимую ДНК-полимеразу, которые сотрудничают, чтобы выполнить транскрипцию. В дополнение к функции транскрипции у ретровиральных обратных транскриптаз есть область, принадлежащая RNase H семья, которая жизненно важна для их повторения. Обратные транскриптазы имеют "правостороннюю" структуру, характерную для клеточных Dnap, с ладонными и пальцевыми поддоменами, а также пространственно разделенным доменом РНКазы H. Обратная транскриптаза представляет собой гетеродимерный белок из двух субъединиц, Р51 и Р66 (рис. 3), кодируемых матрицей Р66 и, следовательно, идентичных по последовательности, за исключением отсутствия у С-конца домена РНКазы-Н в Р51 в результате протеолитического процессинга. Структура Р51 является жесткой и обеспечивает структурную поддержку более гибкой субъединице Р66, которая подвергается функционально важным конформационным перестройкам. Несвязанный Р66 преимущественно складывается в закрытую конформацию «правой» формы с «большим пальцем», смятым вниз на «пальцах» (рис. 4). При связывании нуклеиновой кислоты «большой палец» поднимается вверх, а «пальцы» складываются вниз, чтобы удерживать входящий нуклеотид для продуктивной реакции. Внутри поддомена «ладонь», а также рядом с гибким «большим пальцем», расположен гидрофобный ненуклеозидный связывающий карман (NNBP). 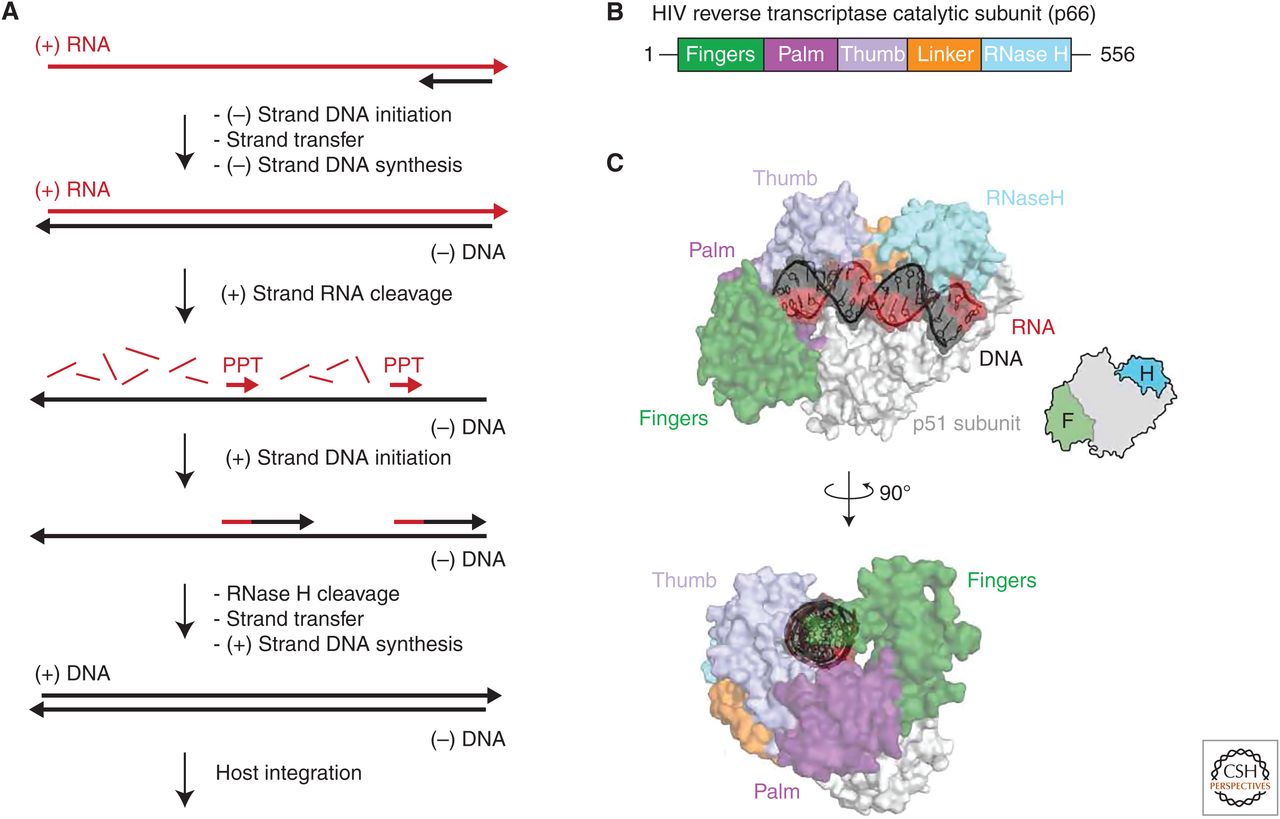 Рис. 3. Консервативная доменная организация субъединицы p66 обратной транскриптазы ВИЧ-1. 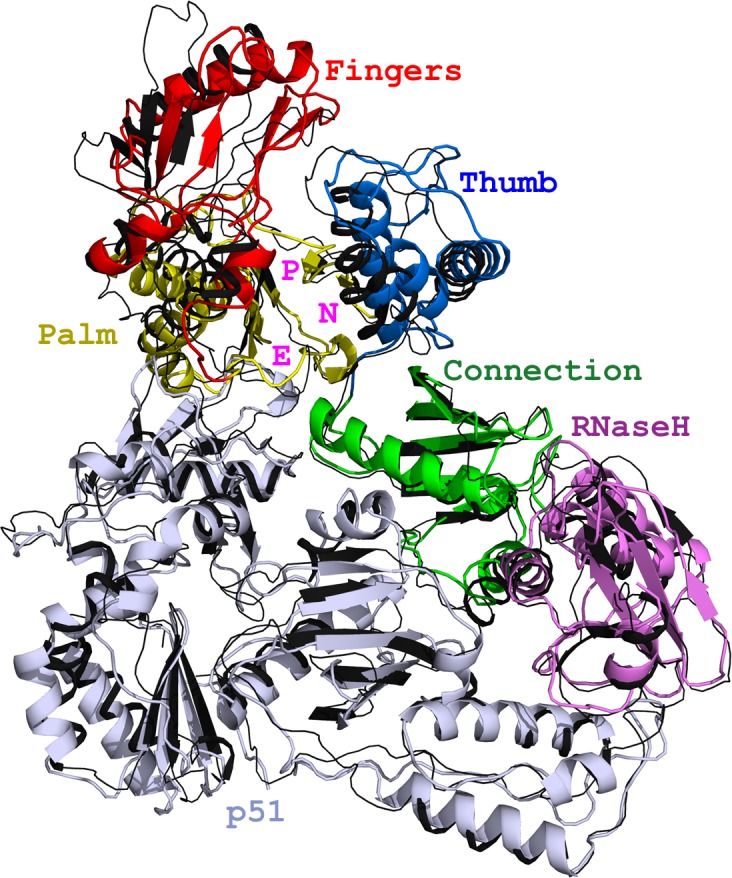 Рис. 4. Структура обратной транскриптазы ВИЧ-1. Строение активного центраP66 и p51 имеют общий аминокислотный конец, p66 имеет 560 аминокислот в длину, p51-440 аминокислот в длину. Р66 содержит активные центры для обеих ферментативных активностей обратной транскриптазы (полимеразы и РНКазы Н); меньшая субъединица играет структурную роль (Рис.5, 6). 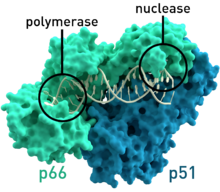 Рис. 5. Кристаллографическая структура обратной транскриптазы ВИЧ-1, в которой окрашены две субъединицы Р51 и Р66 и выделены активные центры полимеразы и нуклеазы. Р66 состоит из двух пространственно различных доменов-полимеразы и РНКазы Н. Полимеразный домен состоит из четырех субдоменов: «пальцы» (остатки 1-85 и 118-155), «ладонь» (остатки 86-117 и 156-236), «большой палец» (237-318) и «соединение» (319-426). Р51 складывается в те же четыре подобласти, что и полимеразный домен p66, однако положения подобластей относительно друг друга различны в p66 и p51 (рис. 6). 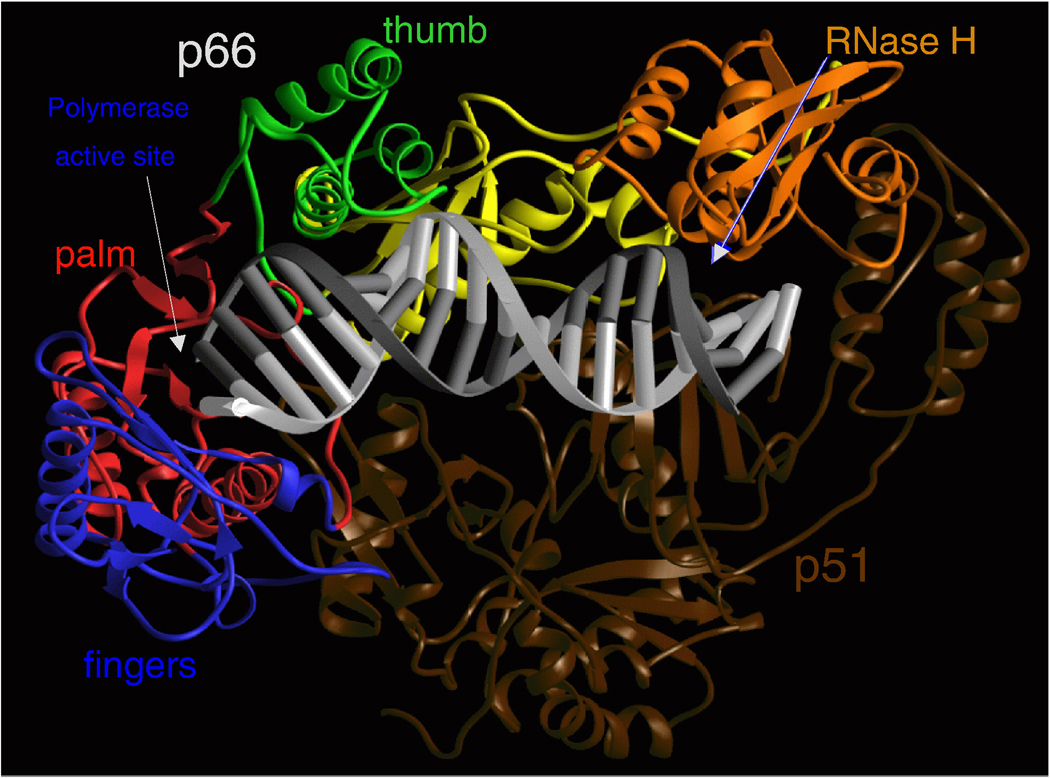 Рис.6 Схематичное представление активных центров обратной транскриптазы. Полимеразный активный центр состоит из трех каталитических карбоксилатов (D110, D185, и D186) в поддомене «ладонь» субъединицы p66. D185 и D186 являются частью мотива YXDD, который высоко консервативен в ретровирусных РТС (X встречается в ВИЧ – РТ и Val, Leu или Ala в других ретровирусах). Другие консервативные остатки, которые помогают формировать dNTP связывания обратной транскриптазы, включают в себя: а) Р72 и К65, которые участвует в процессе связывания на β - и γ - фосфатов в поступающей dNTP; б) остатков Y115 и Q151, которые непосредственно взаимодействует с 3’-ОН, входящих в dNTP (рис. 7). 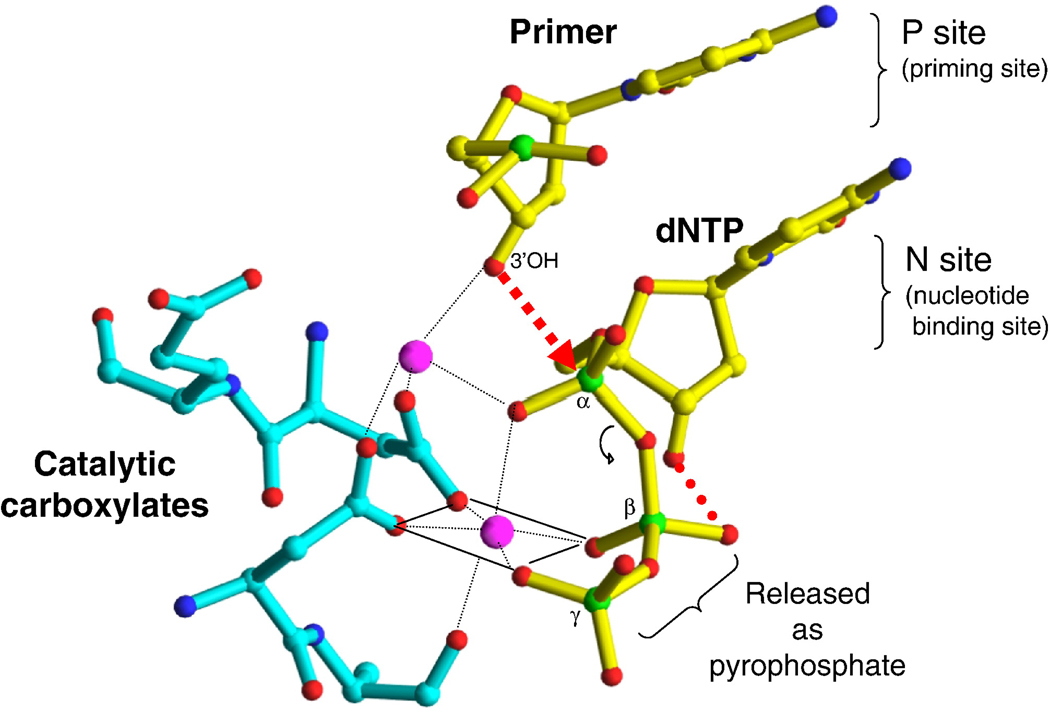 Рис.7. Схематичное представление полимеразного активного центра обратной транскриптазы. Предполагаемый механизм ферментативной реакцииКатализирует удлинение 3'- конца цепочки ДНК, направленное на РНК-шаблон, одним дезоксинуклеотидом за один раз (рис.8).  Рис.8. Механизм ферментативной реакции. Обратная транскриптаза представляет собой фермент, катализирующий синтез ДНК на матрице РНК в процессе, который получил название “обратная транскрипция”. Чтобы начать синтез, ревертазе необходим короткий двухцепочечный участок (праймер). Праймером может служить одноцепочечный сегмент как РНК, так и ДНК, которые в процессе реакции оказываются ковалентно связанными с новосинтезированной цепью ДНК. Обратную транскриптазу преимущественно используют для транскрипции матричной РНК в комплементарную ДНК (кДНК). Реакцию обратной транскрипции проводят в специально подобранных условиях с использованием сильных ингибиторов РНКазной активности. При этом удается получать полноразмерные ДНК-копии целевых молекул РНК. После синтеза на мРНК комплементарной цепи ДНК и разрушения РНК (обычно применяют обработку щелочью) осуществляют синтез второй цепи ДНК. При этом используют способность ревертазы образовывать на 3'-концах одноцепочечных кДНК самокомплементарные шпильки, которые могут выполнять функции праймера. Субстратная специфичностьРетровирусная обратная транскриптаза может использовать в качестве субстрата вирусную РНК, а также ряд специально подобранных веществ, например, 3'-Азидо-3'-дезокситимидин 5'-трифосфат (AZTTP). Ингибировать ферментативные реакции с обратной транскриптазой могут НИОТ (нуклеозидные ингибиторы обратной транскриптазы). НИОТ являются аналогами эндогенных нуклеозидов, но в них отсутствует 3'-ОН дезоксирибозного сахара, который служит местом для 5' - 3'-фосфодиэфирной связи с исходящей нуклеиновой кислотой. Также специфическим ингибитором активности обратной транскриптазы млекопитающих содержится в экстракте плаценты человека. Этот ингибитор взаимодействует с ретровирусоподобными частицами в экстрактах плаценты человека. Данный ингибитор не обладает нуклеазной, протеазной или фосфатазной активностью. Поскольку его ингибирующее действие может быть устранено добавлением большего количества вируса к реакции, неспецифическая инактивация ферментного субстрата была исключена. Температурная стабильность + pH-оптимумТеоретическая изоэлектрическая точка (IEP) обратной транскриптазы равна - 9,2. Однако для обратной транскриптазы ВИЧ-1 практический ИЭП был определен с помощью хроматофокусировки и составлял приблизительно pH = 8,0. Оптимальная активность обратной транскриптазы AMV lbcnbuftncz достигается при температуре 42-48° C (рН 8,3), и при этой температуре мышиный фермент уже деградирует. Оптимум рН для обратной транскриптазы вируса мышинного лейкоза Молони (MLV) составляет 7,6. Оба фермента имеют гораздо более низкую активность, немного ниже или выше оптимума рН. Обратная транскриптаза GoScript™ активна в диапазоне 25-55°C, причем наибольшая активность наблюдается при 37-42°C. Методы выделения и очисткиВыделяют обратную транскриптазу с помощью метода рекомбинантных структур. Например, во многих исследованиях обратная транскриптаза была экспрессирована в E. coli с использованием специфичных векторов. Эффективность такого выделения наблюдается с помощью метода имунно-блотинга. Многие процедуры очистки обратной транскриптазы состоят из осаждения сульфатом аммония или полиэтиленгликолем (ПЭГ). Альтернативным методом осаждения является хроматография на фосфоцеллюлозе или сочетание обоих методов. После начальной стадии очистки применяются хроматографические методы. К ним относятся комбинации ионообменной хроматографии и аффинной хроматография с использованием гепарина или ssДНК. Эксклюзионная хроматография используется в качестве конечной стадии очистки. Применение ферментаРетровирусная обратная транскриптаза имеет три последовательных биохимических активности: РНК-зависимую ДНК-полимеразную активность, рибонуклеазу H (РНКазу H) и ДНК-зависимую ДНК-полимеразную активность. В совокупности эти активности позволяют ферменту превращать одноцепочечную РНК в двухцепочечную кДНК. В ретровирусах и ретротранспозонах эта кДНК может затем интегрироваться в геном хозяина, из которого могут быть созданы новые копии РНК посредством транскрипции клетки-хозяина. Та же последовательность реакций широко применяется в лаборатории для преобразования РНК в ДНК, для использования в молекулярном клонировании, секвенировании РНК, полимеразной цепной реакции (ПЦР), или анализ генома. В генной инженерии обратную транскриптазу используют для получения ДНК копии гена, если удается выделить из донорной клетки соответствующую гену матричную РНК. Синтез гена с помощью ревертазы ведут таким образом: сначала в систему вводят м-РНК, набор ДНК нуклеотидов, праймеры – олиго (dT) и обратную транскриптазу, которая начинает синтезировать на матрице м-РНК комплементарную цепь ДНК. Затем с помощью щелочного гидролиза удаляют м-РНК, а обратная транскриптаза, используя только что образованную цепь ДНК как матрицу, синтезирует на ней еще одну комплементарную цепь. Для ускорения синтеза второй цепи ДНК на этой стадии иногда добавляют ДНК-полимеразу от E. coli, которая дублирует полимеризующую активность ревертазы. По окончании синтеза первая и вторая цепи ДНК оказываются связанными петлей в виде шпилечной структуры. Эту петлю расщепляют эндонуклеазой S 1, которая способна специфически гидролизовать одноцепочечные участки нуклеиновых кислот. В результате получают полноценную ДНК- копию гена, которую можно легко встроить в вектор и ввести в клетку-реципиента. Так как обратная транскриптаза ВИЧ используется, чтобы копировать вирусный генетический материал и производить новые вирусы, многие лекарства были разработаны, чтобы разрушить процесс и таким образом подавить активность вируса. Эти лекарства, известные как обратные ингибиторы транскриптазы, включают нуклеозид и зидовудин. Обратная транскриптаза также используется в производстве инсулина. Вставляя эукариотическую мРНК для производства инсулина наряду с обратной транскриптазой в бактерии, мРНК может быть вставлена в геном прокариота. Таким образом можно получать инсулин, не прибегая к традиционным источникам, таким как поджелудочная железа свиньи. ЛитератураTemin HM, Mizutani S. RNA-dependent DNA polymerase in virions of Rous sarcoma virus. Nature. 1970 Jun 27;226(5252):1211-3. doi: 10.1038/2261211a0. Erratum in: Nature. 1970 Jul 4;227(5253):102. PMID: 4316301. BALTIMORE, D. Viral RNA-dependent DNA Polymerase: RNA-dependent DNA Polymerase in Virions of RNA Tumour Viruses. Nature 226, 1209–1211 (1970). S. M. Torres, V. E. Walker, in Comprehensive Toxicology, 2010 http://propionix.ru/f/naglyadnaya_biotehnologiya.pdf http://ru.knowledgr.com/00017370/ОбратнаяТранскриптаза https://brenda-enzymes.org/enzyme.php?ecno=2.7.7.49 Autexier C, Lue NF. The structure and function of telomerase reverse transcriptase. Annu Rev Biochem. 2006;75:493-517. doi:10.1146/annurev.biochem.75.103004.142412. PMID: 16756500. Sarafianos SG, Marchand B, Das K, et al. Structure and function of HIV-1 reverse transcriptase: molecular mechanisms of polymerization and inhibition. J Mol Biol. 2009;385(3):693-713. doi:10.1016/j.jmb.2008.10.071 Rani S, O'Driscoll L. Reverse-transcriptase polymerase chain reaction to detect extracellular mRNAs. Methods Mol Biol. 2011;784:15-25. doi: 10.1007/978-1-61779-289-2_2. PMID: 21898210. https://ru.qaz.wiki/wiki/Telomerase_reverse_transcriptase https://www.genome.jp/dbget-bin/www_bget?ec:2.7.7.49 http://www.ensembl.org/Homo_sapiens/Gene/Summary?db=core;g=ENSG00000164362;r=5:1253147-1295068 https://www.nextprot.org/entry/NX_O14746/ Jansson LI, Stone MD. Single-Molecule Analysis of Reverse Transcriptase Enzymes. Cold Spring Harb Perspect Biol. 2019 Sep 3;11(9):a032458. doi: 10.1101/cshperspect.a032458. PMID: 31481455; PMCID: PMC6719600. Galilee M, Alian A. The structure of FIV reverse transcriptase and its implications for non-nucleoside inhibitor resistance. PLoS Pathog. 2018 Jan 24;14(1):e1006849. doi: 10.1371/journal.ppat.1006849. PMID: 29364950; PMCID: PMC5798851. Malik O, Khamis H, Rudnizky S, Kaplan A. The mechano-chemistry of a monomeric reverse transcriptase. Nucleic Acids Res. 2017 Dec 15;45(22):12954-12962. doi: 10.1093/nar/gkx1168. PMID: 29165701; PMCID: PMC5728418. Nowak E, Potrzebowski W, Konarev PV, Rausch JW, Bona MK, Svergun DI, Bujnicki JM, Le Grice SF, Nowotny M. Structural analysis of monomeric retroviral reverse transcriptase in complex with an RNA/DNA hybrid. Nucleic Acids Res. 2013 Apr 1;41(6):3874-87. doi: 10.1093/nar/gkt053. Epub 2013 Feb 4. PMID: 23382176; PMCID: PMC3616737. https://www.sciencedirect.com/topics/chemistry/rna-directed-dna-polymerase-inhibitor Reardon JE, Miller WH. Human immunodeficiency virus reverse transcriptase. Substrate and inhibitor kinetics with thymidine 5'-triphosphate and 3'-azido-3'-deoxythymidine 5'-triphosphate. J Biol Chem. 1990 Nov 25;265(33):20302-7. PMID: 1700787. Liao LL, Horwitz SB, Huang MT, Grollman AP, Steward D, Martin J. Triphenylmethane dyes as inhibitors of reverse transcriptase, ribonucleic acid polymerase, and protein synthesis. Structure-activity relationships. J Med Chem. 1975 Jan;18(1):117-20. doi: 10.1021/jm00235a029. PMID: 45883. Nelson JA, Levy JA, Leong JC. Human placentas contain a specific inhibitor of RNA-directed DNA polymerase. Proc Natl Acad Sci U S A. 1981 Mar;78(3):1670-4. doi: 10.1073/pnas.78.3.1670. PMID: 6165015; PMCID: PMC319194. https://link.springer.com/referenceworkentry/10.1007/978-1-4020-6754-9_14552?page=729 Le Grice SF, Grüninger-Leitch F. Rapid purification of homodimer and heterodimer HIV-1 reverse transcriptase by metal chelate affinity chromatography. Eur J Biochem. 1990 Jan 26;187(2):307-14. doi: 10.1111/j.1432-1033.1990.tb15306.x. PMID: 1688798. Koller G, Graumann K, Kramer W, Sara M, Jungbauer A. Laboratory-scale production and purification of recombinant HIV-1 reverse transcriptase. J Chromatogr B Biomed Appl. 1995 Feb 3;664(1):107-18. doi: 10.1016/0378-4347(94)00468-k. PMID: 7538852. Санкт-Петербург 2022 |
