Дополнительные вопросы по биохимии. доп вопросы. Метаболизм этанола
 Скачать 1.61 Mb. Скачать 1.61 Mb.
|
|
Метаболизм этанола Метаболизм этанола происходит преимущественно в печени [1]. Молекула алкоголя превращается сначала в уксусную кислоту, которая распадается на воду и углекислый газ. Окисление этанола осуществляется тремя основными путями. Первый путь – преобразование этилового спирта в ацетальдегид с помощью фермента алкогольдегидрогеназы (АДГ). Алкогольдегидрогеназа катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения NADH/NAD+ в клетке[1]. С2Н5ОН + HAD+ ↔ СН3СНО + NADH + H+. У млекопитающих АДГ содержится главным образом в клетках печени, причем 90 % фермента локализовано в ультраструктурных образованиях печеночных клеток – митохондриях. Активность печеночной АДГ – самая высока (для сравнения скажем: активность АДГ сердца в 4 раза, а почек в 50 раз ниже). Имеется ряд веществ, понижающих активность ферментов. Это так называемые ингибиторы. Типичным ингибитором алкогольдегидрогеназы является тетурам (антабус), тиомочевина, 8-оксихиноин, пиразол и его производные, метронидазол (трихопол), производные нитрофуранов (фурацилин, фуразолидон, фурагин). Некоторые из этих веществ используются для лечения хронического алкоголизма [3]. Общий принцип действия указанных веществ схематически можно сформулировать следующим образом: они замедляют окисление этилового спирта или приостанавливают этот процесс на определенной стадии, в частности, на стадии образования ацетальдегида, что приводит к непереносимости алкоголя. Окисление этилового спирта замедляют и некоторые другие спирты, например, метанол (древесный спирт), этиленгликоль. Это объясняется отвлечением части ферментов на собственный метаболизм. Биологическая роль АДГ состоит в разрушении этилового спирта, который образуется в желудочно-кишечном тракте млекопитающих различными микроорганизмами. За сутки в кишечнике человека синтезируется около 1 - 1,5 г эндогенного (внутреннего) алкоголя, его содержание в крови равно приблизительно 0,034 % [3,19]. Алкогольдегидрогеназный путь обеспечивает окисление 75 % принятого этанола. Скорость этого процесса неодинакова у различных людей. У злоупотребляющих спиртными напитками активность фермента повышается, что рассматривается как защитная реакция организма. Устойчивость (толерантность) организма к алкоголю при этом возрастает. И напротив, при тяжелом поражении печени алкоголем (гепатит, цирроз) общая активность фермента падает, и это снижает толерантность к алкоголю. Окисление спирта замедляется, и усиливается его повреждающее действие на печень и весь организм. Каждый последующий прием алкоголя приводит к гибели печеночных клеток (гепатоцитов) с последующей заменой их соединительной тканью. Естественно, соединительная ткань (рубец) не может выполнять многочисленные весьма важные функции гепатоцитов. Заболевание может привести к смерти в связи с печеночной недостаточностью. Второй путь метаболизма алкоголя – окисление этанола при участии цитохром Р450 - зависимой микросомальной этанолокисляющей системы системы [1]. Цитохром Р450-зависимая микросомальная этанолокисляющая система (МЭОС) локализована в мембране гладкого эндоплазматического ретикулума гепатоцитов. МЭОС играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, лекарствами типа барбитуратов и приобретает существенное значение при злоупотреблении этими веществами. Этот путь окисления этанола происходит при участии одной из изоформ Р450 - изофермента Р450 II E1 [1]. При хроническом алкоголизме окисление этанола ускоряется на 50 - 70% за счёт гипертрофии ЭР и индукции цитохрома Р450 II E1. С2Н5ОН+ NADPH + Н+ + О2 → СН3СНО + NADP+ + 2Н2О. Кроме основной реакции, цитохром Р450 катализирует образование активных форм кислорода (О-2, Н2О2), которые стимулируют перекисное окисление липидов (ПОЛ) в печени и других органах. Третий путь – окисление алкоголя в ацетальдегид под влиянием перекиси водорода, которая также образуется клетками печени [1]. Этот путь обеспечивает метаболизм не более 5 % этанола, находящегося в организме. СН3СН2ОН + Н2О2 → СН3СНО + 2Н2О. Следующий этап превращения алкоголя заключается в окислении образованного ацетальдегида до ацетата при участии ряда ферментов, более активных, чем АДГ - FAD-зависимой альдегидоксидазой и NAD+ -зависимой ацетальдегиддегидрогеназой (АлДГ). СН3СНО + О2 + H2O → СН3СООН + Н2О2 . Повышение концентрации ацетальдегида в клетке вызывает индукцию фермента альдегидоксидазы [1, 5]. В ходе реакции образуются уксусная кислота, пероксид водорода и другие активные формы кислорода, что приводит к активации перекисного окисления липидов (ПОЛ). Другой фермент ацетальдегиддегидрогеназа (АлДГ) окисляет субстрат при участии кофермента NAD+. СН3СНО + Н2О + NAD+ → СН3СООН + NADH * H+. Полученная в ходе реакции уксусная кислота активируется под действием фермента ацетил–КоА-синтетазы. Реакция протекает с использованием кофермента А и молекулы АТФ. Образовавшийся ацетил-КоА, в зависимости от соотношения АТФ/АДФ и концентрации оксалоацетата в митохондриях гепатоцитов, может "сгорать" в ЦТК, идти на синтез жирных кислот или кетоновых тел. В разных тканях организма человека встречаются полиморфные варианты АлДГ [1, 5]. Они характеризуются широкой субстратной специфичностью, разным распределением по клеткам тканей (почки, эпителий, слизистая оболочка желудка и кишечника) и в компартментах клетки. Например, изоформа АлДГ, локализованная в митохондриях гепатоцитов, обладает более высоким сродством к ацетальдегиду, чем цитозольная форма фермента. Ферменты, участвующие в окислении этанола, - алкогольдегидрогеназа и АлДГ по разному распределены: в цитозоле - 80%/20% и митохондриях - 20%/80%. При поступлении больших доз алкоголя (более 2 г/кг) из-за разных скоростей окисления этанола и ацетальдегида в цитозоле резко повышается концентрация последнего. Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NH2- группы белков и других соединений в клетке и нарушать их функции. В модифицированных (ацетилированных) белках могут возникать "сшивки", нехарактерные для нативной структуры (например, в белках межклеточного матрикса - эластине и коллагене, некоторых белках хроматина и липопротеинов, формирующихся в печени). Ацетилирование ядерных, цитоплазматических ферментов и структурных белков приводит к снижению синтеза экспортируемых печенью в кровь белков, например альбумина, который, удерживая Na+, поддерживает коллоидно-осмотическое давление, а также участвует в транспорте многих гидрофобных веществ в крови. Нарушение функций альбумина в сочетании с повреждающим действием ацетальдегида на мембраны сопровождается поступлением в клетки по градиенту концентрации ионов натрия и воды, происходит осмотическое набухание этих клеток и нарушение их функций [1, 20, 26]. Активное окисление этанола и ацетальдегида приводит к увеличению отношения NADH/NAD+, что снижает активность NAD+-зависимых ферментов в цитозоле и менее значительно в митохондриях. Равновесие следующей реакции смещается вправо: Дигидроксиацетонфосфат + NADH * Н+ ↔ Глицерол-3-фосфат + NAD+, Пируват + NADH * Н+ ↔ Лактат + NAD+. Восстановление дигидроксиацетонфосфата, промежуточного метаболита гликолиза и глюконеогенеза, приводит к снижению скорости глюконеогенеза. Образование глицерол-3-фосфата повышает вероятность синтеза жира в печени. Увеличение концентрации NADH по сравнению с NAD+ (NADH>NAD+) замедляет реакцию окисления лактата, увеличивается соотношение лактат/пируват и ещё больше снижается скорость глюконеогенеза. В крови возрастает концентрация лактата, это приводит к гиперлактацидемии и лактоацидозу [1]. NADH окисляется ферментом дыхательной цепи NADH-дегидрогеназой. Возникновение трансмембранного электрического потенциала на внутренней митохондриальной мембране не приводит к синтезу АТФ в полном объёме. Этому препятствует нарушение структуры внутренней мембраны митохондрий, вызванное мембранотропным действием этилового спирта и повреждающим действием ацетальдегида на мембраны. Можно сказать, что ацетальдегид опосредованно активирует ПОЛ [1], так как связывая SH-группы глутатиона, он снижает количество активного (восстановленного) глутатиона в клетке, который необходим для функционирования фермента глутатионпероксидазы, участвующего в катаболизме Н2О2. Накопление свободных радикалов приводит к активации ПОЛ мембран и нарушению структуры липидного бислоя. На начальных стадиях алкоголизма окисление ацетил-КоА в ЦТК - основной источник энергии для клетки [1,3]. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот. Этот процесс, помимо АТФ, требует участия NADPH, который образуется при окислении глюкозы в пентозофосфатном цикле. Из жирных кислот и глицерол-3-фосфата образуются триацилглицериды (ТАГ), которые в составе липопротеидов очень низкой плотности (ЛПОНП) секретируются в кровь. Повышенная продукция ЛПОНП печенью приводит к гипертриацилглицеролемии. При хроническом алкоголизме снижение синтеза фосфолипидов и белков в печени, в том числе и апобелков, участвующих в формировании ЛПОНП, вызывает внутриклеточное накопление ТАГ и ожирение печени [1,3]. Однако в период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идёт на синтез кетоновых тел, которые выходят в кровь. Повышение в крови концентрации лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации. Как уже было сказано ранее, реакция образования ацетальдегида из этанола протекает под действием алкогольдегидрогеназы. Поэтому при повышении концентрации ацетальдегида и NADH в клетках печени направление реакции меняется - образуется этанол. Этанол - мембранотропное соединение, он растворяется в липидном бислое мембран и нарушает их функции. Это негативно отражается на трансмембранном переносе веществ, межклеточных контактах, взаимодействиях рецепторов клетки с сигнальными молекулами [1, 3, 5]. Этанол может проходить через мембраны в межклеточное пространство и кровь и далее в любую клетку организма. Как я отмечал выше, конечным продуктом введенного этанола является CO2 и H2O, при этом выделяется сравнительно много энергии – 7,1 ккал/г. Однако следует отметить, что версия о пищевой ценности спиртных напитков несостоятельна, так как для энергетического обеспечения организма необходимы вполне определенные вещества: белки, жиры, углеводы, витамины. Именно эти вещества, а никоим образом не алкоголь, обеспечивают восстановление энергетических запасов, рост и развитие органов человеческого тела. Превращение алкоголя в организме рассматривают как высокоприоритетную функцию клеток печени. Поэтому значительная алкогольная нагрузка подавляет восстановление печеночных клеток, поскольку энергетические ресурсы клеток направлены на обезвреживание повреждающего агента (алкоголя), а не для обеспечения размножения клеток. Алкоголь нарушает многие звенья обмена веществ: белков, жиров, углеводов, минеральных солей. Причиной этих нарушений является повреждающее действие алкоголя на многие ферменты, принимающие участие в обмене веществ [3, 5, 19]. Так же вредно действует алкоголь на мембраны внутриклеточных структур, повышая их проницаемость. Это, в свою очередь, подавляет аэробное (с участием кислорода) энергообразование при алкогольном отравлении и способствует переходу обмена веществ на анаэробные (бескислородные) пути [3]. Все эти нарушения обмена веществ приводят к накоплению кислых продуктов в органах и тканях организма. В норме в организме существует строгое равновесие между кислыми и щелочными продуктами. Смещение кислотно-щелочного равновесия в ту или иную сторону даже в небольшой мере приводит к серьезным нарушениям обмена веществ, порой несовместимых с жизнью. Фолатный цикл Термины «фолат» и «фолиевая кислота» часто взаимозаменяемы. Единственная разница между ними состоит в том, что фолат относится к естественному, встречающемуся в природе веществу. Известен как витамин B9. Фолиевая кислота является синтетическим веществом, которая в натуральном виде не встречается, но известна также как витамин B9. Оба этих вещества взаимодействуют в организме почти одинаково, с той лишь разницей, что синтетическая форма (фолиевая кислота) всасывается более легко в кишечнике, нежели фолат. И это очень необычно, так как обычно синтетические формы питательных веществ поглощаются медленнее, чем природные. 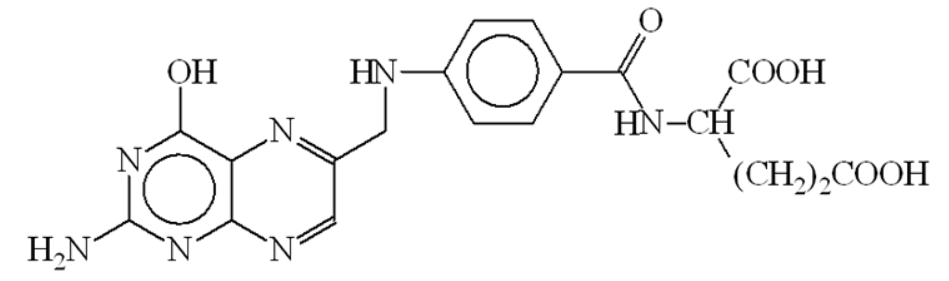 Фолаты – производные фолиевой кислоты (витамина B9), играющие ведущую роль в широком спектре жизненно важных процессов: Стимулирует эритропоэз Участвует в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов Участвует в обмене холина, гистидина Является важным сопутствующим фактором в метилировании ДНК и РНК Способствует регенерации мышечной ткани Влияет на развитие быстрорастущих органов (структур) (кожа, оболочки ЖКТ, костный мозг) Способствует нормальному созреванию и функционированию плаценты Оказывает эстрогеноподобное действие Выполняет защитную функцию при беременности по отношению к действию на плод тератогенных и повреждающих факторов Фолатный цикл – это каскадный процесс синтеза аминокислоты метионина из гомоцистеина в человеческом организме. Процесс синтеза контролируется 3-мя ферментами: метилентетрагидрофолатредуктаза (MTHFR); метионин-синтаза (MTR); метионин-синтаза-редуктаза (MTRR). 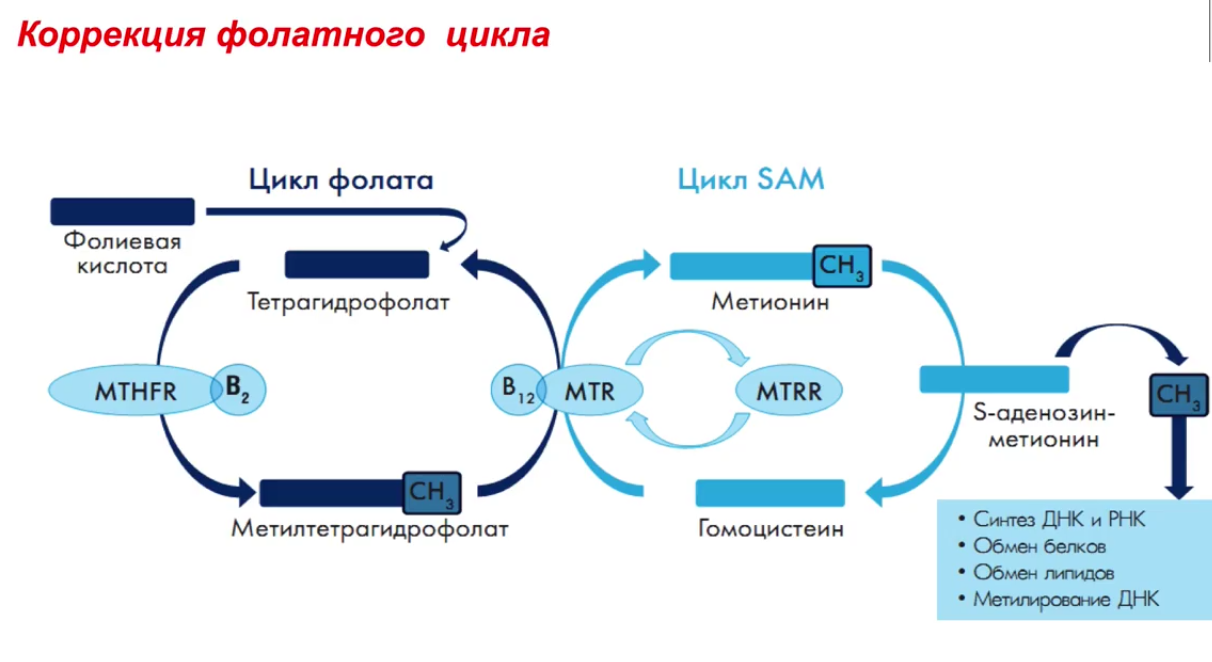 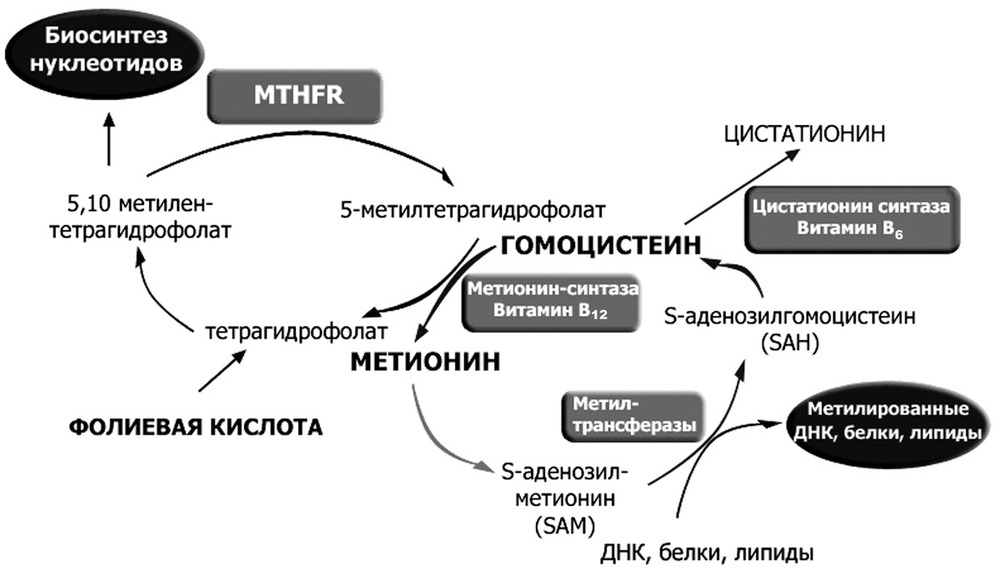 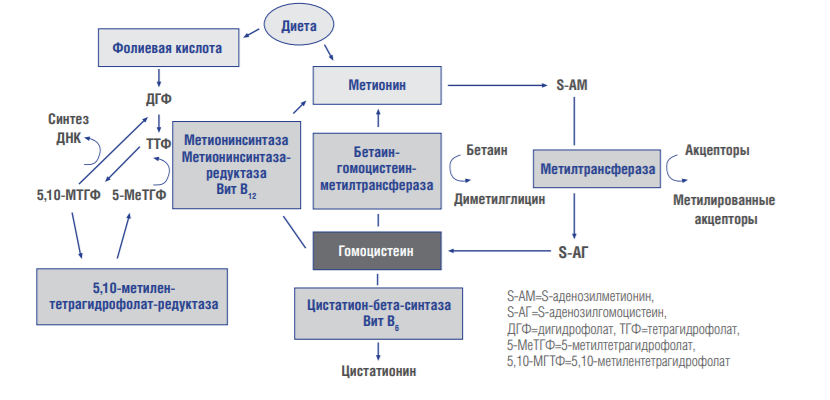 Патологии, к которым приводит гипергомоцистеинемия: Осложнения беременности - фетоплацентарная недостаточность, преэклампсия, преждевременная отслойка нормально расположенной плаценты (ПОНРП), замершая беременность, внутриутробная гибель плода, пороки развития плода в виде незаращения нервной трубки (spina bifida), анэнцефалии, деформации лицевого скелета, синдрома Дауна, пороков сердца. Повышен риск сердечно-сосудистых заболеваний (ишемическая болезнь сердца, инфаркт миокарда, атеросклероз, атеротромбоз). Повышен риск канцерогенеза (колоректальная аденома, рак молочной железы и яичника, острый лимфолейкоз у взрослых). Происходит усиление побочных эффектов при химиотерапии. В настоящее время хорошо изучены и картированы гены и дефекты в них, которые ответственны за синтез ведущих ферментов, метаболизирующих фолиевую кислоту и переработку гомоцистеина в метионин. Это MTHFR, MTR и MTRR. Анализ полиморфизмов в этих генах позволяет определить предрасположенность к указанным выше патологическим процессам и дает возможность своевременно принять меры по корректирующей терапии. Полиморфизм гена метилентетрагидрофолатредуктазы MTHFR(A1298C) и полиморфизм гена редуктазы метионинсинтазы MTRR(A66G) являются тератогенным фактором. Полиморфизм гена метилентетрагидрофолатредуктазы MTHFR(С677Т) предопределяет наследственную гипергомоцистеинемию. Метаболизм лекарств Всасывание; Связывание с белками и транспорт кровью Взаимодействие с рецепторами и распределение в тканях Выведение из организма биотрансформация барбитуратов в печени  активация имипрамина 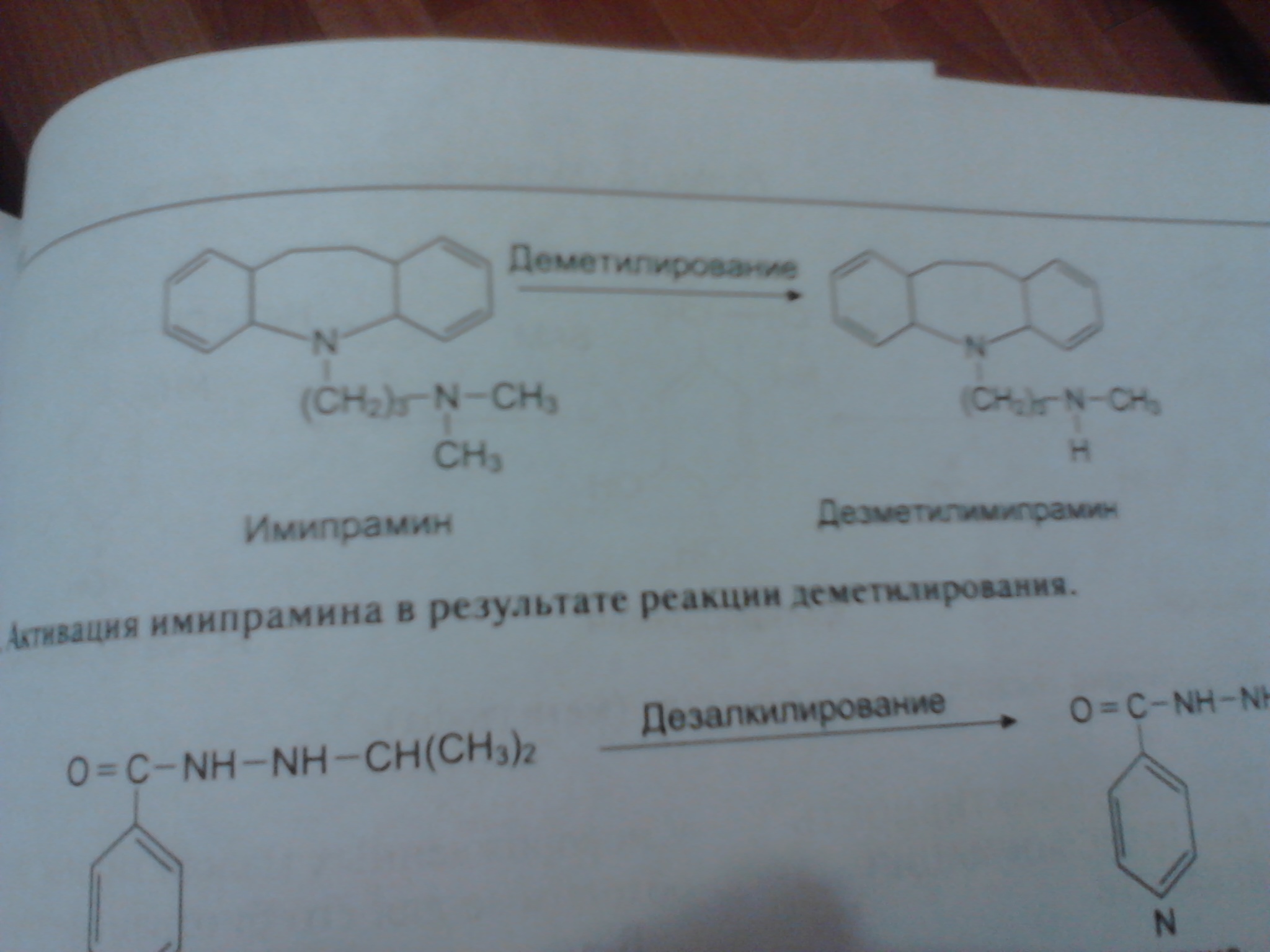 дезалкилирование ипразида 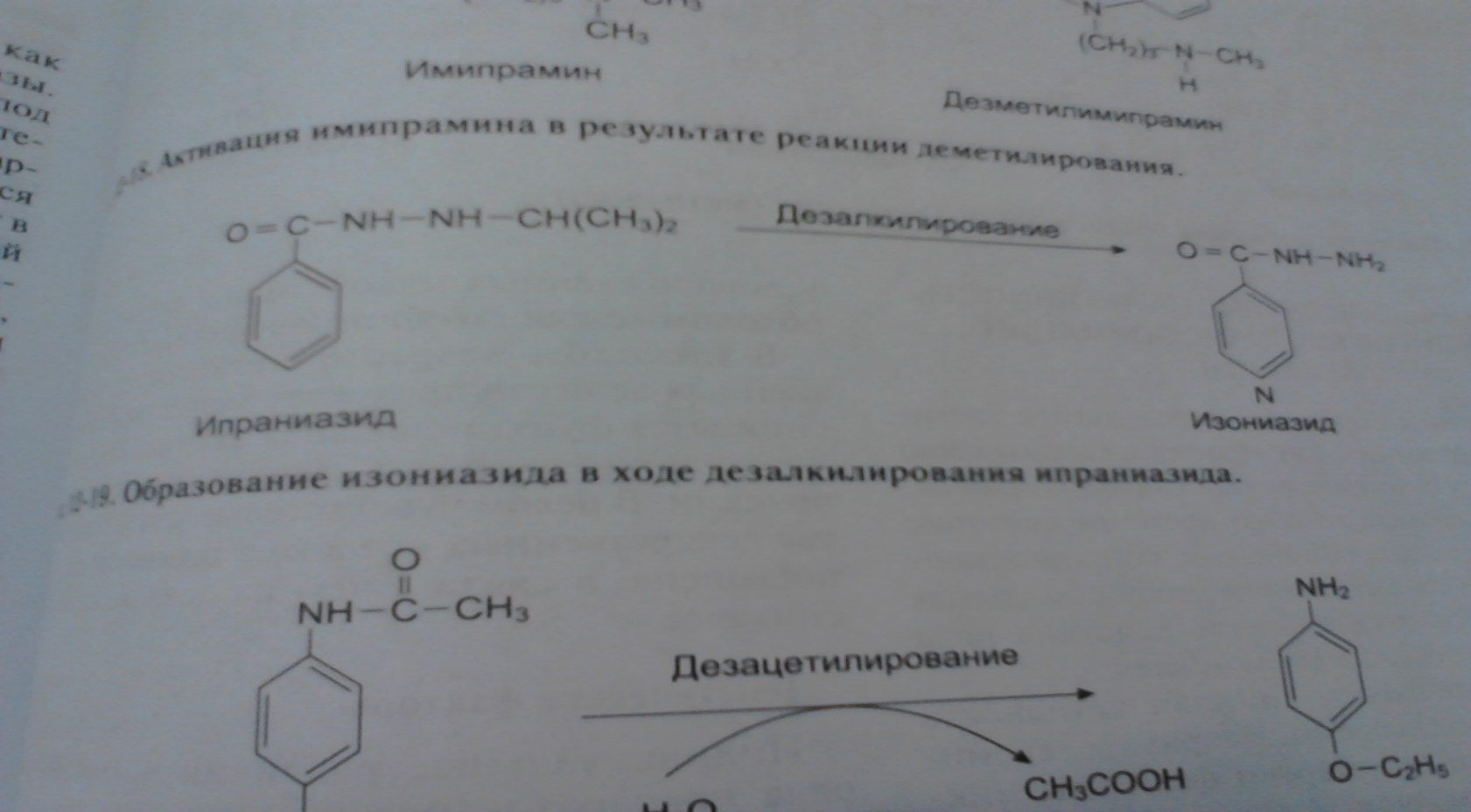 Дезацетилирование фенацетина 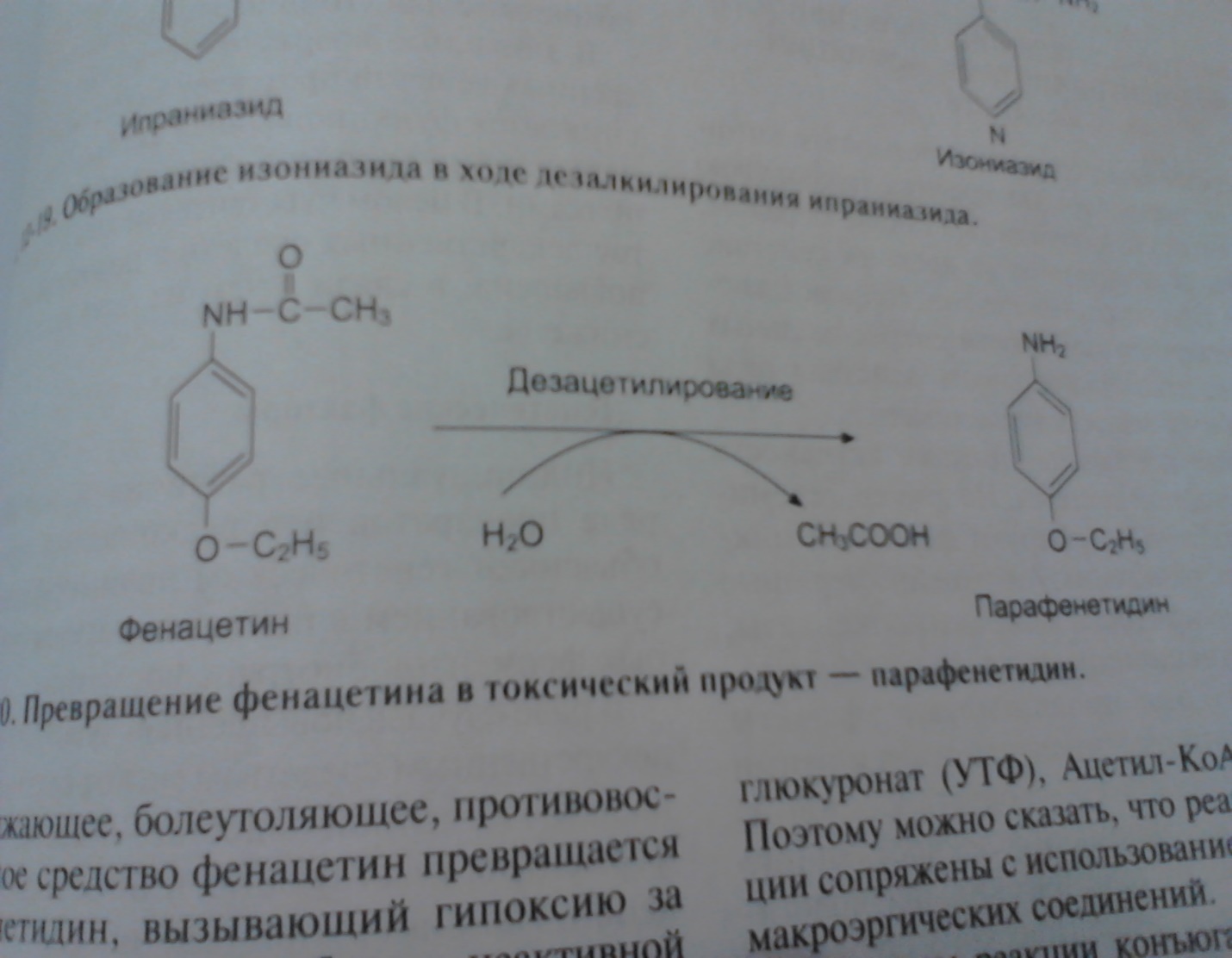 Большинство лекарств метаболизируется до их выведения из организма. Метаболические реакции разделяют на две большие группы — реакции фазы 1 и фазы 2: • реакции фазы 1: окисление, восстановление и гидролиз, в результате которых к молекуле лекарственного вещества присоединяется химическая группа, снижающая активность образованного соединения и повышающая его полярность (и обычно его водорастворимость); • реакции фазы 2: конъюгирование или синтетические реакции с присоединением крупной химической группы. Этот процесс обычно также повышает водорастворимость и облегчает экскрецию препарата из организма. Природа, функции и количество ферментов, метаболизирующих лекарства, у разных индивидов неодинаковы, следствием чего является неодинаковая скорость метаболизма лекарства и его выведения. Ферменты, метаболизирующие лекарства, обладают широкой специфичностью по отношению к субстратам, однако специфичность ферментов носит относительный, а не абсолютный характер. Это означает, что один фермент может катализировать метаболизм многих различных лекарств и что в метаболизме одного и того же лекарства может участвовать несколько изоформ фермента. Обычной метаболической реакцией является окисление. При окислении к молекуле вещества присоединяется гидроксильная группа или удаляется алкильная, или метильная группа. Примером такой реакции может служить деметилирование теофиллина с образованием 1-метилксантина. Первичным ответственным ферментом служит CYP1A2, однако реакцию катализируют также изоформы CYP1A1 и CYP2D6. Метаболизирующие лекарства ферменты представлены множеством форм, и индивидуальные различия их генетической экспрессии определяют индивидуальные различия метаболизма лекарств. Ферменты классифицируют на семейства, подсемейства и продукты специфических генов. Степень экспрессии таких ферментов регулируется на разных уровнях. Некоторые ферменты экспрессируются конститутивно, т.е. они всегда присутствуют и всегда активны. Другие первично экспрессируются лишь вследствие индуцирующего влияния экзогенных химических веществ (лекарств, токсинов и/или пищевых факторов). Мониторинг ксенобиотиков в клинической практике. Проверка большого массива ксенобиотиков на один или несколько видов биологической активности получила название скрининга. Идея скрининга возникла давно – в период становления химической индустрии она уже прочно завоевала себе место в умах фармакологов. Тотальная проверка большого массива химических соединений или природных объектов, направленная на выявление потенциальных лекарств, получила в XX в. свое развитие как один из основных методов поиска новых лекарств (и химических соединений вообще) с заданным типом биологической активности. В 1910 г. одна из немецких фирм испытала около 1200 производных акридина. На «сите» оказались три препарата: трифловин (противопара-зитический), риванол (антисептик) и акрихин (противомалярийный). В поисках заменителя хинина в 30-е годы XX в. было исследовано 16 000 соединений, принадлежащих к различным группам. Среди них 7618-м по счету оказался хлорохин, а 13 272-м – притахин. В 1966 г. в США в поисках противоопухолевых препаратов испытывал ось около 114 000 соединений, из которых было отобрано 12 потенциальных лекарств, но ни одно из них не стало достаточно выдающимся в своем классе фармакологических препаратов. С 1928 г. в СССР на протяжении 10 лет в поисках алкалоидов под руководством исследовано 700 растений, среди которых искомыми оказались всего 60. В следующие 10 лет в результате исследования 4500 растений к этому списку добавилось еще 20 алкалоидов. Системное определение биологической активности всего массива соединений может быть осуществлено путем создания высокопроизводительной системы их классификации по видам биологический активности. Каждый ксенобиотик обладает определенными видами и степенью биологической активности. Необходимо выявить эти свойства и предсказать возможность практического использования данного соединения или его возможную роль в окружающей среде. Выбор тест-объектов и тест-реакций для индикации химического загрязнения окружающей среды Система тестирования ксенобиотиков по видам биологической активности может включать два взаимосвязанных подхода. Первый подход – исследование целевого объекта испытаний (человек, животное, растение, биогеоценоз), на который должно быть направлено действие искомого ксенобиотика исходя из целей поиска (лекарство, ветеринарное средство, гербицид и т. д.); второй – изучение совокупности тест-объектов более примитивной организации, чем целевой. Использование второго подхода оправданно в тех случаях, когда первый не обеспечивает достаточной производительности и т. п. Традиционный путь поиска: с применением фармакологических тестов организменного уровня определяют биологическую активность ряда чужеродных соединений, затем улучшают их свойства путем химической модификации в соответствующих рядах соединений. После этого проводят новые испытания модифицированных веществ, снова их улучшают и т. д. Это делается до тех пор, пока указанная процедура не приведет к созданию наиболее эффективного в данном ряду соединения. Такой подход охватывает лишь один или несколько видов биологической активности и сравнительно малую выборку ксенобиотиков. Обстоятельства, затрудняющие индустриализацию процесса биологического испытания соединений на организменном уровне (в частности на животных): – необходимость большого числа животных в качестве тест-объектов; – затраты большого количества исследуемого химического соединения (на первых порах синтезируются лишь десятки – сотни миллиграммов вещества); – ограниченность автоматизации процесса; – большие временные затраты в связи с тем, что единичный акт испытания химического соединения на животных мало управляем во времени. Работая со сравнительно небольшими массивами чужеродных соединений и определяя сравнительно немного видов активности можно использовать животных как основной тест-объект. Однако индустриальные масштабы испытаний и их промышленная организация требуют увеличения на порядки производительности системы и обеспечения возможность работы с малым количеством испытуемого вещества. Поэтому возникла необходимость обратиться к исследованиям на тканевом, клеточном, молекулярном уровнях. Здесь вступает в право использование принципа качественного подобия – эпиморфизма тест-объекта и целевого объекта в отношении определенного биологического свойства ксенобиотика. Принцип эпиморфизма – это принцип конструктора: из небольшого числа деталей построить как можно больше фигур. Возможности принципа эпиморфизма велики, поскольку основные молекулярные структуры и субклеточные образования в большей степени единообразны у самых разнообразных живых объектов. Главные методологические трудности при использовании эпиморфных моделей связаны с определением оптимального уровня детализации модели по отношению к целостному организму. Этого можно достичь исходя из того, что в системе тест-объектов на клеточном уровне организации представляются все царства живого и основные типы тканей организма человека, а также из того, что у тест-объектов в совокупности определяются все основные реакции (гибель, повреждение, адаптация, проницаемость, метаболизм ксенобиотиков, синтез белка и ДНК, возбудимость и т. д.). Когда говорят о биологической активности ксенобиотиков, то для ее определения необходимы тест-объекты, у которых регистрируются определенные виды биологических реакций (гибель, изменение роста, изменение различных метаболических реакций и т. д.) при их действии, называемые тест-реакциями. В этой связи разработаны принципы отбора и стандартизации тест-объектов при классификации ксенобиотиков по видам биологической активности. Совокупность набора тест-объектов клеточно-тканевого уровня должна удовлетворять главному принципу системы – представительности выбранных биологических тест-объектов (БТО) по отношению к моделям биосферы и организму человека с соответствующим набором характеристик (тест-реакций). Предлагается подбирать тест-объекты по следующим критериям: сходство молекулярных рецепторов, являющихся мишенями для веществ с данными видами активности; принцип надмолекулярной организации и молекулярный состав (близость по структуре); функциональное сходство; органное или тканевое происхождение; идентичность патологического состояния тест-объекта таковому реального объекта. Первый критерий является самым надежным. Например, на этом критерии основан выбор ганглиев прудовика как модели нейронов головного мозга в отношении медиаторных и антимедиаторных видов биологической активности. Высокая гомология или даже тождество рецепторов для медиаторов у моллюсков и позвоночных служит основанием для надежности прогноза этих активностей на целевой тест-объект. Второй (близость по структуре) и третий (близость по функции) критерии используются при выборе моделей для оценки влияния на подвижность (сперматозоиды, тетрахимена), на дыхание и гликолиз (печень, эритроциты, клетки опухолей), на фотосинтез (водоросль Nitella), на химический гомеостаз (печень — монооксигеназная система). При использовании всех трех критериев остается неопределенность прогноза, обусловленная необходимостью переносить результаты ответов in vitro на систему in vivo, а именно тем, что in vitro не учитывается доступность объекта-мишени, метаболизма ксенобиотика и строения реального объекта. Гибель клетки не означает гибели организма. Большая степень неопределенности существует в отношении тех видов активности, которым присущи системные эффекты на уровне ткани, органа или организма. В этом случае подбор биологических тест-объектов по критерию органного происхождения дает значительную гарантию прогноза. Классификация ксенобиотиков по видам биологической активности по-новому ставит вопрос о подборе и стандартизации тест-объектов. Степень воспроизводимости, стандартность набора тест-объектов непосредственно определяют надежность принимаемых решений и степень автоматизации системы. С молекулярными тест-объектами это сделать проще. Каждый тест-объект индивидуален, что приводит к целому ряду затруднений при регистрации его характеристик, интерпретации данных, выявлении их соответствия поставленным целям и т. д. Существует ряд методических подходов для стандартизации, подбора, приготовления тест-объектов, например: – стандартизация условий содержания животных; – использование контрольных карт (отбраковка животных, для которых отклонения, согласно карте, превышают определенную величину); – выбор наиболее щадящих условий выделения и инкубации; – использование дополнительных воздействий, переводящих тест-объект в заданное состояние; – нормирование регистрируемых параметров (приведение к норме); – выбор тест-реакций, минимально зависящих от индивидуальности тест-объектов и т. д. Лекарственный мониторинг. Основные методы. Лекарственный мониторинг - способ контроля и наблюдения за распределением вводимых в организм лекарственных препаратов путем определения их концентрации в крови. Лекарственный мониторинг важен для пациентов с эпилепсией, сердечной недостаточностью, больных после трансплантации и в других ситуациях [12]. Оптимальной индивидуализации лечения помогает измерение концентрации определенных лекарственных препаратов в сыворотке (плазме) крови. Сочетание особенностей выведения, взаимодействия лекарственных препаратов друг с другом, нарушения процессов выведения и распределения обусловливает наличие широкого диапазона уровня содержания лекарственного средства в плазме крови у разных больных при введении им одной и той же его дозы[8]. В данном материале этот вопрос рассматривается в аспекте противосудорожных препаратов в лечении эпилепсии. Фармакокинетика противосудорожных препаратов (обзор данных литературы): При приеме лекарства в организме запускаются последовательно следующие фазы его преобразования: абсорбция, распределение, метаболизм, экскреция [8]. По особенностям распределения и метаболизма все лекарственные средства можно разделить на 3 группы- 1. с линейной кинетикой (дозонезависимые) 2. с нелинейной кинетикой (дозозависимые) 3. с времязависимой кинетикой [9] Линейная кинетика - в этом случае между уровнем содержания лекарства в плазме крови и величиной поддерживающей дозы существует прямая зависимость [5]: удвоение вводимой дозы ведет к удвоению уровня его содержания в плазме крови и предсказуемую концентрацию лекарства в необходимом органе. Поэтому нетрудно рассчитать скорость введения, необходимую для достижения необходимого уровня содержания в крови данного лекарственного средства. К противоэпилептическим препаратам с линейным характером фармакокинетики относятся топиромат [17], ламотриджин [17] . Нелинейная кинетика - введение новой дозы или снижение уровня препарата в крови изменяют скорость его выведения [5] . Сывороточная концентрация нарастает быстрее, чем увеличиваемая доза, и уменьшается быстрее, чем снижаемая доза. Клиренс лекарственного средства изменяется обратно пропорционально его сывороточной концентрации, а период полужизни лекарственного средства изменяется соответственно изменяемой сывороточной концентрациии[9]. Увеличение вводимой дозы может сопровождаться непропорционально высоким возрастанием уровня содержания препарата в плазме крови[8]. Так, при увеличении суточной дозы фенитоина с 300 до 400 мг уровень его содержания в плазме возрастает более чем на 33%[8] . Степень этого увеличения непредсказуема [8] По такому механизму работает вальпроевая кислота. Времязависимая кинетика - через несколько недель от начала лечения без изменения дозы активируются собственные ферменты антиконвульсанта, которые увеличивают скорость его выведения. Следовательно, его концентрация в крови уменьшается, что снижает его содержание в органе- мишени. Это может повлечь за собой падение концентрации ниже значимой и уменьшение эффекта от лечения,вплоть до отсутствия эффекта вообще. Это ситуация типична для карбамазепина[9]. Использовалась методика флуоресцентного поляризационного иммуноанализа (ФПИА), основанная на возрастании поляризации флуоресценции небольших меченых молекул антигена при их взаимодействии со специфическими антителами. Забор крови проводился непосредственно перед приемом лекарства пациентом (остаточная концентрация после последнего приема) и через 2-3 часа после приема (достижение максимальной концентрации в крови). Мониторинг проводился • при первичном назначении препарата противосудорожного ряда после достижения устойчивой концентрации (минимально равняется пяти периодам полувыведения), • у АЭП (антиэпилептических препаратов) с аутоиндукцией (карбамазепин, фенобарбитал) дополнительно через 1 месяц после выхода на терапевтический диапазон, • при каждом ЭЭГ обследовании, • у детей до года - каждые 1-3 месяца в связи с быстроменяющейся массой тела [11] • при достижении контроля над приступами и положительной динамике заболевания в целом 1-2 раза в год • у беременных в момент подтверждения беременности, на 8-10 неделе беременности, далее 1 раз в 2 месяца [4] , на 34-36 неделе беременности, после родов в течение 8 недель - двукратно, и при наблюдающихся припадках - при каждом обращении к неврологу (эпилептологу) [3], • после назначения или отмены других препаратов при комбинированной терапии [12] для определения стационарной концентрации, • при любом ухудшении состояния пациента, принимающего антиконвульсант, • при сомнении в корректности и правильности приема препарата пациентом. |
