Документ36. Металлолигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (жмко). Термодинамические принципы хелатотерапии. Механизм цито
 Скачать 128.51 Kb. Скачать 128.51 Kb.
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации Кафедра медицинской химии Реферат На тему: «Металло-лигандный гомеостаз и причины его нарушения. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО). Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины» Выполнил: студент 1 курса ИС группы №165 Зиновьев А.Д. Проверила: Доцент, Катунина Е.Е. Содержание Введение 3 Цель и задачи работы 6 Основные понятия и терминология комплексных соединений 7 Химические свойства. Диссоциация в растворах 11 Понятие о металло-лигандном гомеостазе 13 Теория ЖМКО 15 Принцип токсического действия мышьяка, патогенез 17 Принципы хелатотерапии 20 Механизм цитотоксического действия соединений платины 22 Заключение 25 Список используемой литературы 27 Введение Значимость комплексных соединений в жизнедеятельности организмов велика. Живой организм представляет собой систему, которая состоит из множества комплексообразователей и лигандов, с точным соотношением между ними. Так, например, в живых организмах присутствуют комплексные соединения металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ. Нарушение баланса компонентов (или же металло-лигандного гомеостаза организма) приводит к развитию патологических состояний. Поэтому изучение процессов взаимодействия «металл–лиганд» является ключом к поиску новых лекарственных средств. На протяжении жизни в организме человека непрерывно происходит образование и разрушение биокомплексов из катионов биометаллов и биолигандов, таких как: аминокислоты, полипептиды и так далее. Обмен веществ с окружающей средой поддерживает концентрации веществ, участвующих в этом равновесии, на определенном уровне, обеспечивая состояние металло-лигандного гомеостаза. Поэтому знание биологической роли химических биокомплексов необходимо будущему врачу при изучении: – биохимических процессов, протекающих в организме человека; – действия фармакологических препаратов; – применения в медицине различных соединений химических элементов; – случаев отравления химическими веществами. Также будущий специалист в области медицины на основе знания бионеорганической химии должен научиться оценивать результаты биохимических анализов, состояние окружающей среды и ее влияние на организм человека. Будущий медицинский работник должен ориентироваться в этой теме, так как она актуальна в наше время и патологическое действие, в следствии нарушения металло-лигандного баланса, имеет крайнюю вариативность. Причинами могут являться следующие факторы: - долговременное непоступление в организм катионов биометаллов или же поступление их в недостаточном количестве, значительно меньших, чем необходимо для нормальной жизнедеятельности - поступление катионов биометаллов в количествах, наоборот, заметно больших, чем нужно для нормального функционирования организма Это может быть вызвано несбалансированным питанием, либо биогеохимическими особенностями местности, где человек проживает на постоянной основе. Так, например в Тюменской области наблюдается недостаток меди, в Самарской области обнаружен дефицит йода, а в Узбекистане и Дагестане отмечают избыток молибдена. Но больше всего, к сожалению, ситуацию усугубляет и деятельность современного человека. Антропогенный фактор оказывает большое влияние на окружающую среду обитания, загрязняя ее соединениями, чуждыми в природе. В связи с этим, в развитых городах остро стоит вопрос экологии. За прошедшие полвека количество автотранспорта резко увеличилось. Выхлопные газы навсегда заполнили города и стали основным источником химического загрязнения воздуха. Они наносят непоправимый вред здоровью человека. По статистике, в среднем один легковой автомобиль выбрасывает в атмосферу за день около одного килограмма разных токсичных и канцерогенных веществ. Причем подобные вещества способны аккумулироваться и находиться в окружающей среде до 5 лет. В состав таких выхлопных газов входят свинец и его соединения. Эти компоненты появляются в отработавших газах при использовании этилированного бензина. Соединения свинца поражают органы и ткани организма, нервную систему, желудочно – кишечный тракт, нарушают обменные процессы, приводят к росту онкологических заболеваний. Опасность отравления соединениями свинца осложняется тем, что они, как канцерогенные вещества не удаляются из организма, а накапливаются в нем, также как в почве и растениях. В организме человека свинец удерживается белками эритроцитов, затем поступает в плазму крови и достигает почек, печени и др. органов. В костях свинец накапливается постепенно и надолго остается в них. Такие элементы являются для человека крайне токсичными, отсюда и появляется термин «металлы токсиканты» и «лиганды токсиканты». Их поступление вызывает более серьезные нарушения в метаболизме организма. Также существенную роль в загрязнении окружающей среды металлами – токсикантами играют электрохимические производства, поставляющие практически любые металлы токсиканты, в особенности ртуть кадмий, хром, отходы металлургической и атомной промышленности. Цель работы: подробное изучение выбранной темы со стороны физико-химических основ вопроса, ее медико-биологическое применение и значение для будущих медицинских работников. Задачи: Иметь представление о следующих понятиях и величинах: комплексообразователь, лиганд, координационное число, дентатность лиганда, внутренняя и внешняя сферы комплексного соединения, хелатные и полиядерные комплексные соединения; Знать особенности химической связи во внутренней сфере комплексных соединений; Ознакомиться с понятием металло-лигандного гомеостаза и с причинами его нарушения; Условия образования, разрушения и трансформации комплексных соединений; Особенности строения и функции в организме миоглобина, гемоглобина, метгемоглобина, цитохромов, ионофоров; Изучить механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО); Узнать о термодинамических принципах хелатотерапии и механизм цитотоксического действия соединений платины; Метод комплексонометрии и ее применения в санитарно-клиническом анализе; Основные понятия и терминология комплексных соединений. Классическая теория валентности была предложена немецким ученым Кекуле. Одно из главных положений которой – постоянство валентности элементов и насыщаемость химической связи. На этой основе в середине 19 века был разработан наглядный метод записи строения молекул с помощью черточек – связями между латинскими символами элементов. Например, кислород О=О, вода Н-О-Н. Этот метод широко используется до настоящего времени. Камнем преткновения для теории валентностей явилась группа веществ, в которой элементы проявляют переменную валентность – комплексные соединения. Одними из первых были открыты разноцветные комплексные соли железа и кобальта. Исходя из представленной классической теории двухвалентная медь Cu (II) должна давать соли типа CuSO4, CuCl2, Cu(NO3)2 и так далее. Оказалось, что помимо средней соли CuSO4 (бледно-голубые кристаллы) существует комплексная соль состава CuSO4 ∙ 4NH3 (ярко-синие кристаллы). Строение комплексных соединений, или просто комплексов, раскрыл швейцарский ученый А. Вернер в 1893 году. Многие положения его теории легли в основу современных представлений о структуре комплексов. Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму. Комплексные соединения состоят из комплексообразователя и лигандов, которые образуют внутреннюю сферу, и внешней сферы – которая состоит из ионов, компенсирующий заряд внутренней сферы. Комплексообразователъ (центральный атом) - атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении. Роль комплексообразователя в основном выполняют атомы или ионы d- и f-металлов, так как они имеют много свободных атомных орбиталей на валентном уровне и достаточно большой положительный заряд ядра, за счет которого способны притягивать электронные пары доноров. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя. Наиболее характерными координационными числами являются 2, 4 и 6. В комплексных соединениях комплексообразователь связан с лигандами. Лиганды - молекулы или ионы, которые являются до норами электронных пар и непосредственно связаны с комплексообразователем. Обычно лигандами являются ионы или молекулы, содержащие неподеленные (свободные) электронные пары или достаточно подвижные π-электронные пары. 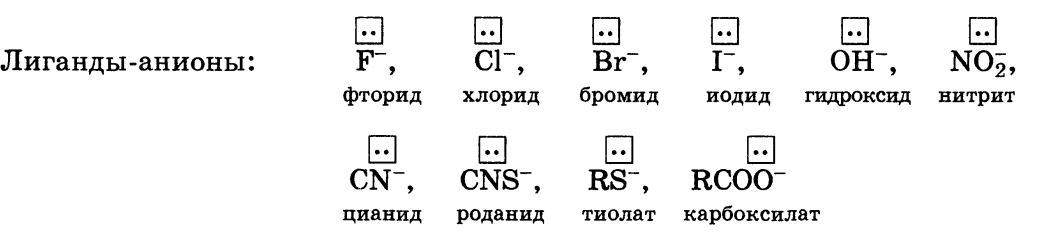 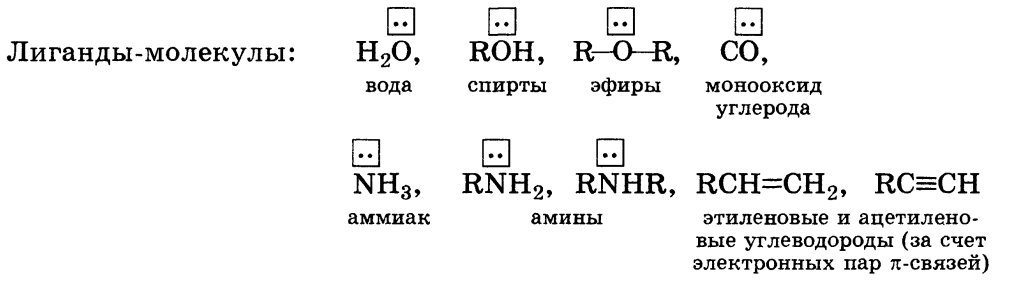 По числу электронных пар, которые идут на образование связей с комплексообразователем различают лиганды: 1) монодентатные – одна электронная пара 2) бидентатные – две электронных пары 3) полидентатные – несколько электронных пар, например этилендиаментетраацетат (ЭДТА) Внутренняя сфера комплексного соединения – совокупность центрального атома и лигандов. Внешняя сфера – ионы, не входящие во внутреннюю сферу и связанные с комплексным ионом ионной связью. Молекула комплексного соединения всегда электронейтральна, поэтому суммарный заряд ионов внешней сферы равен по значению и противоположен по знаку заряду внутренней сферы. Соединения, имеющие внутреннюю и внешнюю сферы, относят к электролитам. Соединения, не имеющие внешней сферы, – к неэлектролитам. Например, К3[Fe(CN)6] – электролит, [Pt(NH3)2Cl2] – неэлектролит. Химические свойства. Диссоциация в растворах. В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации. Первичная диссоциация – это распад комплексного соединения в растворе на комплексный ион внутренней сферы и ионы внешней сферы. В водных растворах первичная диссоциация комплексных со единений связана с разрывом в них ионной связи, и поэтому она практически необратима и ее уравнение следует записывать так: Возникающий в результате первичной диссоциации подвижный комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. Так, в водных растворах [Ag(NH3)2]Cl не удается обнаружить присутствие катионов Ag+ и молекул NH3, в растворах K4[Fe(CN)6] - катионов Fe2+ и анионов CN- . Вторичная диссоциация – это распад внутренней сферы комплекса на составляющие ее компоненты. Вторичная диссоциация связана с разрывом ковалентной связи, поэтому она сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов. Отрыв лигандов из внутренней сферы комплексного иона про исходит ступенчато: Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия, причем каждая стадия имеет свою константу. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса Кнест. Для комплексного иона [Ag(NH3)2]+ выражение константы нестойкости имеет вид: Чем меньше Kнест тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе. Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать не сколько связей с ионами металлов, формируя устойчивую циклическую структуру. Образно говоря, ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака. В связи с этим такие комплексные соединения получили названия хелатов. Хелаты - устойчивые комплексы металлов с полидентатными лигандами, в которых центральный атом является компонентом циклической структуры. Одними из наиболее эффективных хелатообразующих лигандов являются этилендиаминтетрауксусная кислота (ЭДТА) или ее динатриевая соль, называемая трилон Б. ЭДТА образует устойчивые комплексы практически с катионами всех металлов, за исключением щелочных, поэтому она широко используется в аналитической практике для определения содержания ионов различных металлов, а в медицине - в качестве детоксиканта для выведения из организма ионов тяжелых металлов в виде растворимых комплексов. Понятие о металло-лигандном гомеостазе. Для организма характерно поддержание на постоянном уровне не только концентрации ионов Н+ (рН), других ионов, но и концентрации веществ, участвующих в лигандообменных равновесиях. В организме постоянно происходит образование и разрушение жизненно необходимых биокомплексов [МбLб], которые состоят из «металлов жизни» (биометаллов Мб) и биолигандов (Lб). Как мы уже говорили, нарушение металло-лигандного баланса возможно в ряде случаев: а) в организм поступают ионы-токсиканты из окружающей среды; наиболее опасны – ионы ртути, кадмия, таллия. Все они способны образовывать прочные комплексные соединения с биолигандами, серьезно нарушая параметры стационарного состояния; б) Недостаток или избыток в организме микроэлементов, необходимых для жизни. Это может быть обусловлено биогеохимической особенностью территории проживания. в) нарушение концентраций ионов металлов возникает в результате связывания их в комплексы с попадающими извне токсичными лигандами. Например, многие средства химической защиты растений содержат в составе молекул донорные атомы (азот, сера, кислород, фосфор), которые способны координироваться ионами биометаллов; д) в ряде случаев в организме образуются лиганды, не свойственные ему в норме, так называемые «фальшивые» лиганды. Такое явление часто называют лигандной патологией. Например, при красной волчанке происходит «незапланированный» гидролиз пептидов, в результате которых образуются соединения, успешно конкурирующие с другими лигандами, в основном ферментами, за ионы меди. Связанные «фальшивыми» лигандами ионы меди не могут образовывать жизненно необходимые биокомплексы (конкуренция между «фальшивым» и настоящим биолигандом за ион). Теория жестких и мягких кислот и оснований. Химизм токсического действия ионов тяжелых металлов можно объяснить с точки зрения теории ЖМКО. Кислотами по Льюису являются частицы, содержащие атомы-акцепторы электронов, основаниями – атомы-доноры. В соответствии с этим ионы металлов (Al3+ , Fe3+ , Pb2+ и др.) являются кислотами. Оксид О2- и сульфид S2- рассматриваются как основания. Разберем некоторые положения теории «жестких» и «мягких» кислот и оснований (ЖМКО). Для «мягких» частиц характерно наличие достаточно большого радиуса и низкого заряда. Сочетание этих факторов обусловливает большую поляризуемость частицы. Для «жестких» частиц, наоборот, характерно наличие достаточно высокого заряда при небольшом размере. «Жесткие» частицы трудно поляризуются. Таким образом, по мере продвижения вниз по группе периодической системы для ионов одинаковых зарядов будет наблюдаться переход от «жестких» частиц к «мягким» (оксид-ион будет «жестким» основанием, а сульфид-ион – «мягким»; ион цинка – «жесткой» кислотой, ион ртути – «мягкой» кислотой и т.д.). «Мягкие» кислоты предпочтительней координируют «мягкие» основания, а «жесткие» кислоты – «жесткие» основания. В состав активных центров ферментов наряду с донорными атомами азота и кислорода («жесткие» основания) входят атомы серы («мягкое» основание). При попадании в организм ионов тяжелых металлов возникают совмещенные равновесия и, как следствие, конкуренция процессов. Ионы ртути, свинца, таллия являются «мягкими» кислотами, они образуют с атомами серы более прочные соединения, чем ионы биометаллов, представляющие собой более «жесткие» кислоты. Таким образом, возникает конкуренция за лиганд (-SH) между ионами микроэлементов и ионами металлов-токсикантов. Последние, выигрывая конкуренцию, блокируют активные центры ферментов и выключают их из управления метаболизмом. Тяжелые металлы часто называют тиоловыми ядами. Принцип токсического действия мышьяка, патогенез. Мышьяк - химический элемент V группы периодической таблицы, относится к семейству азота. Относительная атомная масса 74,9216. В природе мышьяк представлен только одним стабильным нуклидом 75As. Искусственно получены также более десяти его радиоактивных изотопов с периодом полураспада от нескольких минут до нескольких месяцев. Типичные степени окисления в соединениях - 3, +3, +5. Название мышьяка в русском языке связывают с употреблением его соединений для истребления мышей и крыс; латинское название Arsenicum происходит от греческого "арсен" - сильный, мощный. Неорганические соединения мышьяка - мышьяковистый ангидрид, мышьяковый ангидрид, арсенит натрия и калия - входят в состав инцектицидов, ядов против грызунов, фунгицидов, средств для предохранения деревянных изделий от гнили, гербицидов и растворов, используемых при производстве стекла. Органические соединения мышьяка присутствуют в окружающей среде. Отравления мышьяковистым водородом происходят в промышленности при плавке и рафинировании металлов, при гальванизации и травлении, при расковывании свинца в листы и при производстве силиконовых микрочипсов. В прошлом органические соединения мышьяка использовали для лечения больных сифилисом, эпилепсией, псориазом и амебиазом. В настоящее время острое отравление мышьяком происходит в результате случайного проглатывания, несчастного случая на производстве, попытки самоубийства или убийства. Хроническое отравление мышьяком чаще всего происходит при профессиональном воздействии малыми дозами в промышленности или при хроническом употреблении загрязненной пищи, воды или медицинских средств. Мышьяк абсорбируется через кожу, легкие и желудочно-кишечный тракт. Неорганические соединения абсорбируются легче, чем органические. Мышьяковистый водород эффективно абсорбируется через легкие. Мышьяк распределяется из крови в печень, почки, легкие и селезенку в течение 24 ч после проглатывания, а через 2 недели - в кожу, волосы и кости. Высокое содержание неорганических соединений мышьяка определяют в лейкоцитах. Неорганические соединения не проходят через гематоэнцефалический барьер, но проникают через плаценту. От 5 до 10 % мышьяка экскретируется с калом, а 90 -95 % - с мочой. В моче мышьяк обнаруживают в течение 7- 10 суток после употребления единичной дозы. Мышьяковистый водород соединяется с гемоглобином в эритроцитах, вызывая тяжелый гемолиз с анемией, гемоглобинурией и последующей макрогематурией, развивающейся через 3-4 часа после воздействия. Впоследствии может развиться тяжелая желтуха. Отравление мышьяком характеризуется тошнотой, рвотой и поносом, реактивным состоянием и недомоганием, тахикардией и одышкой. Часто развивается острая почечная недостаточность со смертельным исходом. Острое отравление мышьяком после приема внутрь со стороны желудочно-кишечного тракта характеризуется ожогом глотки, затрудненным глотанием, тошнотой, рвотой, поносом, болями в животе и запахом чеснока при дыхании; со стороны сердечно-сосудистой системы - цианозом, затрудненным дыханием, гипотонией; со стороны центральной нервной системы - делирием, комой, судорожными припадками; со стороны почек острым некрозом канальцев; со стороны системы кроветворения - гемолизом, эозинофилией и в редких случаях угнетением костного мозга. Хроническое отравление мышьяка, появляющееся через 2-8 недели после приема препарата внутрь, сопровождается со стороны кожи и ногтей - эритродермией, гиперкератозом, гиперпигментацией, шелушащимся дерматитом, появлением линии Aldrich - Mees на ногтях; со стороны слизистых оболочек - ларингитом, трахеитом, бронхитом; со стороны центральной нервной системы - полиневритом (чувствительных и двигательных нервов), развивающимся через 1 -3 недели после проглатывания мышьяка. Хроническое воздействие мышьяка вызывает развитие базально-клеточного рака кожи, плоскоклеточного рака и рака легкого. Токсическое действие мышьяка основано на связывании его с сульфгидрильными группами в тканях. Мышьяк способен вызывать повреждение капилляров и оказывать прямое токсическое действие на крупные органы. Меньшее значение имеет блокирование окислительного фосфорилирования. Патологические изменения при отравлении мышьяком характеризуются некрозом желудка и тонкой кишки, сосудистыми и дегенеративными изменениями в печени и почках. Принципы хелатотерапии. Выведение ионов тяжелых металлов из организма под действием хелатирующих реагентов называется хелатотерапией. Один из первых препаратов, который был применен для таких целей – БАЛ (британский антилюизит). В России используется унитол (2,3димеркаптопропансульфонат натрия). Этот препарат эффективно выводит из организма мышьяк, ртуть, хром, висмут; менее эффективен он при отравлениях свинцом. Для выведения свинца используются препараты на основе ЭДТА. Поскольку ЭДТА образует прочные комплексы почти со всеми ионами, введение его в организм в больших дозах опасно, т.к. он начнет связывать ионы кальция, что может привести к очень серьезным расстройствам многих функций. Для детоксикации организма при отравлении свинцом используют препарат тетацин-кальций (кальций динатриевая соль ЭДТА). Препарат применяют также для выведения кадмия, ртути, урана, иттрия, церия и других редкоземельных металлов, избыточного кобальта. Побочное действие при применении этого препарата может выражаться в снижении концентрации гемоглобина и витамина В12. При долгом приеме тетацина кальция рекомендуется принимать препараты железа и витамин В12. Наряду с тетацином кальция применяется близкий ему по структуре пентацин (кальций-тринатриевая соль диэтилентриаминопентауксусной кислоты). Его назначают при острых и хронических отравлениях плутонием, радиоактивными иттрием, церием, цинком, свинцом и для выявления носительства этих радионуклеидов. Основные термодинамические принципы хелатотерапии можно сформулировать в двух положениях. Вводимый детоксикант: а) должен эффективно связывать ионы-токсиканты; вновь образующиеся соединения должны быть прочнее, чем те, которые существовали в организме; б) не должен разрушать жизненно необходимые соединения; соединения, которые могут образовываться при взаимодействии детоксиканта и ионов биометаллов, должны быть менее прочными, чем существующие в организме. В последнее время разработаны эффективные хелатообразующие препараты, позволяющие избирательно выводить из организма те или иные ионы. Для выведения железа применяют дефероксамин (производное пропионгидроксамовой кислоты). Для эффективного выведения избыточного железа (гемохроматоз, гемосидероз, острые отравления) необходимо, чтобы препарат был избирателен не только по отношению к ионам железа, но и по отношению к отдельным классам железосодержащих биокомплексов. Существует препарат, эффективно связывающий почти все токсиканты (ртуть. свинец, мышьяк, кадмий), но не выводящий из организма ионы биометаллов (меди, марганца, железа, цинка, кобальта): сукцимер (димеркаптоянтарная кислота). Механизм цитотоксического действия соединений платины. Известно, что именно соединения платины являются одними из наиболее эффективных противоопухолевых препаратов. В настоящее время их11 широко применяют в клинической практике для лечения онкологических заболеваний головы и шеи, органов желудочно-кишечного тракта, яичек и яичников. Механизм противоопухолевого действия комплексов платины заключается во взаимодействии с ДНК, что приводит к остановке пролиферации и гибели опухолевых клеток. Несмотря на значительный терапевтический эффект, лекарственные препараты на основе платины обладают побочным действием (вызывают тошноту, рвоту, расстройство функций костного мозга, являются причиной различных нервных заболеваний). Токсическое действие комплексов платины в значительной степени связано с их накоплением в почках, где они могут взаимодействовать с белками. Кроме того, существенным недостатком таких препаратов является их низкая растворимость в воде. В настоящее время проводится огромная работа по поиску аналогов этих комплексов, обладающих меньшей токсичностью и более широким спектром противоопухолевой активности. Параллельно изучается биологическая активность соединений палладия с целью выявления цитотоксических и противоопухолевых свойств, которые позволят использовать соединения палладия для лечения онкологических заболеваний. Однако направленный поиск новых лекарственных препаратов, обладающих значительным терапевтическим эффектом и не оказывающих побочного действия, возможен лишь при детальном изучении влияния различных платиноидов и их комплексов на организм человека и выяснении механизма взаимодействия платиновых препаратов с ДНК и белками. Одним из путей установления такого механизма является изучение взаимодействия препаратов на основе металлов платиновой группы с нуклеиновыми кислотами, а также исследование влияния на каталитическую активность различных ферментов, отвечающих за протекание жизненно важных процессов в клетках. Взаимодействие соединений палладия с нуклеиновыми кислотами и их фрагментами заключается в координации соединений палладия по атому азота N7 пуриновых оснований и атому азота N3 пиримидиновых основании (в основном, цитозина). Необходимо отметить, что в последнее время для лечения ряда онкологических заболеваний применяются нитрофурановые препараты, действие которых сводится к разрушению интенсивно делящейся ДНК супероксидным радикалом, образующимся при окислении нитрильной группы нитрофуранов клеточными оксидазами. Методами кругового дихроизма и УФ-спектроскопии установлено, что нитрофураны не связываются с нуклеиновыми кислотами. В то же время комплексное соединение, содержащее нитрофуран и атом платины (или палладия), связывается с нуклеосомой и плазмидной ДНК бактериальных клеток, что установлено методом электрофореза в агарозном геле. В связи с этим палладийсодержащие комплексы нитрофуранов также могут использоваться для преодоления лекарственной устойчивости микроорганизмов. Цитотоксическое действие соединений платины открыто Б. Розенбергом в начале 1960-х годов при наблюдении влияния электрического тока на рост бактерий. В опытах Розенберга образующиеся при электрохимической коррозии платиновых электродов комплексные соединения платины вызывали нарушение деления и гибель клеток кишечной палочки. Было обнаружено, что наиболее выраженным биологическим действием обладает цис-дихлородиамминплатина. Последующие испытания на мышах выявили противоопухолевую активность этого соединения. С начала 1980-х годов цис-дихлородиамминплатина стала использоваться в клинической практике под названием цисплатин. Заключение Комплексообразование имеет большое значение для многих биологических процессов. В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12, участвующий в процессах кроветворения, является комплексом кобальта. Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода. Нарушение баланса компонентов приводит к развитию патологических состояний. Поэтому изучение процессов взаимодействия «металл–лиганд» является ключом к поиску новых лекарственных средств. Поэтому знание биологической роли химических биокомплексов необходимо будущему врачу при изучении: биохимических процессов, протекающих в организме человека; действия фармакологических препаратов; применения в медицине различных соединений химических элементов; случаев отравления химическими веществами. Также будущий специалист в области медицины на основе знания бионеорганической химии должен быть заинтересован в новых открытиях в сфере хелатотерапии. Ведь Поиск препаратов, в том числе и на основе платины, тормозящих или прекращающих рост клеток злокачественной опухоли, продолжается. Список используемой литературы 1. Литвинова Т.Н. и др. Биогенные элементы. Комплексные соединения: учебно-методическое пособие для студентов I курса медицинского вуза / Ростов-на-Дону: КГМУ, 2009. — 283 с. 2. Слесарев В.И. Химия: Основы химии живого: учебник для вузов / СПб: Химиздат, 2007. – 784 с. 3. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: учеб. для вузов. / Высш. шк., 2003. — 560с.
|
