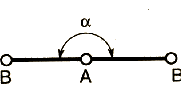Метод Гиллеспи (раздаточный материал). Метод (теория) отталкивания валентных электронных пар (овэп) СиджвикаПауэлла. Правила Гиллеспи
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
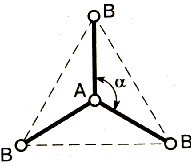
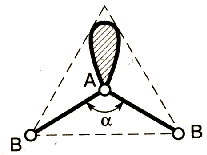
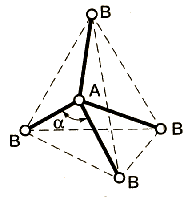
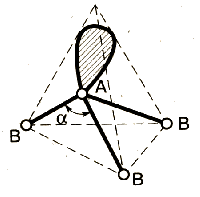
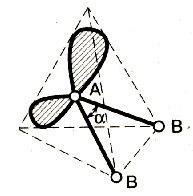
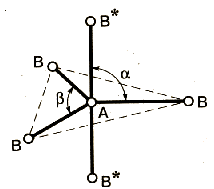
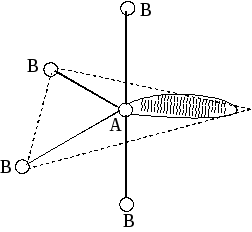
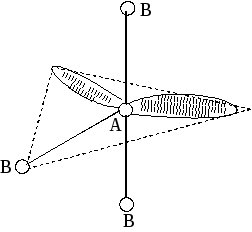
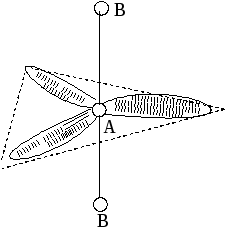
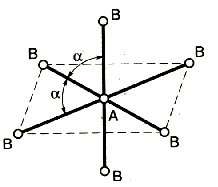
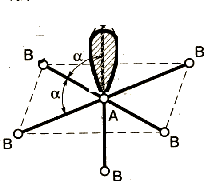
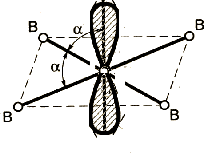
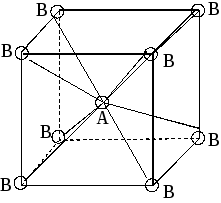
Метод (теория) отталкивания валентных электронных пар (ОВЭП) Сиджвика-Пауэлла. Правила Гиллеспи. Этот метод позволяет предсказать структуру (геометрию молекул). В 1940 г его предложили Сиджвик и Пауэлл, а в 1957 г он был усовершенствован Гиллеспи и Найхамом. 1. Расположение электронных пар вокруг центрального атома в молекуле зависит от числа таких пар: они принимают пространственное положение, сводящее к минимуму их взаимное отталкивание. 2. По степени взаимного отталкивания электронные пары располагаются в ряд: НП−НП > НП−СП > СП−СП (отталкивание убывает). НП − несвязывающая (неподеленная) электронная пара ближе расположена к ядру и облако неподеленной пары электронов занимает большее пространство, чем связывающей электронной пары (СП). 3. Электронные пары занимают такие позиции, чтобы углы между ними были максимальны, а отталкивание минимально. Поэтому из нескольких возможных структур, включающих взаимодействие под углом 90°, наиболее благоприятна структура, обладающая наименьшим числом взаимодействий под углом 90° с неподеленной парой. 4. Электронное облако двойной связи занимает большее пространство, чем облако одинарной связи. 5. Чем более электроотрицателен атом − партнер центрального атома, тем меньше пространства вблизи центрального атома требуется для электронной пары. Так как она оттянута к атому-сосоду. Подсчитывают стерическое число (СЧ) для центрального атома в молекуле, и в зависимости от его значения − такова и геометрия. СЧ есть сумма связывающих электронных пар (т.е. число связей) и неподеленных электронных пар: СЧ = СП + НП. Если у центрального атома нет неподеленных пар, то СЧ = СП. Кратность связи не влияет на предсказанные структуры: СЧ(ВН2) = СЧ(СО2) = 2. Если один из присоединенных атомов заменен неподеленной парой, то геометрия молекулы меняется:
или
  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||