Строение атома. Методические указания к практическим занятиям и для самостоятельной подготовки студентов всех специальностей дневной и заочной форм обучения
 Скачать 440.75 Kb. Скачать 440.75 Kb.
|
|
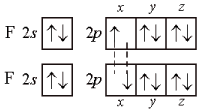
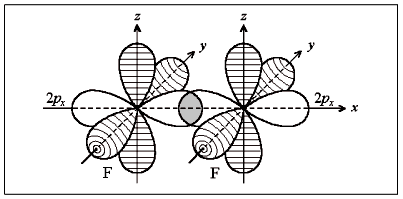
Порядок связи (кратность связи) – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь. Например, порядок связи в молекулах H2, O2 и N2 равен 1, 2 и 3 соответственно, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков. В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии. При перекрывании АО вдоль линии соединения атомов образуется -связь. Схема образования -связи приведена на рисунке 4.  s– s s–p p–p d–d s– s s–p p–p d–dРисунок 4 – схема образования -связи При перекрывании АО по обе стороны от линии соединения атомов образуется -связь. Схема образования –связи приведена на рисунке 5.  p-p p-d d-d рисунок 5 – схема образования –связи –связи 3.1.2 Донорно-акцепторная связь Донорно-акцепторная связь, а точнее, донорно-акцепторный механизм образования ковалентной связи, реализуется за счет обобществления пары электронов, принадлежащих одному атому (донору) и вакантной орбитали другого атома (акцептору). Например, у атома азота имеется три неспаренных электрона, которые образуют три ковалентные связи с тремя атомами водорода, по обменному механизму; но он может образовать еще одну связь за счет неподеленной пары электронов по донорно-акцепторному механизму с образованием иона аммония: 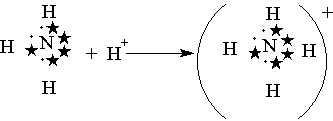 3.1.3 Ионная связь Ионная связь – крайний случай ковалентной связи. Такая связь возникает между атомами, ΔЭО которых больше 2, например, между s – элементами I группы и р –элементами VI и VII групп (LiF, К2О, СsС1). Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов. Так как электрическое поле иона имеет сферический характер, то для ионной связи не характерны направленность и насыщаемость. Ионная химическая связь проявляется в твердых веществах с ионной кристаллической решеткой. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой ΔЭО. Поэтому и чисто ионные связи не существуют. Можно лишь говорить о той или иной доли ионности связи. Таким образом, при образовании полярных ковалентных и ионных связей на атомах возникают электрические заряды. Величины зарядов не имеют целочисленных значений. В практических целях их удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т.е. если бы связи были полностью ионными. Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0. В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы. Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н3РО4. Поскольку у кислорода СО – -2 , а у водорода - +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5: [3(+1)+1(+5)+4(-2)=0]. 3.1.4 Металлическая связь Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространств 3.1.5 Метод валентных связей (ВС) Структура и свойства молекул с ковалентной связью могут быть объяснены с позиций метода валентных связей (ВС) Основные положения метода ВС: По методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар; образованная электронная пара локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной; химическая связь образуется только при взаимодействии электронов с антипараллельными спинами; характеристики химической связи (энергия, длина, полярность, валентные углы) определяется типом перекрывания АО; ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. На рисунке 7 приведена схема образования связи в молекуле фтора F2 по методу ВС
Рисунок 6 – схема образования связи в молекуле фтора 3.1.6 Межмолекулярные связи К основным видам межмолекулярного взаимодействия относят вандерваальсовы силы, водородные связи и донорно-акцепторные взаимодействия. Вандерваальсовы силы обуславливают притяжение межу молекулами и включают в себя три составлющие: диполь- дипольное взаимодействия, индукционное и дисперсионное взаимодействия. Диполь - дипольное взаимодействие происходит за счет ориентации диполей: Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи: Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования: 3.1.7 Водородная связь Водородная связь – это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К). Энергия и длина водородной связи. Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи. В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты. 4 Комплексные соединения 4.1 Состав комплексных соединений. Комплексными называются соединения, образованные сочетаниями отдельных компонентов – электронейтральных молекул простых и сложных веществ Теория, объясняющая строение таких соединений, была предложена А. Вернером. Она получила название координационной теории. Её основные положения сводятся к следующему: Один из основных компонентов комплексного соединения – центральный атом или центральный ион, иначе – комплексообразователь. Чаще всего комплексообразователем является ион d- элемента, но известны комплексы с ионами s- или р-элементов в роли центральных ионов. Комплексообразователем может быть и нейтральный атом, например Fe . Комплексообразователь координирует (удерживает вокруг себя) неко- торое число одинаковых или разных лигандов. В качестве лигандов могут выступать как анионы, так и нейтральные молекулы, атомы в которых имеют неподеленные электронные пары, или молеулы, атомы в которых связаны π-связями, например: F-, Cl- , Br- , I- , OH- , CN- , SCN- , NO2- , SO42- , S2O32-, H2O, NH3. Общее число лигандов при данном центральном ионе – координацион- ное число – зависит от его природы, заряда и от природы лигандов. Комплексообразователь с координированными лигандами образует внутреннюю координационную сферу. При записи химической формулы внутренняя координационная сфера заключается в квадратные скобки. В зави- симости от зарядов комплексообразователя и лигандов комплекс представляет собой анион, катион или нейтральную молекулу. Например: [Cu(NH3)4]2+, [Ag(CN)2]-, [Pt(NH3)2Cl2]0 . Заряд комплекса подсчитывают как алгебраическую сумму зарядов всех составляющих его частиц (считая все заряды целочисленными). Незаряженным центральным атомам и лигандам – нейтральным молекулам приписывается ну- левой заряд. Заряд комплексного иона уравновешивается зарядами соответст- вующих противоионов, образующих внешнюю координационную сфе- ру (записываются за квадратными скобками), например: [Cu(NH3)4](OH)2, [Ag(CN)2]Cl На рисунке 7представлена структура комплексного соединения. 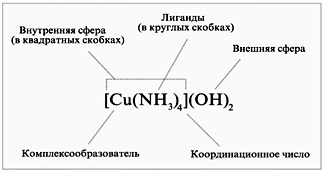 Рисунок 7 – структура комплексного соединения Чаще всего роль комплексообразователей выполняют катионы переходных металлов ( d-элементы, f-элементы, реже s и p). Число лигандов, располагающихся вокруг комплексообразователя, называется координационным числом. Чаще встречаются координационные числа 2, 4 и 6, что соответствует наиболее симметричной геометрической конфигурации комплекса – линейной (2), тетраэдрической (4), октаэдрической (6). Способность к комплексообразованию уменьшается в следующем порядке: f > d >p >>s. Заряд комплексного иона численно равен суммарному заряду внешней сферы, но противоположен ему по знаку, и определяется как алгебраическая сумма зарядов комплексообразователя и лигандов. 4.2 Классификация комплексных соединений По принадлежности к определенному классу соединений комплексные соединения подразделяются на: комплексные кислоты (Н[AuCl4] –хлористозолотая кислота); комплексные основания ([Ag (NH3)2]OH –гидроксид диамминосеребра); комплексные соли (K4[Fe(CN)6] – гексацианоферрат (II) калия, ферроцианид калия) По природе лигандов: аквокомплексы -лигандами являются молекулы воды ([Cu(H2O)4](NO3)2); аммиакаты -лигандами являются молекулы аммиака ([Ag(NH3)2]Cl);гидроксокомплексы- соединения с ОН --группами в виде лигандов (Nа 2[Zn(OH)4]);ацидокомплексы- содержат в качестве лигандов анионы различных кислот. По знаку заряда комплекса:комплексные катионы ([Zn(NH3)4]2+Cl2);комплексные анионы( K3Fe[CN)6]3- ): нейтральные комплексы - не имеют внешней сферы ([Co(NH3)3Cl3]). 4.3 Тип связи в комплексных соединениях Современная теория строения комплексных соединений использует положения квантовой химии. Согласно методу (ВС) связь в комплексных соединениях осуществляется за счет свободных орбиталей комплексообразователя и неподеленных пар лигандов, т.е. реализуется по донорно-акцепторному механизму. Рассмотрим строение комплекса [Ag(NH3)2]+. Электронная конфигурация иона серебра : 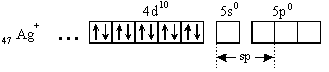 Свободные орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака: 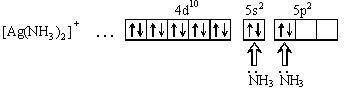 4.4 Диссоциация комплексных соединений. Для комплексных соединений характерна первичная и вторичная диссоциация. Первичная диссоциация комплексных соединений на комплексный ион и противоположно заряженные ионы внешней сферы протекает полностью, как у сильных электролитов: K2[Zn(CN)4] = 2K+ +[Zn(CN)4]2- [Co(NH3)6](NO3)2 = [Co(NH3)6]2+ +2NO3- Поэтому, соединения, содержащие комплексные ионы, могут вступать в реакции обмена с электролитами с образованием малорастворимых веществ: 2  CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4; CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2K2SO4;2  Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]Однако, в отличие от “простых” ионов, комплексные ионы сами способны к диссоциации, которая называется вторичной диссоциацией. Она характеризует диссоциацию самого комплексного иона и протекает ступенчато, как у слабых электролитов, подчиняясь закону действия масс. Количественно каждая ступень характеризуется константой диссоциации. I ступень: [Ag(NH3)2]+ = [AgNH3]+ +NH3 [AgNH3]+ [NH3] Кд (I) = [Ag(NH3)2]+ II ступень: [AgNH3]+ = Ag+ + NH3 [Ag+] [NH3] Кд (II)= [AgNH3]+ В целом устойчивость комплексного иона в растворе характеризуется величиной константы нестойкости Кн , которая равна произведению констант диссоциации отдельных ступеней. Кн = Кд(I) Кд(II) Общая константа нестойкости Кн является константой равновесия полной диссоциации комплекса: [Ag(NH3)2]+ = Ag+ + 2NH3 [Ag+ ] [NH3]2 К [Ag(NH3)2]+ н = Чем меньше константа нестойкости, тем прочнее комплексный ион. 5 Вопросы и задания Каковы современные представления о строении атома? Какие элементарные частицы входят в состав ядра? Каков физический смысл порядкового номера элемента? Как определить число протонов, нейтронов и электронов в атоме? Как влияет изменение количества этих структурных единиц на строение атома? Что такое изотопы, изобары, изотоны? Охарактеризуйте квантовые числа n, l, ml, ms. Какие значения они могут принимать? Что называют энергетическим уровнем (слоем), подуровнем, атомной орбиталью? Каким квантовым числом они характеризуется? Сформулируйте основные принципы заполнения электронной оболочки атома (принцип минимальной энергии, принцип Паули, принцип Гунда). Какие семейства элементов вам известны? Что называют атомной валентной зоной (АВЗ) элемента? Как определяется АВЗ для элементов различных семейств? Напишите электронные формулы атомов элементов с порядковым номером 9, 28, 31, 35, 80, и 84. К какому семейству относится каждый из этих элементов? Покажите распределение электронов АВЗ этих элементов по квантовым ячейкам. Определите их возможные валентные состояния? Чему равен суммарный спин р- электронов у первого элемента и сколько свободных d- орбиталей у последнего элемента? Дайте современную формулировку периодического закона Д.И. Менделеева. Укажите связь периодической системы со строением атома (порядковый номер, номер периода, номер группы). В чём причина периодичности свойств? Что называют радиусом атома? Как он изменяется по периоду? В главных подгруппах? По периодической системе? Почему? Что понимают под энергией ионизации? Энергией сродства к электрону? Электроотрицательностью? Как они изменяется по периоду? В главных подгруппах? По периодической системе? Почему? Как изменяются окислительно-восстановительные свойства элементов по периоду? В главных подгруппах? По периодической системе? Почему? Как изменяются кислотно-основные свойства оксидов и гидроксидов (оксидгидроксидо) по периоду? В главных подгруппах? По периодической системе? Почему? Пользуясь периодической системой элементов, напишите формулы: а) высших оксидов хрома, марганца, олова; б) кислот, соответствующих этим оксидам; в) оксида, гидроксида и нитрата стронция. Напишите электронно-графические формулы данных элементов, укажите соответствующие степени окисления. Приведите графические формулы ионов. Определите, у какого элемента сильнее выражены металлические свойства: а) Na или Cs; б) K или Cr; в) Rb или Ag. Напишите электронно-графи-ческие формулы ионов: Na+, Cs+, K+, Cr2+, Rb+, Ag+. Какая связь между химической активностью щелочных металлов и строением их атомов? Как изменяются значения первых потенциалов ионизации в ряду Li-Fr? Ответ мотивируйте. Какие типы химической связи вы знаете? Охарактеризуйте их.. Охарактеризуете силы межмолекулярного взаимодействия. Составьте формулы комплексных ионов для Ag+, Cu2+,Au3+, в которых их координационные числа равны четырем, а лигандами являются следующие нейтральные молекулы и ионы: NH3, Cl–, S2O32– Составьте формулы всех возможных комплексных соединений, используя в качестве комплексообразователя Co3+ (координационное число его равно шести), в качестве лигандов – NH3, NO2–, внешней сферы– K+, NO2–. Определите степень окисления и координационное число комплексообразователя в следующих комплексных соединениях: K[AuBr4], [Cd(NH3)4](OH)2, Na3[Ag(S2O3)2], H[Co (H2O)2(CN)4], Cu2[Fe(CN)6]. Распишите, как диссоциируют в растворе следующие комплексные соединения, напишите выражения для констант нестойкости их комплексных ионов: K2[PtCl6]; [Co(NH3)3(H2O)3]Cl3; [Cr(H2O)3Cl3]. Список литературы 1 Хомченко, И. Г. Общая химия : учебник / И. Г. Хомченко. – М.: Новая Волна, 2002. – 464 с. 2 Гольбрайх, З. Е. Сборник задач и упражнений по химии : учеб. пособие / З. Е. Гольбрайх, Е. И. Маслов. – 6-е изд. – М.: АСТ, Астрель, 2004. – 383 с. 3 Коровин, Н. В. Общая химия / Н.В. Коровин – М.: Высшая школа, 2010. – 559с. 4 Глинка, Н. Л. Задачи и упражнения по общей химии/ Н. Л. Глинка – Л.: Химия, 2004. – 274 с. 5 Глинка, Н. Л. Общая химия/ Н. Л. Глинка – Л.: Химия, 2002. – 653 с. 6 Курс химии/ Под ред. Г. П. Лучинского, В. И. Семишина – М.: Выс. шк., 1972,Ч.2– 372 с. 7 Курс общей химии / Под ред. Н. В. Коровина – М: Выс. шк., 1981. – 431с. |