Методические указания к выполнению комплекса виртуальны. Методические указания к выполнению комплекса виртуальных лабораторных работ СанктПетербург 2015
 Скачать 6.79 Mb. Скачать 6.79 Mb.
|
Лабораторная работа № 8«Изучение приборов для измерения концентрации водородных ионов»Цель лабораторной работы Изучение принципа действия и устройства лабораторного многопредельного рН-метра рН-673М. Изучение конструкции стеклянного, каломельного и хлорсеребряного электродов. Измерение концентрации водородных ионов Кислотность и щелочность любых водородных растворов кислот и щелочей можно выразить в функции концентрации водородных ионов, которая может быть определена по величине потенциала, возникающего на границе различных электродов, опущенных в раствор. Скорость диссоциации V1 пропорциональна действующей массе недиссоциированных молекул воды, т.е. V1 = k1*[H2O] (24) Скорость маляризации V2 пропорциональна произведению концентрации ионов Н и ОН, т.е. V2 = k2*[H+]*[OH-], (25) При равновесии V1= V2, тогда k1/k2 = k = [H+]*[OH-] / [H2O], (26) где k - константа диссоциации. Опытами установлено, что для нейтральных растворов [H+]=[OH-]=10-7 г-моль/л. При растворении в воде кислоты концентрация ионов водорода [H+] увеличивается, а при растворении щелочи - уменьшается. Поэтому у кислых растворов [H+] > 10, а у щелочи [H+] < 10. На практике концентрацию водородных ионов численно характеризуют отрицательным логарифмом концентрации ионов водорода, так называемым водородным показателем pH: pH = -lg ([H+]). (27) При этом нейтральная реакция раствора соответствует pH=7, кислая pH<7, щелочная pH>7. Измерение активности водородных ионов производится с помощью электродов. При внесении электрода в водный раствор возникает пограничный (электродный) потенциал, величина которого определяется активной концентрацией ионов в растворе. Измерить абсолютно значение указанных потенциалов трудно. Поэтому в систему вводится дополнительный, сравнительный, электрод, обладающий определенными, постоянным по величине потенциалом. В качестве измерителей применяются водородные и стеклянные электроды, в качестве сравнительных - каломельные и хлорсеребрянные. Градуировка и проверка pH-метров производится по образцовым (буферным) растворам, значение pH которых устойчиво и не изменяется при небольшом разбавлении. Измерение разности потенциалов преобразователя со стеклянным электродом должно осуществляться вторичным прибором с большим входным сопротивлением, т.к. величина сопротивления больше 10 МОм. Оборудование для измерения концентрации водородных ионов Лабораторный рН-метр-милливольтметр рН-673М представляет собой настольный прибор, состоящий из преобразователя и штатива. Конструктивно преобразователь выполнен в виде отдельного блока, в котором размещены элементы электрической семы. Электрическая схема, монтаж которой выполнен на печатных платах, разбита на блоки: блок усилителя, блок измерения, блок преобразователя, блок генератора управляющих импульсов и блок стабилизации. Измерительная часть схемы выполнена в виде отдельного блока, который крепится ко дну корпуса преобразователя. Связь между блоком измерения и остальной частью электрической схемы осуществляется внутри прибора с помощью разъема. На лицевую панель (рис.28) вынесены следующие элементы: Микроамперметр 6, ручка потенциометра температурной компенсации 4, ручка переключателя диапазонов измерения 5, ручка переключателя рода работ 3, кнопка включения прибора 2 и индикатор напряжения питания 1. Лицевая панель прикрывает доступ к потенциометрам заводской настройки. 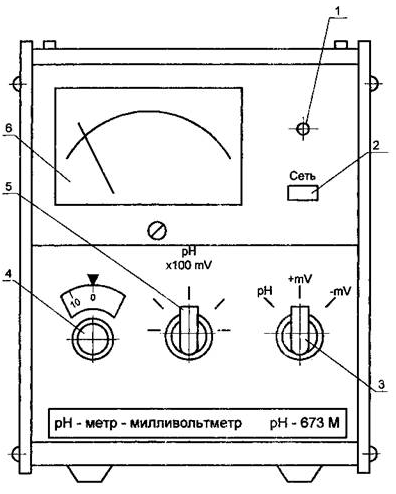 Рис. 28 - Лицевая панель рН-метра. 1 - индикатор; 2 - кнопка; 3 - ручка переключателя рода работ; 4 - ручка потенциометра температурной компенсации; 5 - ручка переключателя диапазонов измерения; 6 - микроамперметр. Штатив предназначен для крепления электродов и установки сосуда с контролируемым раствором при измерении. На штативе закрепляются два кронштейна, высота которых может регулироваться в зависимости от вида измерений (измерение в станке, измерение в термостатированной ячейке, измерение в ячейке для микроизмерений). Для измерения величины рН используется электродная система со стеклянным электродом, электродвижущая сила которого зависит от активности ионов водорода в растворе. Схема такой электродной системы приведена на рисунке 29. Стеклянный электрод 2 представляет собой трубку с напаянным на конус полым шариком 1 из литиевого стекла. 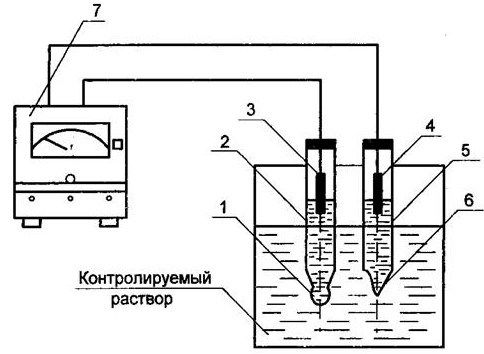 Рис. 29 - Схема измерения рН-раствора. 1 - полый шарик из электродного стекла; 2 - стеклянный электрод; 3 - внутренний контактный электрод; 4 - вспомогательный электрод; 5 - электролитический ключ; 6 - пористая перегородка; 7 - рН-метр. При погружении электрода в раствор между поверхностью шарика-электрода и раствором происходит обмен ионами, в результате которого ионы лития в поверхностных слоях стекла заменяются ионами водорода, и стеклянный электрод приобретает свойства водородного электрода. Между поверхностью стекла и контролируемым раствором возникает разность потенциалов Ех, величина которой определяется активностью водорода в растворе. Ех = R*T / F - ln dH = -2.3 - R*T / F – pH, (28) где R - универсальная газовая постоянная, равная 8,315x10-7; Т - температура раствора, К; F - 96500 кулон (г-эков) число Фарадея; dH - активность ионов водорода в растворе; рН - величина рН раствора. Для создания электрической цепи при измерении применяются контактные электроды: внутренний хлорсеребряный электрод 3, осуществляющий электрический контакт с раствором, заполняющим внутреннюю часть стеклянного электрода и каломельный электрод (так называемый вспомогательный электрод) 4, осуществляющий электрический контакт с контролируемым раствором. Для защиты от воздействия высоких температур (при измерении рН горячих растворов) вспомогательный электрод помещают вне контролируемого раствора и соединяют с ним при помощи электрического ключа 5 - трубки, заполненной насыщенным раствором хлористого калия и заканчивающейся пористой перегородкой 6. Раствор хлористого калия непрерывно просачивается через пористую перегородку, предотвращающую проникновение из контролируемого раствора в систему электрода 4 постоянных ионов, которые могли бы изменить величину ЭДС электрода. ЭДС электродной системы равна алгебраической сумме ЭДС контактных электродов Ек и Евсп, ЭДС, возникающей на внутренней поверхности стеклянного электрода Евн определяемой величиной рН внутреннего раствора, и ЭДС, возникающей на наружной поверхности стеклянного электрода Ex. Величины Ек, Евсп, и Евн не зависят от состава контролируемого раствора и меняются только при изменении температуры. Ε = Ек + Евсп + Евн + Ех Суммарная ЭДС электродной системы линейно зависит от величины рН раствора. Изменяя ЭДС электродной системы с помощью рН-метра 7, шкала которого градуирована в единицах рН, определяют величину рН контролируемого раствора. Элементарная схема, поясняющая принцип действия преобразователя приведена на рисунке 30. Электродвижущая сила Ех электродной системы сравнивается с падением напряжения на сопротивлении R, через которое протекает ток Iвых оконечного каскада усилителя. Падение напряжения U на сопротивлении R противоположно по знаку ЭДС Ех, и на вход усилителя подается напряжение: Uвх = Eх- Uвых =Еx - Iвых · R Напряжение Uвх преобразуется в переменное напряжение, которое затем многократно усиливается и при помощи демодулятора вновь преобразуется в постоянное напряжение. Это напряжение управляет током Iвых оконечного каскада усилителя. Принцип действия рН-метра Стеклянный электрод 2 (рис.19) заполнен децинормальным раствором соляной кислоты, в которую погружен вспомогательный хлорсеребряный контактный электрод 3. Последний служит для снятия потенциала с внутренней поверхности шарика и представляет собой посеребренную платиновую проволоку диаметром 0,3 мм покрытую хлористым серебром. Потенциал в таких электродах возникает на границе серебро - хлористое серебро. В качестве вспомогательного электрода в датчике применяется проточный каломельный электрод. Насыщенный раствор хлористого калия медленно (около 20 мл в сутки) вытекает в контролируемый раствор из полиэтиленового сосуда по резиновой трубке и наконечнику, имеющему прокладку из микропористого материала. Вытекание раствора хлористого калия через пористую перегородку регулируется винтом. Непрерывный поток раствора хлористого калия через пористую перегородку создает четкую границу между раствором хлористого калия и контролируемым раствором. В этом случае диффузионный потенциал на границе между растворами имеет стабильную весьма малую величину, что позволяет производить измерения с высокой точностью. 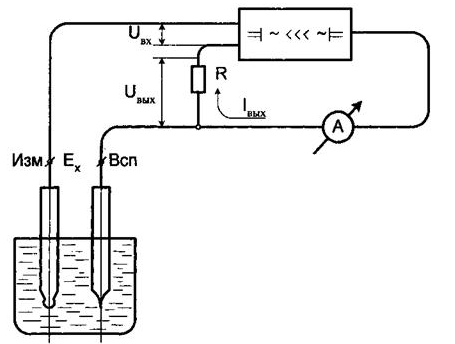 Рис.30 - Схема элементарная прибора. Стартовое положение Стартовое положение прибора в данной лабораторной работе представлено на рисунке 31.  Рис. 31 - Внешний вид рН-метра в лаборатории. Порядок действий 1. Включите блок питания прибора в розетку. 2. Налейте раствор в мерный стакан, а из него в рабочий. 3. Опустите электроды в стакан. 4. Включите прибор. Прибор покажет уровень pH раствора, также данные занесутся в табель. 5. Выключите прибор. 6. Выньте электроды из стакана. 7. Промойте электроды. 8. Повторите еще 9 испытаний для данного раствора с п.3. 9. Повторите весь эксперимент для всех растворов. Результаты измерений занесите в отчет. Отчет по лабораторной работе должен содержать следующее: Краткое описание и принцип действия лабораторного рН-метра рН-673М. Таблица с записью 10 - кратного измерения рН неизвестного раствора. Расчеты доверительного интервала для каждого раствора. Таблица 10 – Протокол поверки уровнемера
Контрольные вопросы 1. Электрическая схема датчика. 2. Измерительный электрод. 3. Сравнительный электрод. 4. Что такое рН, рН кислотной, щелочной, нейтральной среды. |
