курсовая дистиллсят. Методические указания к КР(расчеты) (1). Методические указания по выполнению расчетной части
 Скачать 1.26 Mb. Скачать 1.26 Mb.
|
|
4.6. Физическое тепло продуктов 1) теплоемкости продуктов при 20000С СС = 8,531 Дж/моль*град ССО = 33,800 кДж/кмоль*град 2) физическое тепло продуктов QФ = n*c*t QФС = 11,57*8,531*2000 = 197407,34 кДж Q  ФСО = 13,82*33,800*2000 = 934232,00 кДж ФСО = 13,82*33,800*2000 = 934232,00 кДжИТОГО = 3199989,70 кДж 4.7. Тепловой баланс процесса Полученные расчетные данные представляются в таблице
4.8. Расход электроэнергии 1) недостающее количество энергии 9583447,7– 30411,01 = 9553036,7 кДж 2) расход электроэнергии (без учета потерь) 3,6*103 кДж – 1 кВт*ч 9553036,7 кДж – х х = 2653,6 кВт*ч 4.9. Изменение свободной энергии системы G = H – T*S 1) значение энтропии реагентов и продуктов SCaO = 39,7 Дж/моль*град SC = 5,74 Дж/моль*град SCO = 197,4 Дж/моль*град 2) изменение энтропии реакции S = 70,3 + 197,4 – 39,7 – 3*5,74 = 210,78 Дж/моль*град 3) изменение энергии Гиббса системы G = 92380,0 – (2273*210,78) = - 386722,94 кДж/кмоль При 20000С реакция не вызывает затруднений При стандартных условиях (20 - 250С) G = 461900 – (298*210,78) = 399087,56 кДж/кмоль значение энергии Гиббса положительно. Без дополнительной затраты энергии прямая энергия не может быть проведена. 5. Выполнение расчетов по заданию четвертого варианта Задание: Дать обзор по свойствам реагентов и продуктов, по кинетике и механизму реакции. Определить количественный состав продуктов, тепловой эффект реакции, температуру в зоне реакции, изменение энергии Гиббса системы. Представить материальный и тепловой балансы системы. Обосновать выбор технологической схемы процесса. Дать экологический анализ.   С3Н8 + 3Н2О(Г) 3СО + 7Н2 +Н С3Н8 + 3Н2О(Г) 3СО + 7Н2 +НКонверсии подвергается 100 нм3 С3Н8. Соотношение реагентов эквивалентное. Конверсия полная. Примеси отсутствуют. Температура реагентов 3500С. Необходимая температура в зоне реакции (6500С) создается сжиганием дополнительно подаваемого пропана. 5.1. Схема материальных потоков  С3Н8 СО, Н2 С3Н8 СО, Н2 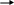 Н2О(Г) Н2О(Г) С3Н8 CO2, H2O, N2   О2 О2N2  C3Н8 + 3Н2О 3СО + 7Н2 +Н C3Н8 + 3Н2О 3СО + 7Н2 +Н (С3Н8 + 5О2 3СО2 + 4Н2О - Н) (С3Н8 + 5О2 3СО2 + 4Н2О - Н) 5.2. Материальный баланс основной реакции Таблица материального баланса по основной реакции
5.3. Тепловой эффект реакции 1) теплоты образования веществ НобрС3Н8 = -103,9 кДж/моль НобрН2О(Г) = -241,84 кДж/моль НобрСО = -110,5 кДж/моль 2) тепловой эффект реакции при стандартных условиях Н293 = 3*(-110,5) – (-103,9 – 3*241,84) = 497,920 кДж/моль Н293 = 497920 кДж/кмоль Реакция эндотермична 3) тепловой эффект реакции, приходящийся на 4,46 кмоль С3Н8 Н293 = 497920*4,46 = 2220723,2 кДж 5.4. Физическое тепло реагентов 1) теплоемкости реагентов при 3500С 2) физическое тепло пропана и водяного пара на входе в аппарат QФ = n*c*t QФ = 67903,5 + 163090,2 = 230993,7 кДж 5.5. Физическое тепло продуктов 1) теплоемкости продуктов при 6500С ССО = 30,6 кДж/кмоль*град 2) физическое тепло оксида углерода и водорода на выходе из аппарата QФСО = 13,39*30,6*650 = 266327,1 кДж QФ = 266327,1 + 597187,5 = 863514,6 кДж 5.6. Тепловой баланс основной реакции
Дополнительно в зону необходимо подать: 3084237,8– 230993,7 = 2853244,1 кДж По условию задания это тепло должно быть получено сжиганием в зоне реакции пропана. 5.7. Требуемое количество пропана на сжигание Горение пропана протекает по реакции  С3Н8 + 5О2 3СО2 + 4Н2О(Г) - Н С3Н8 + 5О2 3СО2 + 4Н2О(Г) - НПредположим, что для достижения температуры в зоне реакции 6500С необходимо сжечь х кмоль пропана. 1) теплоемкости продуктов горения пропана при 6500С 2) физическое тепло продуктов Q = n*c*t  QФ = 554306*х (По соотношению О2 и N2 в воздухе на 1 кмоль О2 приходится 3,76 кмоль N2) По справочным данным горение 1 кмоль С3Н8 сопровождается выделением 2223000 кДж тепла. На основании этих данных определяется, какое количество пропана необходимо сжечь, для того, чтобы в зону реакции дополнительно подать 2853244,1 кДж (см. табл. теплового баланса основной реакции) х*2223000 = 2853244,1 + 554306*х х = 1,7 5.8. Состав продуктов
Состав продуктов СО – 10,6%об Н2 – 24,8%об СО2 – 18,0%об Н2О(Г) - 24,0%об N2 – 22.6%об 5.9. Изменение энергии Гиббса системы G = H - T*S Значение энтропии веществ SCO = 151,2 Дж/моль*град Изменение энтропии реакции S = 3*151,2 + 7*130,6 – 269,6 – 3*188,74 = 531,98 Дж/моль*град Изменение энергии Гиббса системы при 650°С (923 К) G = 497920 – (923*531,98) = -6902,46 кДж/кмоль При 6500С протекание реакции на вызывает затруднений. Некоторые константы наиболее употребляемых газов [1]
*   Для равновесного состояния 2NO2 N2O4 Для равновесного состояния 2NO2 N2O4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
