Лабораторная работа Классы неорганических соединений. Методическое пособие по дисциплине Химия (комплект лабораторных работ) 1 курс Разработала преподаватель гбпоу
 Скачать 177.34 Kb. Скачать 177.34 Kb.
|
|
Министерство образования и молодежной политики Ставропольского края Государственное бюджетное профессиональное образовательное учреждение «Георгиевский региональный колледж «Интеграл» УТВЕРЖДАЮ: СОГЛАСОВАНО Председатель ПЦК ЕНД Зав. отделением П.П., Н.А. Серкова О.В. Бойко ________________ ________________ Методическое пособие по дисциплине «Химия» (комплект лабораторных работ) 1 курс Разработала: преподаватель ГБПОУ ГРК «Интеграл» Савченко О.П. Рассмотрено на заседании предметно-цикловой комиссии «_____» _____________ протокол № _____ г. Георгиевск 2015 Министерство образования и молодежной политики Ставропольского края Государственное бюджетное профессиональное образовательное учреждение «Георгиевский региональный колледж «Интеграл» УТВЕРЖДАЮ: СОГЛАСОВАНО Председатель ПЦК ЕНД Зав. отделением П.П., Н.А. Серкова О.В. Бойко ________________ ________________ Методическое пособие по дисциплине «Химия» (комплект лабораторных работ) 1 курс Разработала: преподаватель ГБПОУ ГРК «Интеграл» Савченко О.П. Рассмотрено на заседании предметно-цикловой комиссии «_____» _____________ протокол № _____ г. Георгиевск 2017 Министерство образования и молодежной политики Ставропольского края Государственное бюджетное профессиональное образовательное учреждение «Георгиевский региональный колледж «Интеграл» УТВЕРЖДАЮ: СОГЛАСОВАНО Председатель ПЦК ЕНД Зав. отделением П.П., Н.А. Серкова О.В. Бойко ________________ ________________ Методическое пособие по дисциплине «Химия» (комплект лабораторных работ) 1 курс Разработала: преподаватель ГБПОУ ГРК «Интеграл» Савченко О.П. Рассмотрено на заседании предметно-цикловой комиссии «_____» _____________ протокол № _____ г. Георгиевск 2014 Предлагаемая методическая разработка является руководством при выполнении лабораторных работ. Разработка содержит теоретическое введение и экспериментальную часть. Цель разработки: привить студентам навыки химического мышления и теоретического толкования наблюдений и выводов, вытекающих из эксперимента. Предусматривается индивидуальное выполнение работ каждым студентом. Данное методическое пособие предназначается для студентов первого курса специальностей дневного обучения: 19.02.06 «Технология консервов и пищеконцентратов» и 19.02.10 «Технология продукции общественного питания» Правила выполнения лабораторных работ Студент должен придти на лабораторное занятие подготовленным по данной теме. Каждый студент должен знать правила по технике безопасности при работе в химической лаборатории (и при работе с реактивами в данной работе). После проведения работы студент представляет письменный отчет. До выполнения лабораторной работы у студента проверяют знания по выявлению уровня его теоретической подготовки по данной теме. Отчет о проделанной работе следует выполнять в тетради для лабораторных работ. Содержание отчета указано в описании лабораторной работы. Таблицы и рисунки следует выполнять карандашом, записи – синим или чёрным цветом пасты или чернил. Рисунки выполняются в левой половине листа, наблюдения и выводы в правой части листа. Уравнения реакций записываются во всю строку (после наблюдений и выводов). Зачет по данной лабораторной работе студент получает при положительных оценках за теоретические знания и отчет по лабораторной работе, общий зачет – при наличии зачетов по всем лабораторным работам. ЧТОБЫ ОПЫТ ПОЛУЧИЛСЯ… …ознакомьтесь с каждым пунктом правил и старайтесь точно их выполнять В химический кабинет заходите только после того, как разрешит преподаватель. Не трогайте и не переставляйте на столе приготовленные реактивы и оборудование – это может затруднить вашу дальнейшую работу. Прежде чем приступить к выполнению химических опытов, обязательно изучите описание лабораторной работы и внимательно выслушайте объяснения преподавателя. Проверьте, все ли необходимое для работы есть на вашем столе. В ходе выполнения работы координируйте свои действия с действиями группы. Разговаривайте шепотом, чтобы не мешать работать другим. Если возникнут какие-либо затруднения, которые вы не можете разрешить самостоятельно, обратитесь за помощью к преподавателю. Вещества берите только шпателем или ложечкой и в тех количествах, которые указаны в описании работы; если таких указаний нет, то объемы веществ не должны превышать 1 мл. (3-4 капли) Чтобы не перепутать пробки, не открывайте одновременно несколько склянок. Если вы случайно взяли вещества больше, чем нужно для данного опыта, лишнее вылейте в специальную склянку для слива веществ или, если вещество твердое, отсыпьте в коробку для мусора. В химической лаборатории (кабинете) очень важно быть предельно аккуратным во всем – тут нет мелочей. Прежде чем начать работать руками, продумайте, как разместить оборудование на столе, чтобы было удобно, и работать, и наблюдать за ходом эксперимента. Не забывайте, что за этим же столом с этими же реактивами и оборудованием будут работать студенты других групп, - не создавайте им дополнительных трудностей, оставив свое рабочее место в беспорядке. Правила по технике безопасности при проведении лабораторных и практических работ Работая в химической лаборатории, необходимо соблюдать большую осторожность. Приступать к выполнению задания после указания преподавателя. Химические реакции выполнять с такими количествами и концентрациями веществ, в таких приборах и посуде, как указано в описаниях работ. Производить опыты в чистой посуде. Внимательно прочесть надпись на этикетке, прежде чем взять вещество для опыта. Все опыты с выделением ядовитых, летучих и неприятно пахнущих веществ проводить с особой осторожностью. Выполнять опыты с взрывчатыми, легковоспламеняющимися веществами или кислотами и щелочами с соблюдением мер предосторожности, работая стоя. Поджигать газы и пары после проверки их на чистоту, смесь горючего газа с воздухом взрывается. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе. Реактивы не пробовать на вкус, так как большинство из них ядовиты. Держать дальше от огня легко воспламеняющиеся вещества: эфир, бензин, спирт, бензол и др., если эти вещества воспламеняются, накрыть пламя брезентом или засыпать песком. Не зажигать горючее зажигалкой. Гасить горючее, накрывая ее колпачком. В случае возникновения пожара в лаборатории вызвать пожарную охрану, а до прибытия гасить огонь песком, огнетушителем. В случае ожога лица, рук кислотой или щелочью необходимо оказать пострадавшему помощь. Правила выполнения лабораторной работы Лабораторная работа выполняется в три этапа:
Правила оформления отчёта по лабораторной работе Запишите название номер и тему лабораторной работы. Лабораторная работа №__. Тема:_______________________________________________________________. Цели работы: _______________________________________________________. Реактивы и оборудование: ___________________________________________. 2) Ознакомьтесь самостоятельно с целями работы и списком оборудования и реактивов. 3) Запишите номер и название опыта из методической рекомендации. Самостоятельно определите его цель и содержание эксперимента. Опыт № __. __________________________________________________________.
4) Проведите запланированный эксперимент, и кратко запишите всё, что вы делали и что при этом наблюдали, то есть опишите условия протекания и признаки химических реакций. 5) Напишите уравнение реакций, которые вы провели. Если в ходе опыта протекало несколько химических реакций, для каждой запишите уравнение. Не забудьте расставить коэффициенты. 6) Нарисуйте прибор, которым вы пользовались. Постарайтесь, чтобы рисунок получился четким. Обязательно сделайте на нем пояснительные надписи. Для изображения окрашенных веществ пользуйтесь цветными карандашами или фломастерами. 7) Сделайте вывод после каждого опыта (или работы). Напомним: повторное описание своих действий или наблюдений не может считаться выводом. 8) Ответьте на вопросы и выполните все задания. Полезные советы. Каждую лабораторную работу начинайте с нового листа. Лабораторная работа № 1 "Классы неорганических веществ" Цель: Познакомиться с понятиями кислота, основание, оксид, амфотерный гидроксид, соли, получить и исследовать наиболее распространенные простые вещества и соединения. Теоретический обзор
Практическая часть
Лабораторная работа № «Химические свойства спиртов, фенолов» Цель: Изучить свойства этанола, глицерина, фенола. Теоретический обзорЭтанол С2Н5ОН - растворы этанола практически нейтральны. 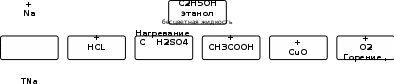 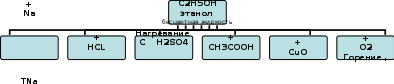 Запишем реакции …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… …………………………………………………………………………………………………… Глицерин СН2ОН-СНОН-СН2ОН - густая бесцветная сладковатая вязкая прозрачная жидкость, тяжелее воды, но хорошо смешивается с ней. Простейший представитель трёхатомных спиртов. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества. Химические свойства глицерина типичны для многоатомных спиртов. Эфиры глицерина и высших карбоновых кислот — жиры Фенол - С6Н5-ОН - (оксибензол, устар. карболовая кислота) — кристаллическое, бесцветное вещество с характерным запахом. На воздухе легко окисляется, приобретая вначале розовую, затем бурую окраску. Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. Фенол ядовит. Пыль и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Обладает слабокислотными свойствами, при действии щелочей образует соли — феноляты. При действии брома образуется трибромфенол, который используют для получения антисептика — ксероформа. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга.
Практическая часть
Лабораторная работа № 3 «Получение уксусной кислоты и изучение ее свойств» Цель: Получить СН3СООН лабораторным способом, изучить способность уксусной кислоты вступать в реакции с активными металлами, в реакции этерификации, доказать ее кислотные свойства. Теоретический обзорОбщие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот. Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором: Cl2 + CH3 COOH → ClCH2 COOH + HCl Карбоновые кислоты классифицируют: а) в зависимости от числа карбоксильных групп в молекуле на одноосновные, двухосновные и многоосновные; б) в зависимости от природы радикала на предельные, непредельные и ароматические. Нахождение в природе. Муравьиная кислота содержится в муравьях, в крапиве и хвое ели. Ожог крапивой – результат действия муравьиной кислоты. Масляная (бутановая) кислота входит прогорклого масла, а валериановая (пентановая) кислота содержится в корнях валерианы. Муравьиная кислота НСООН - бесцветная прозрачная жидкость, с резким, кислым вкусом и запахом, хорошо растворяющаяся в воде. Самая сильная из всех карбоновых кислот. Единственная из всех карбоновых кислот вступает в реакцию «серебряного зеркала». Уксусная кислота СН3СООН - бесцветная прозрачная жидкость, с резким, кислым вкусом и запахом, хорошо растворяющаяся в воде. Реагирует с металлами (находящимися в ряду напряжений до водорода) выделяя водород Уксусная кислота проявляет слабые кислотные свойства. Она применяется в синтезе красителей, медикаментов (н/р аспирин), ацетатного волокна, органического стекла и т.д. Сложные эфиры - это продукты взаимодействия карбоновых кислот со спиртами, в результате реакции этерификации. Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества. Благодаря ароматичности, эфиры применяются в кондитерской и парфюмерной промышленности. Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Характер многих фруктовых запахов, таких, как запахи малины, вишни, винограда и рома, отчасти обусловлены летучими эфирами, например этиловым и изоамиловым эфирами муравьиной, уксусной, масляной и валериановой кислот. Практическая часть
Лабораторная работа № 4 "Свойства белков. Цветные реакции на белок" Цель: Экспериментально изучить качественные реакции на белок и его денатурацию. Теоретический обзорБелки - высокомолекулярные органические вещества, играющие фундаментальную роль в структуре и жизнедеятельности живых организмов. Белки являются продуктами взаимодействия a-аминокислот. Белки могут быть простыми (протеины) и сложными (протеиды). Они играют важную биологическую роль для человека и животного, выполняя следующие функции: Ферментативные - выполняют роль катализаторов в организме; Транспортные - белковые молекулы переносят другие молекулы и ионы по тканям и органам. Структурные - фибриллярные белки - это строительный материал мышечных, опорных, опорных тканей. Защитные – белки-антитела, они распознают и уничтожают чужеродные вирусы, бактерии, клетки. Сигнальные - белки-рецепторы воспринимают и передают сигналы, поступившие от соседних клеток или окружающей среды. Белки – необходимые компоненты пищевых продуктов, они входят в состав лекарственных препаратов. Свойства: Денатурация – нарушение природной структуры белка под действием нагревания и химических реагентов. а.) действие спирта на белок; б) действие солей хлорида натрия (концентрированный раствор) и ацетата свинца на белок; в) действие HNO3 (конц.); г) свертывание белков при кипяченииө Денатурация бывает обратимой (при употреблении алкоголя, солёной пищи) и необратимой. Необратимая денатурация может быть вызвана высокими температурами, радиацией, при отравлении организма солями тяжелых металлов, спиртами, кислотами. - денатурация - свертывание и выпадение в осадок при е-t=60-65'С (варка мяса, яиц), - старение - при длительном хранении образуется жесткая консистенция (черствение хлеба, твердение сыра), - набухание - при взаимодействии с водой увеличивается в объемах (варка круп), - коагуляция - снижение водопоглатительной способности (образование творога, простокваши) Практическая часть
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



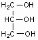




 Наблюдали:
Наблюдали: