Решение типовых задач - Химическая кинетика. Методика решения задач
 Скачать 179 Kb. Скачать 179 Kb.
|
Методика решения задачПри решении задач по химической кинетике необходимо различать следующие понятия: С0 – начальная концентрация реагирующего вещества – это количество вещества, содержащееся в 1 л раствора или газа в момент начала реакции, моль/л; С – текущая концентрация вещества – это количество вещества в 1 л реакционной системы в определенный момент времени; [С] – равновесная концентрация вещества – это количество вещества в 1 л реакционной системы в момент наступления равновесия. Для гомогенной реакции количество прореагировавших исходных веществ и количество образовавшихся продуктов реакции находится в пропорциональной зависимости друг от друга. Так для реакции: aА + вВ = сС + dD имеем При протекании реакций в прямом направлении происходит уменьшение концентрации реагентов и увеличение концентраций продуктов реакции. Пример №1. Реакция идет по уравнению 2H2 (г) + O2 (г) = 2H2O (г) Начальные концентрации реагирующих веществ: С0 (H2) = 4 моль/л; С0 (О2) = 2 моль/л. 1.1 Во сколько раз изменится скорость прямой реакции, когда прореагирует 50 % вещества H2? Во сколько раз изменится скорость прямой и обратной реакций, если увеличить давление в 2раза? Решение: 1. Количество водорода, вступившего в реакцию (∆Сн2), (в расчете на 1 л газовой системы): 4 моль Н2 составляет 100% ∆Сн2 составляет 50%; ∆Сн2 = Текущая концентрация водорода: Сн2 = С0н2 ─ ∆Сн2 = 4 – 2 = 2 моль/л. Количество кислорода, вступившего в реакцию согласно уравнению реакции: Текущая концентрация кислорода: Со2 = С0о2 ─ ∆Со2 = 2 – 1 = 1моль/л. Начальная скорость прямой реакции. Из закона действующих масс следует: VO= K(C Текущая скорость прямой реакции: V= K(С Найдем, во сколько раз уменьшится скорость прямой реакции: Ответ: скорость прямой реакции изменится в 8 раз, когда прореагирует 50% водорода. 1.2. Если обозначить концентрации водорода, кислорода и воды соответственно через а, b и с, то выражения для скоростей реакций примет вид: Увеличение давления в два раза увеличивает концентрацию каждого из газообразных реагирующих веществ в два раза, поэтому: С Найдем, во сколько раз изменится скорость прямой и обратной реакций: Ответ: при увеличении давления в 2 раза, скорость прямой реакции увеличится в 8 раз, а обратной реакции – в 4 раза. Пример № 2. При температуре 200С некоторое количество вещества вступает в реакцию за 10 минут. Рассчитать время, при котором это же количество вещества вступит в реакцию при температуре 700С, если температурный коэффициент равен 2. Во сколько раз при этом изменится скорость реакции. Решение: Между скоростью протекания химической реакции и её продолжительностью существует обратно пропорциональная зависимость: где Правило Вант-Гоффа в данном случае можно записать в виде: откуда При температуре 700С эта реакция заканчивается за 18,75 с. Подставим в уравнение Вант-Гоффа исходные данные: Следовательно, при повышении температуры с 200С до 700С скорость реакции возрастает в 32 раза. Пример № 3. Вычислите начальные концентрации исходных веществ и константу равновесия реакции 2SO2 + O2 ↔ 2SO3, если равновесные концентрации реагирующих веществ равны [SO2] =2 моль/л; [O2] = 3 моль/л и [SO3] = 4 моль/л. Решение: Определяем константу равновесия реакции: 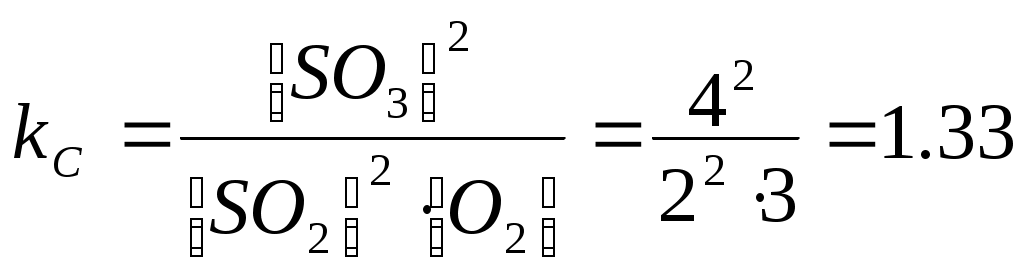 . .В соответствии со стехиометрией реакции имеем: Найдем количество оксида серы (IV), вступившего в реакцию (∆C Найдем исходную концентрацию оксида серы (IV): Найдем количество кислорода, вступившего в реакцию ( Найдем исходную концентрацию кислорода: Ответ: КС = 1,33; Пример № 4. Для реакционной системы начальные концентрации равны: С Решение: Предположим, что к моменту равновесия прореагировало Х моль (в расчете на 1 л газовой системы) водорода, т.е. Согласно со стехиометрией реакции имеем: Оформим решение в виде таблицы:
отсюда 43х2 – 168,5х + 140 = 0; Х1 = 1,2; Х2 = 2,7; Корень Х2 не имеет смысла, так как Х2>С0. Следовательно, равновесные концентрации веществ: [H2]=0,8моль/л; [I2]=0,3моль/л; [HI]=3,4моль/л. Пример № 5. Выразите через концентрации реагентов константу равновесия следующей реакции Указать направление смещения этой реакции: 1) при увеличении температуры, если давление постоянно; 2) при повышении давления, если температура постоянна. Решение: Выразим константу равновесия реакции через равновесные концентрации реагирующих веществ: 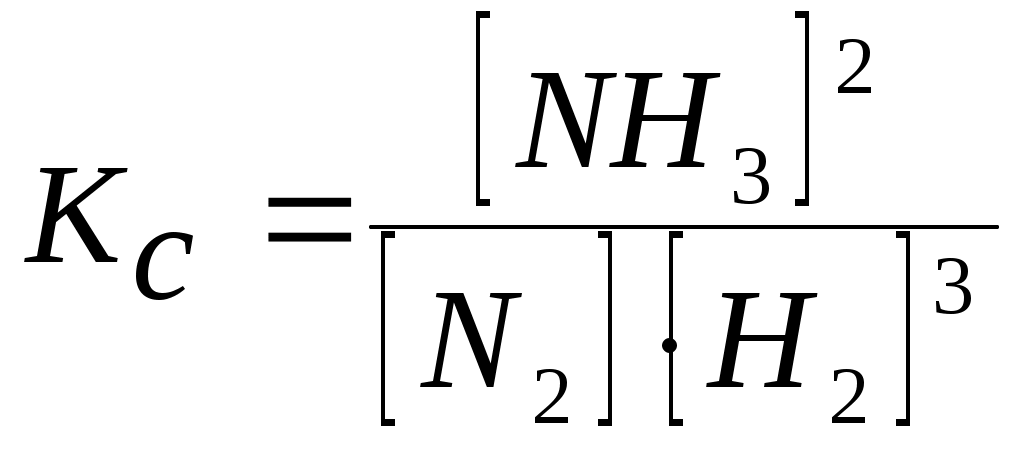 Реакция синтеза аммиака экзотермическая (∆H Повышение давления будет благоприятствовать реакции, ведущей к образованию меньшего числа молей газообразных веществ, т.е. в сторону образования аммиака (слева 4 моль газообразных веществ, справа – 2 моль). Это значит, что равновесие реакции сместится вправо. | ||||||||||||||||||||||||||||
