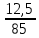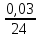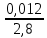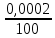Материальный баланс цианирования. Нагиев А.О.практическая. Рассчитать расход реагентов, состав продуктов и составить
 Скачать 29.57 Kb. Скачать 29.57 Kb.
|
|
Рассчитать расход реагентов, состав продуктов и составить материальный баланс цианирования 1 т золотосодержащей руды (или концентрата) при условиях, заданных в табл.2. Обратите внимание, в числителе показано содержание компонентов в руде, в знаменателе – степень перехода этих компонентов в раствор. Таблица 2 – Исходные данные для металлургического расчета выщелачивания золотосодержащей руды
Определим массу и состав растворов, выходящих из аппаратов цианирования. Масса растворов, поступивших на цианирование 1 т руды составит 1,5 т. (При соотношении Т:Ж = 1:1,5) Объем их при плотности равной 1,03 составит 1,5 м3. Состав раствора после цианирования характеризуется концентрациями NaCN, Аu, Ag, металлов-примесей и зависит от степени взаимодействия цианида с составляющими компонентами руды. Определим массу компонентов руды, переходящих в раствор при цианировании с учетом заданных степеней извлечения: Au – 1 ∙ 12,5 ∙ 0,85 = 10,625 г Feметал – 1 ∙ 0,000002∙ 106 = 2 г FeS2 – 1 ∙ 0,0003 ∙ 0,24 ∙ 106 = 72 г CuFeS2 – 1 ∙ 0,00012 ∙ 0,028 ∙ 106 = 3,36 г Определим расход NaCN на растворение этих компонентов и количество продуктов реакции по реакциям (1) – (4) используя стехиометрические коэффициенты: 2Au 4NaCN H2O 0,5O2 2NaAuCN2 2NaOH (1) На растворение Au по реакции (1) потребуется х1 г NaCN: 2·197,2 — 4·49 10,625 — х1 → х1 = 5,28г NaCN Fe 6NaCN 2H2O Na4[Fe(CN)]6 2NaOH H2 (2) На растворение Fe по реакции (2) потребуется х2 г NaCN: 55,8 — 6·49 2 — х2 → х2 = 10,53 г NaCN При этом в раствор перейдет (y2) [Fe(CN)6]4-: 55,8 — 211,9 2 — y2 → y2 = 7,59 г [Fe(CN)6]4-; FeS2 8NaCN H2O 0,5O2 Na4FeCN6 2NaCNS 2NaOH (3) На растворение FeS2 по реакции (3) потребуется х3 г NaCN: 119,8 — 8·49 72 — х3 → х3 = 235,59 г NaCN При этом в раствор перейдет (y3) [Fe(CN)6]4- и (Z3) CNS-: 119,8 — 211,9 72 — y3 → y3 = 127,35 г [Fe(CN)6]4-; 119,8 — 2·58 72 — z3 → Z3 = 69,71 г CNS- 2CuFeS2 + 22NaCN +1,5O2 + 3H2O = 2Na4[Fe(CN)6] + 2Na2[Cu(CN)3] + 4NaCNS + 6NaOH (4) На растворение CuFeS2 по реакции (4) потребуется х3 г NaCN: 2·183,5 — 22·49 3,36 — х4 → х4 = 9,87 г NaCN При этом в раствор перейдет (y4) [Fe(CN)6]4-, (b4) [Cu(CN)3]2- и (Z4) CNS-: 2·183,5 — 2·211,9 3,36 — y4 → y4 = 3,88 г [Fe(CN)6]4-; 2·183,5 — 2·141,6 3,36 — b4 → b4 = 2,59 г [Cu(CN)3]2- 2·183,5 — 4·58 3,36 — Z4 → Z4 = 2,12 г CNS- Общий расход NaCN на растворение золота и сопутствующих минералов составит: Σ𝑥 = 5,28+ 10,53 + 235,59 + 9,87 = 261,27 г. На цианирование поступают растворы с концентрацией 300 г/м3 NaCN. Концентрация NaСN в растворах, выходящих из аппаратов цианирования, понизится за счет протекания реакций 1-4 и составит: 300 – 261,27 = 38,73 г. Общее содержание [Fe(CN)6]4- в растворе по реакциям (2-4) составит Σу = 7,59 + 127,35 + 3,88 = 138,82 г. Учитывая, что соотношение Т:Ж = 1:1,5, определим содержание [Fe(CN)6]4- в растворе: 138,82 : 1,5 = 92,55 г/м3 Общее содержание [Cu(CN)3]2- в растворе по реакциям и (4) составит Σb = 2,59 г Соответственно, содержание – 1,72 г/м3 Общее содержание CNS в растворе по реакциям (3) и (4) составит: Σ𝑧 = 69,71 + 2,12 = 71,83 г Соответственно, содержание – 47,89 г/м3 Представим состав раствора после цианирования в виде таблицы 2. Таблица 2 – Состав раствора после цианирования
2. Определим остаточное содержание золота в руде после цианирования. Остаточное содержание золота находим либо по разности исходной и растворенной масс золота в расчете на 1 т руды: 12,5 – 10,625 = 1,875 г/т, либо по заданному коэффициенту извлечения золота:  100 − 85 100 − 8512,5 100 = 1,875 г/т Зная массу растворенных компонентов и объем раствора, определим их концентрации в нем. Концентрация Au составит: 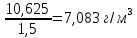 | |||||||||||||||||||||||||||||||||||||||||||||||||