Лр 3 ОИХ Волков вар. 8. Министерство науки
 Скачать 384.16 Kb. Скачать 384.16 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «ТЮМЕНСКИЙ ИНДУСТРИАЛЬНЫЙ УНИВЕРСИТЕТ» Институт дополнительного и дистанционного образования Кафедра Общей и специальной химии Лабораторная работа №3 «Определение концентрации фосфатов в почве фотоколориметрическим способом» по дисциплине: «ОСНОВЫ ИНЖЕНЕРНО ХИМИИ» ВАРИАНТ № 8 Выполнил студент группы БТПб(до)з-20-2 Волков Максим Юрьевич Номер зачетной книжки 20-10-000298 Проверил: Агейкина О.В. Тюмень, 2021 Лабораторная работа «Определение концентрации фосфатов в почве фотоколориметрическим способом» Цель работы: Ознакомление с методом фотоколориметрии на примере определения фосфатов в почве Ход работы. 1.1. Построение градуировочного графика. 1. Для построения градуировочного графика готовят серию стандартных растворов фосфора (V), Для этого в семь пронумерованных мерных колб на 50 мл последовательно вносят пипеткой аликвоты стандартного раствора фосфора 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4 мл. 2. Затем в каждую колбу приливают по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Объём жидкости в колбах доводят до метки дистиллированной водой, перемешивают и оставляют на 30 минут для завершения реакции (для развития окраски). 3. Далее измеряют оптическую плотность (светопоглощение) D полученных окрашенных растворов на фотоколориметре при длине волны λ = 440нм в кювете толщиной 10 мм. В качестве раствора сравнения (холостой пробы) используют дистиллированную воду, в которую добавлены все те же реагенты для которой D=0. Результаты измерений оптической плотности серии стандартных растворов
 С0=1 мг Р/мл 1 колба: С=1·0,2/50=0,004 мг Р/мл 2 колба: С=1·0,4/50=0,008 мг Р/мл 3 колба: С=1·0,6/50=0,012 мг Р/мл 4 колба: С=1·0,8/50=0,016 мг Р/мл 5 колба: С=1·1,0/50=0,02 мг Р/мл 6 колба: С=1·1,2/50=0,024 мг Р/мл 7 колба: С=1·1,4/50=0,028 мг Р/мл 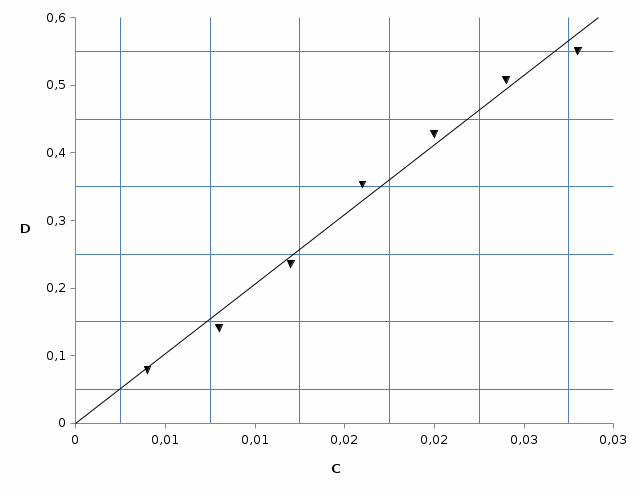 1.2 Результаты измерений исследуемых растворов 1. В коническую колбу на 250 мл помещают 20 г воздушно-сухой почвы и приливают 50 мл 10 %-ной уксусной кислоты (или 0,1 н HCl), перемешивают в течении 2-3 минут и оставляют на 30 минут (вытяжка из почвы). 2. Почву отфильтровывают, используя складчатый фильтр. 3. В две мерные колбы на 50 мл вносят пипеткой по 5 мл полученного фильтрата. В каждую колбу вносят по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Доводят объём жидкости в колбах до метки дистиллированной водой, перемешивают и оставляют на 30 мин. 4. Измеряют оптическую плотность исследуемых растворов (D1 и D2) аналогично п.3 построения градуировочного графика. Измерение оптической плотности исследуемых растворов проводят не менее трёх раз. Рассчитывают среднее значение Dх для каждого раствора. 5. Результаты измерений исследуемых растворов заносят в таблицу. 6. С помощью построенного калибровочного графика находят значения Сх для каждого исследуемого раствора (С1 и С2) по средним значениям Dх.
Сср=(0,0280+0,0285)/2= 0,0283мгР/мл   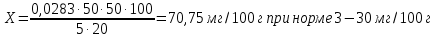 Вывод: содержание фосфора превышает норму более чем в 2 раза. 1. Сущность фотометрического анализа заключается в следующем: определяют уменьшение интенсивности потока монохроматического света (т.е. света с определенной, возможно узкой областью спектра) после прохождения его через определенной толщины слой окрашенного раствора и, учтя законы светопоглощения, делают вывод о концентрации растворенного вещества. 2. П. Бугер (1729г.) и И. Ламберт (1760 г.) установили взаимосвязь поглощения с толщиной слоя раствора. А. Бер (1852 г.) выявил зависимость поглощения от концентрации вещества. Указанные зависимости легли в основу закона светопоглощения, названного законом Бугера – Ламберта – Бера: «Интенсивность поглощения света растворами вещества пропорциональна их концентрации и толщине поглощающего слоя». Или «Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое)». Математическое выражение этого закона следующее: 𝐼 = 𝐼0 ⋅ 10 −𝜀𝜆⋅𝐶⋅𝑙 где: I0 - интенсивность падающего потока света; l – толщина поглощающего слоя, см; С – концентрация поглощающего вещества, моль/л; ε – молярный коэффициент светопоглощения при данной длине волны λ. 3. Для монохроматизации светового потока в фотоэлектроколориметрах применяют набор светофильтров. Светофильтры – это специальные стекла, пропускающие излучение определенного интервала длин волн (20–60 нм). 4. Оптическая плотность раствора прямо пропорциональна толщине слоя раствора. 5. Градуировочный график показывает зависимость оптической плотности от концентрации. Готовят растворы с точно известной концентрацией определяемого вещества, измеряют их оптическую плотность, стоят график зависимости, измеряю плотность раствора с неизвестной концентрацией и зная D опреляют по графику значение этой концентрации. 6. В основном происходит одностороннее движение фосфора с суши в воду и далее в донные отложения в форме гидро- и дигидроанионов HPO4 2- и H2PO4- с катионами меди, железа и других тяжелых металлов. Главным антропогенным источником фосфатов являются фосфорные удобрения: СaHPO4; Сa(H2PO4)2; NH4H2PO4 и (NH4)2HPO4. Поступление фосфатов из почвы в водоёмы с грунтовыми водами и поверхностными стоками является одним из факторов ускоренного эвтрофирования водоёмов. Кроме того, фосфат-ион регулирует направленность внутриклеточных процессов окисления. Вследствие этого недостаток в окружающей среде фосфора может быть фактором, лимитирующим процессы жизнедеятельности. Вместе с тем избыточное накопление фосфатов в почве приводит к загрязнению грунтовых вод и природных водоёмов. Фосфор содержится в земной коре в количестве 0,1 % в виде химических соединений и минералов, главным образом фосфатных. Нормальное количество фосфатов в почвах нечернозёмной зоны изменяется от 3 до 30мг на 100г почвы. 7. определение железа в воде, кремния, марганца, никеля и хрома в сточных водах, кислорода в питьевой и природной воде. 9. 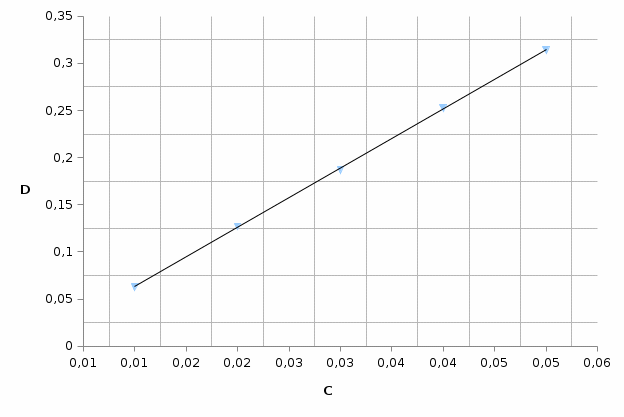 D=0,300, С=0,0478 мг Cr3+ /л D=0,100, С=0,016 мг Cr3+ /л |
