Биохимия БЕЛКИ (1 занятие). Многообразие белков
 Скачать 435.06 Kb. Скачать 435.06 Kb.
|
|
Рис. 1-44. Пространственные структуры эластазы (А) и химотрипсина (Б). Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. В процессе активации нативных белков сериновые протеазы гидролизуют одну или две особенные пептидные связи из сотен связей, имеющихся в белковом субстрате. Это связано с тем, что в нативном белке фермент узнаёт не только аминокислоты, непосредственно формирующие пептидную связь, но и некоторые аминокислотные остатки, окружающие связь, подвергающуюся ферментативному гидролизу. 2. Суперсемейство иммуноглобулинов В работе иммунной системы огромную роль играют белки, относящиеся к суперсемейству иммуноглобулинов. Это суперсемейство включает по крайней мере три больших семейства белков, участвующих в иммунной защите организма: семейство иммуноглобулинов, семейство Т-клеточных антигенраспознающих рецепторов и белки главного комплекса гистосовместимости I и II классов, которые в литературе обозначают МНС (от англ, major histocompatibility complex). В это суперсемейство включено также семейство адгезивных белков, участвующих в узнавании определённых типов клеток и их межклеточных взаимодействиях. Основной критерий включения белков в суперсемейство иммуноглобулинов - их доменная организация, достоверная гомология аминокислотных последовательностей и пространственных структур отдельных доменов. Кроме того, белки этого суперсемейства имеют схожие функции: иммуноглобулины взаимодействуют с чужеродными структурами, находящимися в крови, лимфе, межклеточной жидкости или секретах желёз, а рецепторы Т-лимфоцитов и белки главного комплекса гистосовместимости - с антигенами, находящимися на поверхности клеток данного организма. 3. Семейство иммуноглобулинов Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения, который мы рассмотрим на примере строения IgG. Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ, light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам. Лёгкие цепи IgG состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена (рис. 1-45). Тяжёлые цепи IgG имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют "биваленты". В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных доменов обеих цепей, а всего лишь 20-30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальные способности каждого клона антител взаимодействовать с соответствующим (комплементарным) антигеном. Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител. 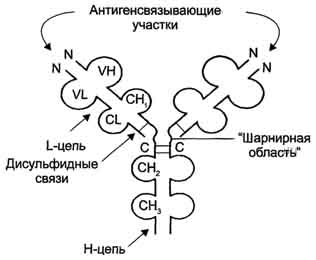 Рис. 1-45. Строение иммуноглобулина G. Классы иммуноглобулинов. Существует 5 классов тяжёлых цепей иммуноглобулинов, отличающихся по строению константных доменов: α, δ, ξ, γ и μ. В соответствии с ними различают 5 классов иммуноглобулинов: A, D, Е, G и М. Особенности строения тяжёлых цепей придают их "шарнирным участкам" и С-концевым областям характерную для каждого класса конформацию. Связывание антигена с антителом изменяет конформацию константных доменов тяжёлых цепей, что определяет путь разрушения комплекса в организме (связывание с белками системы комплемента или поглощение комплекса фагоцитирующими клетками). Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь. Мембранно-с вязанная форма иммуноглобулинов М. Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой ("хвостовой") области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков. Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител. Секреторная форма иммуноглобулинов М. Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46). В тяжёлых цепях их мономеров отсутствует гидрофобная "хвостовая" часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления Неизвестного ранее антигена к иммуноглобулину (рис. 1-47). Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его "хвостовой" области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки. Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1 а в наименьшем - IgGg4). Степень гомологии между этими подклассами очень высока (около 90-95%). 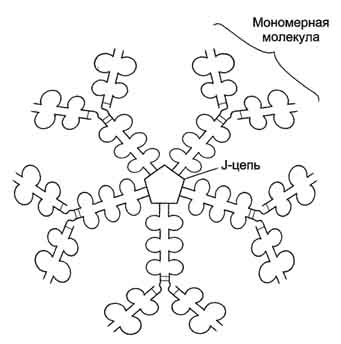 Рис. 1-46. Строение пентамерной секреторной молекулы иммуноглобулина М. 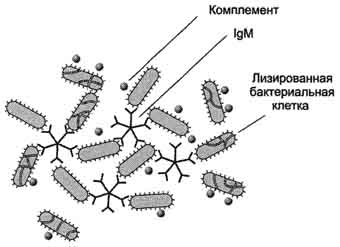 Рис. 1-47. Связывание IgM с антигенами бактериальных клеток и их разрушение активированными белками системы комплемента. 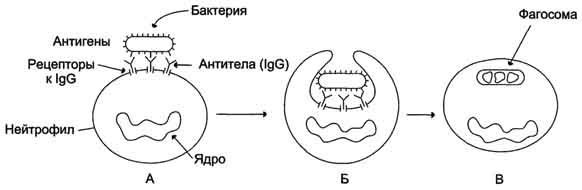 Рис. 1-48. Фагоцитоз комплекса антиген-антитело нейтрофилом. А - взаимодействие бактерии, покрытой IgG, с рецепторами нейтрофилов; Б - поглощение бактерии нейтрофилом; В - переваривание бактерии внутри фагосомы нейтрофила. IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в "хвостовой" области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах (рис. 1-48). IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций. Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J (рис. 1-49). На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство (рис. 1-50). Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм. Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток (рис. 1-51). 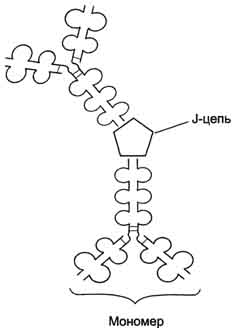 Мономер Рис. 1-49. Строение димерной молекулы иммуноглобулина А. 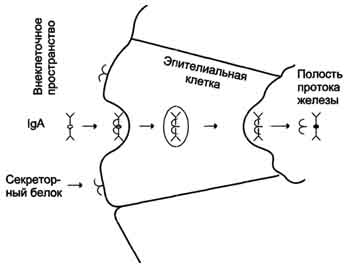 Рис. 1-50. Транспорт иммуноглобулинов А через эпителиальные клетки в протоки желёз. После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций. Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено. 4. Семейство Т-клеточных антигенраспознающих рецепторов Если антитела, вырабатываемые В-лимфоцитами, связывают антигены в жидкостях организма (так называемый гуморальный иммунитет), то Т-лимфоциты взаимодействуют с антигенами на поверхности заражённых вирусами и изменённых в результате опухолевой трансформации собственных клеток организма (клеточный иммунитет). Т-лимфоциты узнают антигены только в комплексе с молекулами МНС I или II класса, также присутствующими на клеточной поверхности. Рецепторы Т-лимфоцитов - гетеродимеры, т.е. состоят из α- и β-цепей. Каждая цепь имеет два иммуноглобулиноподобных домена: вариабельный (V) и константный (С) (рис. 1-52). С-концевые участки каждой цепи встроены в плазматическую мембрану. Единственный антигенсвязьшающий участок располагается между двумя вариабельными доменами Vα и Vβ. Количество рецепторов Т-лимфоцитов с разными антигенсвязьшающими участками сопоставимо с разнообразием иммуноглобулинов. 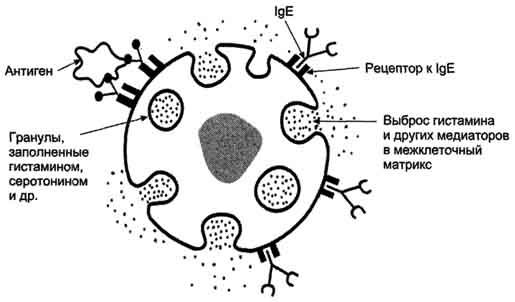 Рис. 1-51. Выброс биологически активных веществ тучной клеткой в результате присоединения антигена к фиксированным на её поверхности IgE. Семейство белков главного комплекса гистосовместимости Белки главного комплекса гистосовместимости были открыты при изучении вопросов внутривидовой пересадки тканей, откуда и произошло их название. Их называют также белками МНС (см. выше), или белками HLA (от англ. human lymphocyte antigen - человеческие лимфоцитарные антигены), так как впервые они были обнаружены на лимфоцитах человека. Существует два основных класса молекул МНС: I и II. Молекулы МНС класса I расположены на поверхности практически всех клеток организма человека, а белки МНС класса II только на определённых клетках иммунной системы, называемых антигенпредставляющими клетками. К ним, в первую очередь, относят макрофаги и В-лимфоциты, контактировавшие с антигеном. Молекулы МНС класса I - гетеродимеры. Они имеют одну полипептидную a-цепь, связанную нековалентными связями с небольшим внеклеточным белком β2-микроглобулином. Полипептидная α-цепь имеет три внеклеточных глобулярных домена (α1, α2, α3), трансмембранный участок и карбоксильный конец, локализованный в цитоплазме (рис. 1-53, А). α3-Домен и β2-микроглобулин имеют конформацию, напоминающую структуру иммуноглобулинов. Домены α1 и α2 содержат вариабельные участки, способные связывать "развёрнутый" антиген (чаще всего пептидный фрагмент чужеродного белка), расположенный на поверхности клеток. Молекулы МНС класса II - также гетеродимеры. Они состоят из двух полипептидных цепей - α и β, имеющих по одному консервативному иммуноглобулинподобному домену и по одному вариабельному домену на N-концевых участках. Связывание антигенов происходит в области вариабельных доменов α- и β-цепей (рис. 1-53, Б). Чужеродные белки в клетке человека (например, белки вирусных частиц), в лизосомах подвергаются ограниченному протеолизу, и небольшие фрагменты этих белков вместе с белками МНС класса I или II экспонируются на поверхности клеточной мембраны. Комплексы пептид-белок МНС узнаются рецепторами Т-лимфоцитов. В результате происходит специфическое взаимодействие (рис. 1-54), активация Т-лимфоцита и развитие иммунной реакции. Так, взаимодействие цитотоксического Т-лимфоцита с комплексом антиген-МНС I на поверхности заражённой вирусом клетки приводит к высвобождению лимфоцитом специальных белков, вызывающих повреждение и гибель заражённой клетки. 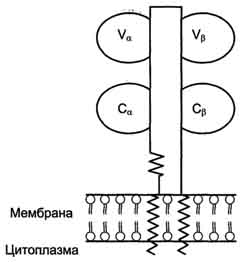 Рис. 1-52. Строение рецептора Т-лимфоцитов. 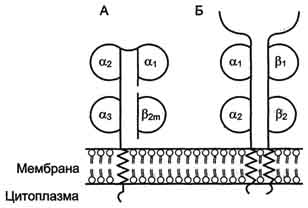 Рис. 1-53. Строение белков главного комплекса гистосовместимости: МНС класса I (А) и МНС класса II (Б). 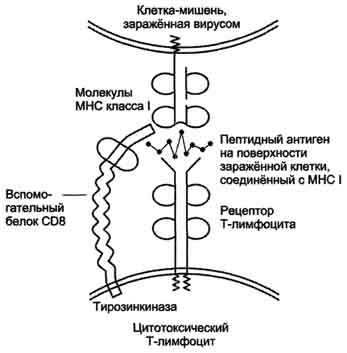 Рис. 1-54. Специфическое взаимодействие рецептора цито-токсического Т-лимфоцита с комплексом антиген-МНС I белком. Е. Изофункциональные белки Изофункциональные белки - семейства белков, выполняющих почти одинаковую или близкую функцию, но небольшие особенности строения и функционирования некоторых членов этого семейства могут иметь важное физиологическое значение. Пример таких белков - изоформы гемоглобина человека: HbA, HbA2, HbF и другие, рассмотренные выше. Все они представляют собой тетрамеры, но состоят из разного набора протомеров α, β, γ, δ. Гемоглобины выполняют одинаковую функцию - присоединяют О2 и переносят его в ткани. Однако каждый из них обладает функциональными особенностями. Так, гемоглобин F имеет большее сродство к О2, чем НbА, и благодаря этому обеспечивает диффузию О2 от НbА из крови матери к HbF в крови плода. |
