Кислотно-основное титрование на демо-экзамен. Модуль Приготовление растворов для кислотноосновного титрования
 Скачать 31.86 Kb. Скачать 31.86 Kb.
|
Модуль «Приготовление растворов для кислотно-основного титрования»Ссылка на презентацию по модулю https://cloud.mail.ru/public/3kvS/3Bbh2gggG Для выполнения модуля «Приготовление растворов для кислотно-основного титрования» студенту необходимо решить следующие задачи: Провести расчет необходимого объема концентрированного раствора кислоты или щелочи для приготовления разбавленного раствора; Провести стандартизацию приготовленного раствора; Провести анализ и обработку полученных результатов анализа. Обучающее видео https://www.youtube.com/watch?v=P-hzAt7PMhU&feature=emb_logo  Приготовление титрованного раствора соляной кислоты (ГОСТ 25794.1-83) Титрованные растворы предназначены для титриметрических определений и содержат в определяемом объеме точно известные количества активного вещества. За основу расчетов при приготовлении и проверке титрованных растворов взято понятие «молярная масса эквивалентов». Задание Провести приготовление 500 см3 раствора соляной кислоты с концентрацией 0,1 моль-экв/дм3. Провести определение точной концентрации приготовленного раствора методом отдельных навесок. Оборудование и реактивы Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 200 г. Штатив для бюретки с двумя лапками. Электроплитка с закрытой спиралью. Термометр 50-1000С. Колба мерная, 500 мл. Пипетки и бюретки (25 мл) 2-го класса точности по ГОСТ 20292-74; Колбы конические вместимостью 250 см3 по ГОСТ 25336-82; Мерный цилиндр вместимостью 50-100 см3; Бюкс; Воронки аналитические; Стаканы химические 100-600 см3; Кислота соляная по ГОСТ 3118, концентрированная с известной плотностью; Метиловый красный, 0,1% спиртовый раствор; Вода дистиллированная по ГОСТ 6709-72; Натрий тетраборнокислый 10-водный по ГОСТ 4199. Приготовление раствора кислоты заданной концентрации Раствор кислоты готовят разбавлением концентрированной кислоты. Для приготовления 500 см3 раствора берут объем соляной кислоты в соответствии с таблицей 5.1. Таблица 5.1
Отмеренный объем кислоты осторожно при перемешивании вливают в воду и доводят объем раствора водой до 500 см3. Определение коэффициента поправки по 10-водному тетраборнокислому натрию. Формула Na2B4O7∙10H2O. Относительная молекулярная масса – 381,37. Молярная масса эквивалента – 190,68 г/моль. При установлении коэффициента поправки применяют калиброванную мерную посуду, титрование проводят в конических колбах вместимостью 250- 300 см3. Воду добавляют цилиндром. Для установления коэффициента поправки используют не менее трех навесок установочного вещества. Взвешивая их с точностью до четвертого знака после запятой. 0,3000 – 0,4000 г 10-водного тетраборнокислого натрия помещают в коническую колбу, растворяют при энергичном взбалтывании в 20-40 см3 теплой (50-600С) воды, охлаждают до комнатной температуры, добавляют 3-4 капли метилового красного и титруют из бюретки раствором соляной кислоты до перехода желтой окраски в розовато-оранжевую. Обработка результатов Коэффициент поправки (К) вычисляют по формуле: К = 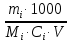 , ,где mi – масса навески установочного вещества, г; Mi – молярная масса эквивалента установочного вещества, г/моль; Сi – заданная молярная концентрация вещества в растворе, моль-экв/л (н.); V – объем анализируемого раствора, израсходованный на титрование, см3. Коэффициент поправки вычисляют с точностью до четвертого десятичного знака по каждой навеске установочного вещества. Расхождения между коэффициентами не должны превышать 0,001. Из вычисленных значений коэффициентов берут среднее арифметическое. Это значение коэффициента поправки должно быть равным 1,00±0,03. Если коэффициент поправки выходит из указанных пределов, то раствор соответственно укрепляют или разбавляют. Концентрацию полученного раствора находят по формуле: С = сi∙К.  Пример оформления протокола испытания Расчет объема соляной кислоты для приготовления 1000 см3 раствора концентрацией 0,1 моль-экв/ дм3: ρ(HCl) = 1,178 г/см3 Формула интерполяции: V = Vi + 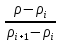 (Vi+1 – Vi) (Vi+1 – Vi)Проведем расчет: V = 9,00 + 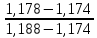 (8,50 – 9,00) = 8,79 см3 переносим в мерную колбу объемом 1000 см3, растворяем и доводим до метки. (8,50 – 9,00) = 8,79 см3 переносим в мерную колбу объемом 1000 см3, растворяем и доводим до метки. Определение коэффициента поправки раствора соляной кислоты
Расхождение между коэффициентами поправки: 1,0010 – 1,0001 = 0,0009<0,001 Вывод о приемлемости результатов расчета коэффициента поправки: результаты приемлемы Вывод о соответствии коэффициента диапазону 1,00 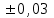 соответствует. соответствует. Концентрация полученного раствора: С = 0,1*1,0006 = 0,1001 с Заключение о концентрации полученного раствора: Приготовлен раствор концентрацией 0,1001 моль-экв/дм3, коэффициент поправки составляет 1,0006. Контрольные вопросы: Дать определение титриметрическому методу анализа. Что называется титрантом и титруемым раствором? Дать определение понятиям: кислотно-основное титрование, точка эквивалентности Какая мерная посуда используется «на вливание» и какая «на выливание»? |

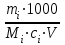 ,
,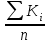
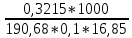 =1,0006
=1,0006