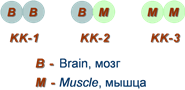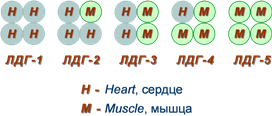Ферменты883038135. На чем основан ферментативный катализ
 Скачать 476.34 Kb. Скачать 476.34 Kb.
|
|
На чем основан ферментативный катализ? Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И.П.Павлов, назвав их "возбудителями жизни". Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний – фенилкетонурия, гликогенозы, галактоземия, тирозинемия или существенному снижению качества жизни – дислипопротеинемии, гемофилия. Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов. 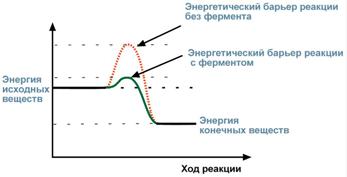 Величина энергии активации с ферментом и без него По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях. Сходство и отличия ферментов и неорганических катализаторов
Ускорение реакций при помощи ферментов весьма значительно, например:
2Н2О2 → О2 + 2Н2О Если скорость реакции без катализатора принять за единицу, то в присутствии платиновой черни скорость реакции увеличивается в 2×104 раза и энергия активации снижается с 18 до 12 ккал/моль, в присутствии фермента каталазы скорость реакции возрастает в 2×1011 раза с энергией активации 2 ккал/моль.
Ферментативный катализ имеет свои особенности Этапы катализа В ферментативной реакции можно выделить следующие этапы:
Механизмы катализа
Типы ферментативных реакций
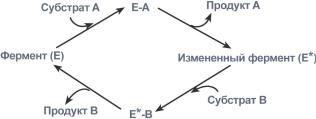 Ферментативная реакция по типу "пинг-понг"
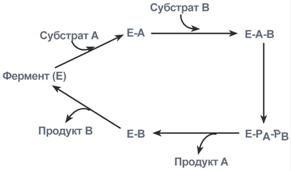 Ферментативная реакция по типу "последовательных реакций"
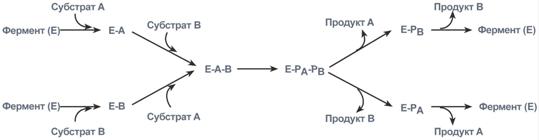 Ферментативная реакция по типу "случайных взаимодействий" Ферменты имеют белковую природу Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные. Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем), лактатдегидрогеназа (содержит Zn2+), амилаза (содержит Ca2+). Кофактор, в свою очередь, может называться коферментом (НАД+, НАДФ+, ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe2+, Mg2+, Ca2+, Zn2+). Деление на коферменты и простетические группы не всегда однозначно:
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении. Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц. Структурно-функциональная организация ферментов В составе фермента выделяют области, выполняющие различную функцию:
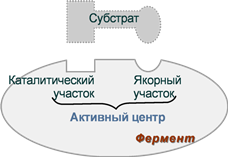 Схема строения ферментов У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр. У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.  Схема формирования сложного фермента
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах. 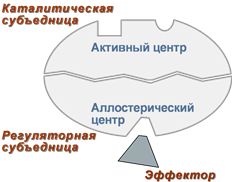 Схема строения аллостерического фермента В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Изоферменты Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры). Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы.
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции. Мультиферментные комплексы В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами "туннель". В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции. 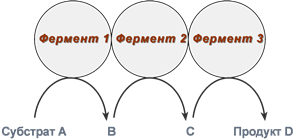 Строение мульферментного комплекса Например,
Абзимы Абзимами называются антитела, имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции). Что означает выражение "активность фермента"? Прежде чем обсуждать свойства ферментов и зависимость ферментов от каких-либо факторов необходимо определиться с понятием активность ферментов. В повседневной биохимической практике практически не оценивается количество фермента, а только его активность. Активность – более широкое понятие, чем количество. Она подразумевает в первую очередь результат реакции, а именно убыль субстрата или накопление продукта. Естественно, при этом нельзя игнорировать время, которое проработал фермент и число молекул фермента. Но так как число молекул фермента подсчитать обычно нереально, то используют количество биологического материала, содержащего фермент (объем или массу). Таким образом при определении активности ферментов нужно одновременно учитывать три переменные:
Для понимания соотношений указанных факторов наглядным и простым примером может служить строительство двух зданий. Здания приравняем к продукту реакции, рабочие – это ферменты, бригада пусть соответствует объему биологического материала. Итак, задачи из 3-го класса:
Основы количественного определения активности ферментов
В практике обычно используют:
Активно используются и другие производные – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин. Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д. Например, известно, что 1 г пепсина расщепляет 50 кг яичного белка за один час – таким образом, его активность составит 50 кг/час на 1 г фермента, если 1,6 мл слюны расщепляет 175 кг крахмала в час – активность амилазы слюны составит 109,4 кг крахмала в час на 1 мл слюны или 1,82 кг/мин×г или 30,3 г крахмала/ с×мл.
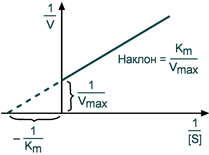
Зависимость фермента от количества субстрата описывает ферментативная кинетика Уравнения Михаэлиса-Ментен и Лайнуивера-Берка Общую теорию ферментативной кинетики и зависимость активности фермента от субстрата.описали Л.Михаэлис и М.Л.Ментен, выразив его в своем уравнении. Бриггс и Холдейн усовершенствовали их уравнение, введя введя в него константу Михаэлиса (Km), определяемую экспериментально. Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата. Так как пользоваться графиком, построенным в прямых координатах V и Km для точных расчетов неудобно, то Г.Лайнуивер и Д.Бэрк преобразовали уравнение Бриггса–Холдейна в обратные координаты.
На самом деле уравнение Михаэлиса-Ментен в данном виде предложили Бриггс и Холдейн, но в честь основоположников оно носит название Михаэлиса-Ментен. Выделяют три основных решения уравнения Михаэлиса-Ментен:
В математическом смысле Km соответствует концентрации субстрата при которой скорость реакции равна половине максимальной. Ее биологический смысл заключается в характеристике сродства фермента к субстрату, а именно: увеличение величины Кm означает снижение сродства фермента к субстрату.
Ферменты избирательны в своем действии Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента.
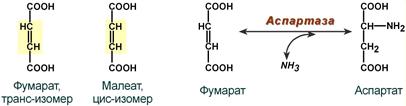 Стереоспецифичность аспартазы к транс-изомеру субстрата
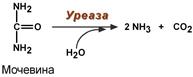
Реакция расщепления мочевины
Механизмы специфичности В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
 Схематичное представление теории Фишера
 Схематичное представление теории Кошланда Как регулируется активность ферментов? Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – предоставить клетке шанс выжить. Способы регуляции активности ферментов В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
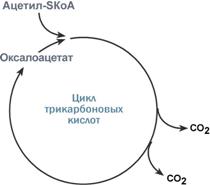
Здесь работает закон действия масс – фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно – скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию. Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА. Именно из-за недостатка оксалоацетата (относительного или абсолютного) при голодании и инсулинзависимом сахарном диабете развивается состояние под названием кетоацидоз.
Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах, ядре, плазматической мембране и т.п. Например, ферменты цикла трикарбоновых кислот и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах.
Генетическая регуляция (изменение количества фермента) может происходить в результате увеличения или снижения его синтеза. С этой точки зрения ферменты можно подразделить на три группы:
Примеры индуцируемых ферментов:
Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. 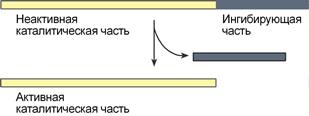 Схема активации фермента способом "ограниченного протеолиза" Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывающей системы крови, лизосомальных ферментов (катепсины). Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок в плазме крови до наступления определенного момента (факторы свертывания крови, белки системы комплемента, калликреин-кининовой и ренин-ангиотензиновой систем).
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. 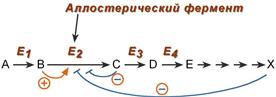 Общий принцип аллостерической регуляции В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким то образом связанных с данной реакцией. 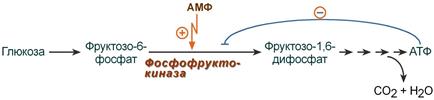 Регуляция фосфофруктокиназы конечным продуктом Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. Еще один пример: в большинстве клеток организма (кроме печени) при регуляции синтеза холестерола аллостерическим ингибитором ключевого фермента этого процесса ГМГ-КоА-редуктазы выступает сам холестерол, что быстро и точно регулирует его количество. В то же время в адипоцитах синтез нейтрального жира (триацилглицеролов) никак не ограничивается количеством конечного продукта, что позволяет клетке накапливать жир в гигантском количестве.
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
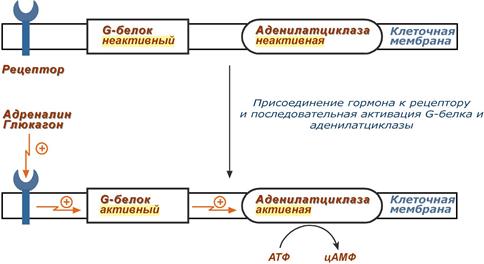 Упрощенная схема активации аденилатциклазы
Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются. 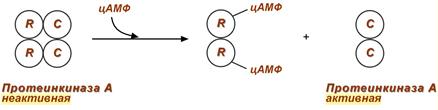 Активация протеинкиназы А при помощи цАМФ
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. 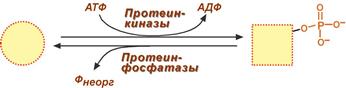 Изменение активности фермента при фосфорилировании-дефосфорилировании Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза
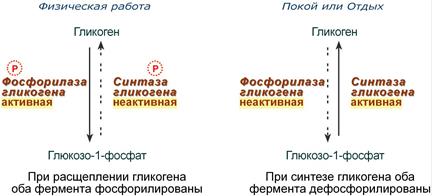 Зависимость активности ферментов обмена гликогена от наличия в структуре фосфорной кислоты Лекарства обычно ингибируют ферменты В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме. Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично. В научной деятельности для более точного описания процессов ингибирования пользуются кинетикой Михаэлиса-Ментен и ее терминами - максимальная скорость (Vmax) и константа Михаэлиса (Km). Ингибирование ферментов Можно выделить два основных направления ингибирования
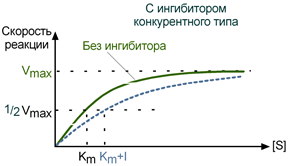
Необратимое ингибирование При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности. Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию. Аналогично диизопропилфторфосфат ингибирует химотрипсин и другие протеазы, имеющие в активном центре серин (сериновые протеазы). Диизопропилфторфосфат относится к нервно-паралитическим ядам, аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман). Сюда же относится вещество "малатион", включенный в инсектициды (карбофос, дихлофос) и превращающийся в организме насекомых в ингибитор ацетилхолинэстеразы, а в организме животных и человека разрушающийся до безвредных продуктов. 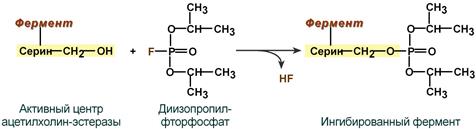 Механизм необратимого ингибирования ацетилхолинэстеразы Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях. Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов. 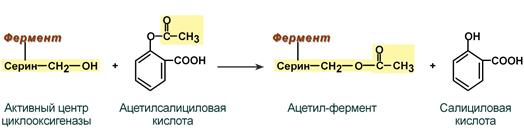 Механизм необратимого ингибирования циклооксигеназы Третьим показательным примером необратимого ингибирования является влияние антибиотика пенициллина на фермент транспептидазу, обеспечивающую сшивку цепей пептидогликана как последний шаг в синтезе клеточной стенки бактерий. Обратимое ингибирование При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается. Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС. Конкурентное ингибирование При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата. Например:
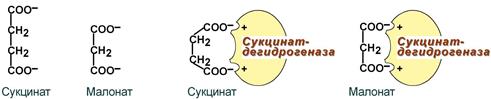 Конкурентное ингибирование сукцинатдегидрогеназы
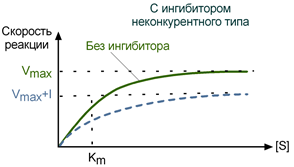
Неконкурентное ингибирование Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
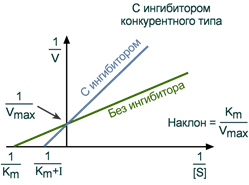
связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков. Еще примером может служить фруктозо-1,6-дифосфат, который ингибируя аденилосукцинатсинтетазу (синтез пуриновых нуклеотидов), синхронизирует в мышце функционирование пуриннуклеотидного цикла и гликолиза, поставлющего энергию для мышечного сокращения. Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор. В данном случае максимальная скорость реакции (Vmax) уменьшается, константа Михаэлиса (Km) не изменяется. Бесконкурентное ингибирование В этом случае ингибитор связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Таким образом, бесконкурентное ингибирование более сложно, чем другие типы ингибирования. В качестве примера бесконкурентного ингибирования обычно называют связывание пенициллина и фермента транспептидазы, обеспечивающей сшивку цепей пептидогликана при синтезе клеточной стенки бактерий. Пенициллин встраивается в активный центр фермента и его лактамное кольцо мимикрирует под переходное состояние фермента - фермент-субстрат. Хотя ситуация похожа на конкурентное ингибирование, из-за одновременного снижения Vmax и Km этот случай относят к бесконкурентному. На примере пенициллина также рассматривается т.н. суицидное ингибирование. При нем субстрат первоначально связывается с ферментом обратимо, а затем образует устойчивое ковалентное соединение с активным центром, что приводит к ингибированию активности фермента. Смешанное ингибирование При таком ингибировании ингибитор способен присоединяться везде – не только в активном центре, и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность. Примером является влияние мертиолата (ртутьорганическое вещество) на сахаразу грибов микромицетов для подавления их роста. Ингибирование описывает кинетика Михаэлиса-Ментен Кинетика конкурентного ингибирования При таком виде ингибирования ингибитор конкурирует с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и снижению катализа. Используя терминологию кинетики Михаэлиса-Ментен можно сказать, что конкурентный ингибитор уменьшает сродство фермента к субстрату, повышая константу Михаэлиса (Km), максимальная скорость реакции (Vmax) остается при этом неизменнной. Зависимость в координатах Лайнуивера-Берка имеет вид пучка прямых, пересекающихся на оси ординат. Конкурентный ингибитор увеличивает Кm и не изменяет Vmax.
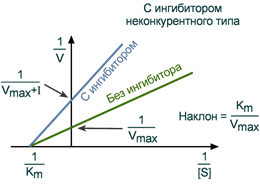
Кинетика неконкурентного ингибирования Особенностью неконкурентного ингибитора является его способность связываться с ферментом не в активном центре, и изменение концентрации субстрата никак не влияет на это связывание. В то же время неконкурентный ингибитор не мешает связыванию субстрата с активным центром. В результате формируется тройной комплекс фермент-субстрат-ингибитор (E-S-I), в котором фермент уже не способен изменить свою конформацию и обеспечить проведение реакции. Количество "работоспособных" комплексов E-S при этом снижается. Максимальная скорость реакции (Vmax) при неконкурентном ингибировании снижается, константа Михаэлиса (Km) не изменяется, т.е. добавление дополнительного субстрата не может повлиять на состояние активного центра и работу фермента. Зависимость в координатах Лайнуивера-Берка имеет вид пучка прямых, пересекающихся на оси абсцисс. Неконкурентный ингибитор не изменяет Кm и снижает Vmax.
Кинетика бесконкурентного ингибирования Бесконкурентный ингибитор способен связываться только с уже образовавшимся комплексом E-S, но не со свободным ферментом. Связывание происходит либо на молекуле субстрата, либо с ферментом, уже начавшем катализ и изменившим свою конформацию. Образовавшийся тройной комплекс E-S-I также непродуктивен. Максимальная скорость реакции (Vmax) и константа Михаэлиса (Km) при бесконкурентном ингибировании снижаются. Добавление дополнительного субстрата не может повлиять на состояние активного центра и работу фермента. |