дота гайд. Найти изменение энтропии при переходе 3 молей со
 Скачать 23.91 Kb. Скачать 23.91 Kb.
|
|
Найти изменение энтропии при переходе 3 молей СО2 от стандартных условий к температуре 773 К и объему 90л. Считать Ср равным 7/2·R. Считая Ср(SO2) = 7/2·R и приняв его за идеальный газ, рассчитать изменение энтропии 1 моля SO2 при его переходе от стандартных условий к температуре 423 К и давлению 3,04·105Па. Найти изменение энтропии 50г азота при нагревании от 298 до 423 К при постоянном давлении и при постоянном объеме, считая, что теплоемкость азота при Р=const равна 7/2·R. При 298 К и Р = 1,0133·105 Па смешали 2л СО и 5л СО2. Определить изменение энтропии, считая СО и СО2 идеальными газами. Определить изменение энтропии при плавлении 2 кг свинца, если температура плавления равна 600 К, а теплота плавления 5123 Дж/моль. Определить изменение энтропии при нагревании 1 моля меди от 298 до 773 К. Молярная теплоемкость меди выражается уравнением Ср = 22,64 + 6,28·10-3Т. Определить изменение энтропии при нагревании 5 кг цинка от 273 К до точки плавления (693 К). Стандартная энтропия серебра при 298 К равна 42,55 Дж/(моль·К), его молярная теплоемкость зависит от температуры по уравнению Ср = 23,97 + 5,27·10-3Т – 0,25·105Т-2. Определить энтропию серебра при температуре плавления (1234 К). Молярная теплоемкость СО выражается уравнением Ср = 28,41 + 4,10·10-3Т – 0,46·105Т-2. Рассчитать молярную энтропию СО при 700 К, если 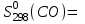 197,55 Дж/(моль·К). 197,55 Дж/(моль·К).Ср = 27,28 + 3,26·10-3Т + 0,50·105Т-2. Определить энтропию водорода при 1000 К, если 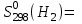 130,52 Дж/(моль·К). 130,52 Дж/(моль·К).Определить изменение энтропии при нагревании 100 г серы от 298 до 400 К на основании следующих данных: Ср(Sромб.) = 14,97 + 26,10·10-3Т Ср(Sмонокл.) = 14,88 + 29,11·10-3Т температура превращения Sр→ Sм равна 368,6 К. Теплота превращения ΔΗ = 376,38 Дж/моль. Стандартная энтропия кобальта при 298 К равна 28,69 Дж/(моль·К). Зависимость теплоемкости кобальта от температуры имеет вид Ср = 19,74 + 17,98·10-3Т. При температуре 718 К Со – α превращается в Со– β. Теплота превращения составляет 543,66 Дж/моль. Определить энтропию Со– β при температуре 718 К. Стандартная энтропия кварца при температуре 298 К равна 41,84 Дж/(моль·К). При температуре 846 К происходит превращение SiO2 – α → SiO2 – β. Зависимость теплоемкостей от температуры модификаций кварца имеют вид Ср(SiO2 – α) = 46,99 + 34,31·10-3Т - 11,30·105Т-2 Ср(SiO2 – β) = 60,29 + 8,12·10-3Т Теплота перехода ΔΗα→β = 630 Дж/моль. Определить энтропию SiO2 – β при температуре 1200 К. Стандартная энтропия белого олова при 298 К равна 18,83 Дж/(моль·К). Температура плавления олова 505 К. Теплота плавления составляет 7030 Дж/моль. Температурные зависимости теплоемкостей модификаций олова имеют вид Ср(Sn белое) = 21,59 + 18,10·10-3Т Ср(Snжелтое) = 21,54 + 6,15·10-3Т + 12,88·105Т-2. Определить энтропию олова при температуре 1100 К. Стандартная энтропия Н2О (ж) при температуре 298 К равна 69,95 Дж/(моль·К). Определить энтропию Н2О (г) при температуре 500 К, если при температуре кипения воды 373 К, теплота испарения 40858,14 Дж/моль, а температурные зависимости теплоемкостей имеют вид Ср(Н2Огаз) = 30,00 + 10,71·10-3Т + 0,33·105Т-2 Ср(Н2Ожид.) = 39,02 + 76,54·10-3Т + 11,06·105Т-2. Определить 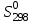 для реакций для реакцийС + СО2 = 2СО Н2 + 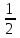 О2 = Н2О О2 = Н2О2NiO = 2Ni + O2 СоО + СО = Со + СО2. Определить 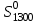 для реакции для реакции2FeO = 2Fe + O2 . Определить 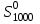 для реакции для реакцииMgCO3 = MgO + CO2 . |
