них. Кучкина 3 группа 6 леч. Научная обоснованность лабораторного исследования уровня
 Скачать 0.75 Mb. Скачать 0.75 Mb.
|
|
федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации Лечебный факультет Кафедра поликлинической терапии и общей врачебной практики Вид практики: Производственная практика Тип: Научно-исследовательская работа тема: Научная обоснованность лабораторного исследования уровня сердечного тропонина I и T в диагностике острого инфаркта миокарда с точки зрения доказательной медицины. Исполнитель: студент Кучкина Екатерина Евгеньевна Курса 6 группы 3 Факультета лечебного Куратор: _____________ Дата сдачи НИР________________________________________ Оценка___________________________________________________________ Подпись руководителя_____________________________________________ Курск - 2022 г. Список сокращений ОИМ - острый инфаркт миокарда Тн – тропонин вч-Тн — высокочувствительный тропонин ОКС- острый коронарный синдром ИМ- инфаркт миокарда НС- нестабильная стенокардия ССЗ- сердечно-сосудистые заболевания СН – сердечная недостаточность NP- Натрийуретические пептиды cTns – сердечные тропонины Введение Актуальность темы: сердечно-сосудистые заболевания являются главной причиной летальности в индустриально развитых странах и в России. Эффективность лечебных процедур при ведении больных с острым инфарктом миокарда и нестабильной стенокардией, как основных форм острого коронарного синдрома во многом зависит от ранней и точной диагностики заболевания. Цель исследовательской работы: - разработка алгоритма точного и быстрого исключения ОИМ - установления диагноза ОИМ в течение 1 ч с определением уровня тропонинов в разные промежутки течения ИМ - исследование эффективности применения сердечных тропонинов - изучение проведенных лабораторных экспериментов Задачи исследования: сортировка больных на ранних этапах госпитализации, стратификация риска и прогноза заболевания. Материалы и методы исследования: Сбор и анализ публикаций по использованию сердечного тропонина I и T у пациентов с острым инфарктом миокарда; Поиск публикаций был произведен с использованием отечественных (РИНЦ) и зарубежных (PubMed, ClinicalTrials, Medline) баз данных. Почти у половины больных с ИМ наблюдается безболевое начало заболевания или нетипичное проявление болевого синдрома и более чем у 40% пациентов отсутствуют четкие, однозначно интерпретируемые изменения ЭКГ. Третий диагностический признак ИМ — гиперферментемия таких традиционно определяемых сывороточных энзимов, как аспартатаминотрансфераза (АСТ), лактатдегидрогеназа (ЛДГ) и креатинкиназа (КК) — высокочувствителен, но неспецифичен. Более диагностически специфичный тест — определение изофермента КК МВ. Но вследствие того, что КК МВ содержится не только в миокардиальных клетках, но и в скелетных мышцах, хотя и в относительно небольших количествах (3–5% от общей КК), тест не может рассматриваться как идеально специфичный маркер миокардиального повреждения. Поэтому до последнего времени существовали серьезные проблемы в диагностике ИМ, особенно у больных ОКС без подъема сегмента ST. Они были во многом решены после того, как в миокардиальных клетках были идентифицированы абсолютно специфичные для этой ткани миокардиальные изоформы тропонина Т и тропонина I. После разработки в начале 1990-х гг. коммерческих тест-систем для определения уровня тропонинов (Тн) были проведены многочисленные исследования их диагностической значимости. Доказательная база клинических исследований сердечных тропонинов T и I Сердечно-сосудистые заболевания (ССЗ) являются ведущей причиной смерти, заболеваемости и госпитализаций во всем мире [1-3]. Стратификация риска для пациента является важной целью, поскольку она определяет стратегии лечения и последующего наблюдения, конечной целью которых является влияние на естественное течение болезни. Лабораторные биомаркеры с интересом рассматриваются как инструменты прогностической стратификации [4–6]. За последние годы в этом отношении было оценено более 100 новых биомаркеров, опубликовано более 4000 клинических исследований [6-9]. Оценка прогностической точности нового сердечно-сосудистого биомаркера очень сложна [9, 10]. Согласно принципам доказательной лабораторной медицины, биомаркер должен не только быть независимым предиктором результата в моделях множественной регрессии, но и влиять на ведение пациента [5, 11], что является предпосылкой экономической эффективности. В результате очень немногие новые лабораторные биомаркеры рекомендуются для прогнозирования риска [12, 13]. При рассмотрение данной темы нам необходимо обратиться к биохимическим свойствам сердечных тропонина Т и тропонина I. Они отличаются своим аминокислотным составом от скелетных тропонинов, тогда как сердечный тропонин С полностью идентичен скелетному тропонину С [1, 4]. Уникальное строение сердечных тропонина Т и тропонина I дает важное клиническое применение — использование в качестве лабораторных биомаркеров при сердечно– сосудистых заболеваниях [8–9], включая острый инфаркт миокарда, миокардиты и сердечную недостаточность, о чем мы подробнее будем говорить ниже. Тропонин Т, в отличие от тропонина I, кодируется несколькими генами, вследствие чего образуется несколько изоформ сердечного тропонина Т [13–14]. Данные гены также имеют в своем составе несколько экзонов, которые подвергаются альтернативному сплайсингу, в результате которого может образоваться большое количество изоформ тропонина Т с разными аминокислотными последовательностями. В миокарде взрослых людей экспрессируется только одна изоформа тропонина сердечного Т, а в эмбриональном миокарде несколько. В патологических условиях, например, при сердечно недостаточности, происходит усиление экспрессии сердечных изоформ тропонина Т, характерных для эмбрионального периода [15–16]. Важным направлением использования тропонинов является лабораторная диагностика сердечно–сосудистых заболеваний. Сердечные тропонины, являются внутриклеточными белками и обнаружение их в сыворотке крови свидетельствует о повреждении или гибели клеток миокарда. При обратимом повреждении кардиомиоцитов происходит нарушение целостности мембраны и/или повышение ее проницаемости, а также частичный протеолиз цитозольного пула тропонинов на более мелкие фрагменты и их высвобождение из клетки во внеклеточное пространство и сыворотку крови. Уровни тропонинов повышаются в несколько или максимум в десятки раз, поскольку объем цитозольного пула тропонинов невелик. Обратимое повреждение кардиомиоцитов может происходить при тяжелой физической нагрузке (марафонском беге), психоэмоциональном стрессе, сепсис-индуцированной дисфункции миокарде [8, 19–21]. При необратимом повреждении, которое чаще всего возникает при остром инфаркте миокарда (ишемическое повреждение) или миокардите (воспалительное повреждение) происходит разрушение сократительного аппарата кардиомиоцитов и высвобождение структурного пула тропонинов в сыворотку крови. Уровни тропонинов при этом могут повышаться в несколько сотен раз [8]. Отсюда можно сделать вывод, что кардиальные тропонины являются главными биомаркерами для диагностики острого инфаркта миокарда, дополняя клинические (симптомы боли в груди, одышка, учащенное сердцебиение, потливость потеря сознания и др.) и функциональные данные (электрокардиография, эхокардиография). Повышение сердечных тропонинов в сыворотке крови наряду с симптомами и ишемическими признаками электрокардиографии является основанием для постановки диагноза инфаркта миокарда и начала соответствующей терапии. Если рассматривать статью Чаули А.М. « сердечные тропонины как биомаркеры сердечно-сосудистых заболеваний», то стоит обратить внимание, что только после 2006 года введение в клиническую лабораторную практику иммуноанализов с повышенной аналитической чувствительностью (высокочувствительные (hs)-методы)) позволило выявить повышенные уровни cTnI и cTnT у пациентов с сердечными заболеваниями, отличными от инфаркта миокарда (ИМ), у пациентов с внесердечные заболевания (почечные, легочные и воспалительные заболевания) и даже у некоторых практически здоровых людей [22-26]. Кроме того, несколько исследований [27, 28], включая также два метаанализа и два обзора [29-32], продемонстрировали, что сердечно-сосудистый риск имеет тенденцию к увеличению также у некоторых практически здоровых людей обоего пола при для значениях cTn выше 99-го процентиля, который является пороговым значением, рекомендованным всеми международными рекомендациями по диагностике ИМ [33, 34]. Современная диагностическая классификация основных форм ОКС, основывающаяся на определении уровня Тн и данных ЭКГ, предусматривает разделение всех больных с ОКС на две основные группы: а) со стойкой элевацией сегмента ST б) без подъема сегмента ST. Выявление повышенного уровня одного из Тн у больных первой группы с несомненностью подтверждает ЭКГ-диагноз ИМ. Вторая группа пациентов с ОКС без подъема сегмента ST подразделяется на две категории: Тн-позитивные (со значениями концентрации Тн выше верхней границы «патологических» значений — сut off) с диагнозом ИМ и Тн-негативные (со значением концентрации Тн ниже границы «патологических» значений — сut off), диагностируемые как НС. Предлагаемый алгоритм может рассматриваться как основополагающий в современной диагностике ИМ и дифференциальной диагностике ИМ и НС. Тесты на тропонин были разработаны для того, чтобы избавиться от ложноположительных результатов, которые дает тест на КК МБ. Первый тест для определения циркулирующих cTnT имел предел нижний определения (НПО) - 500 нг/л. При этом для дифференциации между ИМ и нестабильной стенокардией использовались уровни в диапазоне, лежащие от 500 до 1000 нг/л [5]. Однако неожиданно обнаружилось, исследования обнаружили, что многие «КК МБ отрицательные пациенты» одновременно являются «тропонин - положительными». Действительно, от 12 до 39% лиц с отрицательным тестом на КК МБ, были «тропонин – положительными [6]. Проблема, являются ли в указанных случаях результаты теста КК МБ ложно отрицательными или тесты на тропонин ложно отрицательными была решена с помощью мета-анализов, которые четко показали, что пациенты с положительными тестами на тропонины (I или T) имеют высокий риск неблагоприятных кардиальных событий независимо от результатов тестов КК МБ [7,8]. В частности, в 2017 году Willeit et al. [30] выполнили метаанализ, включающий 28 исследований с 154 052 участниками. Значения cTnI, измеренные методами Architect (14 исследований) и Erenna (три исследования), были обнаружены у 82,6% людей, а значения cTnT - только у 69,7% (метод ECLIA, 11 исследований). В метаанализ были включены данные 10 рандомизированнх исследований ИТК в первой линии терапии EGFR – ассоциированного НМРЛ ( рис. 1 ). Характеристика представлена в табл. 1. 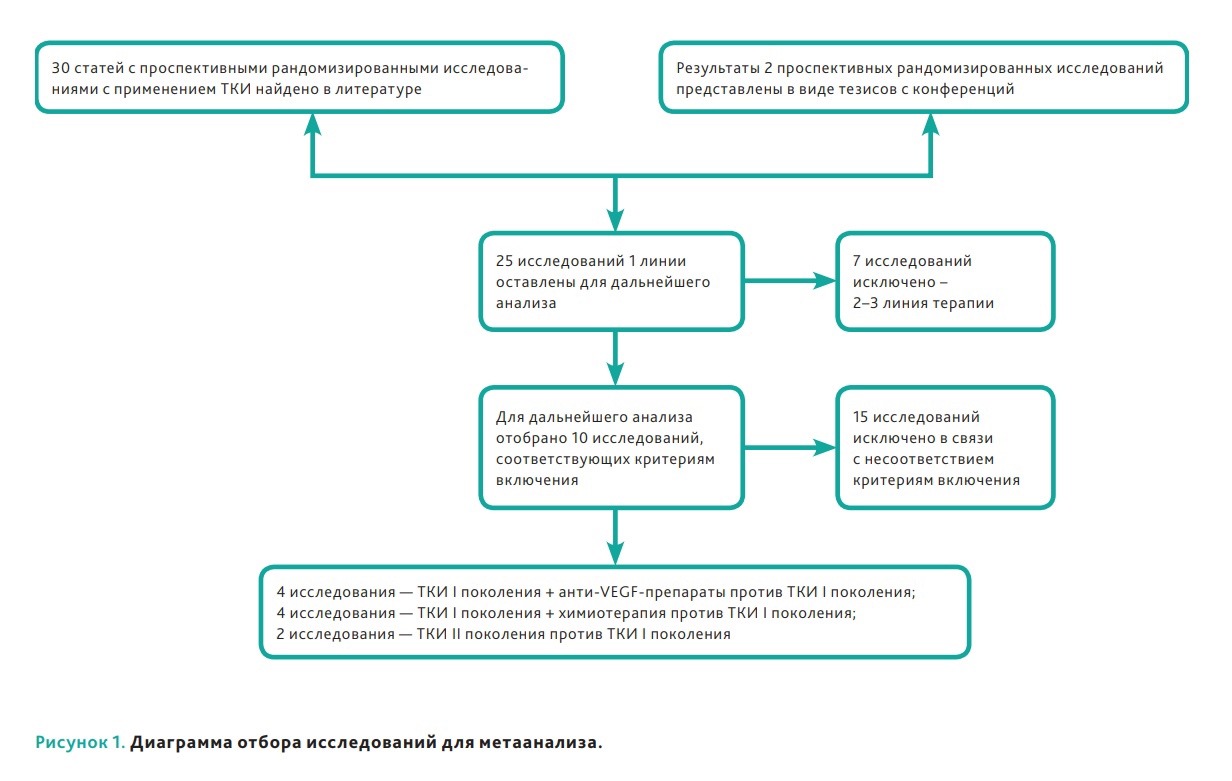 Рисунок 1. Диаграмма отбора исследований для метаанализа. 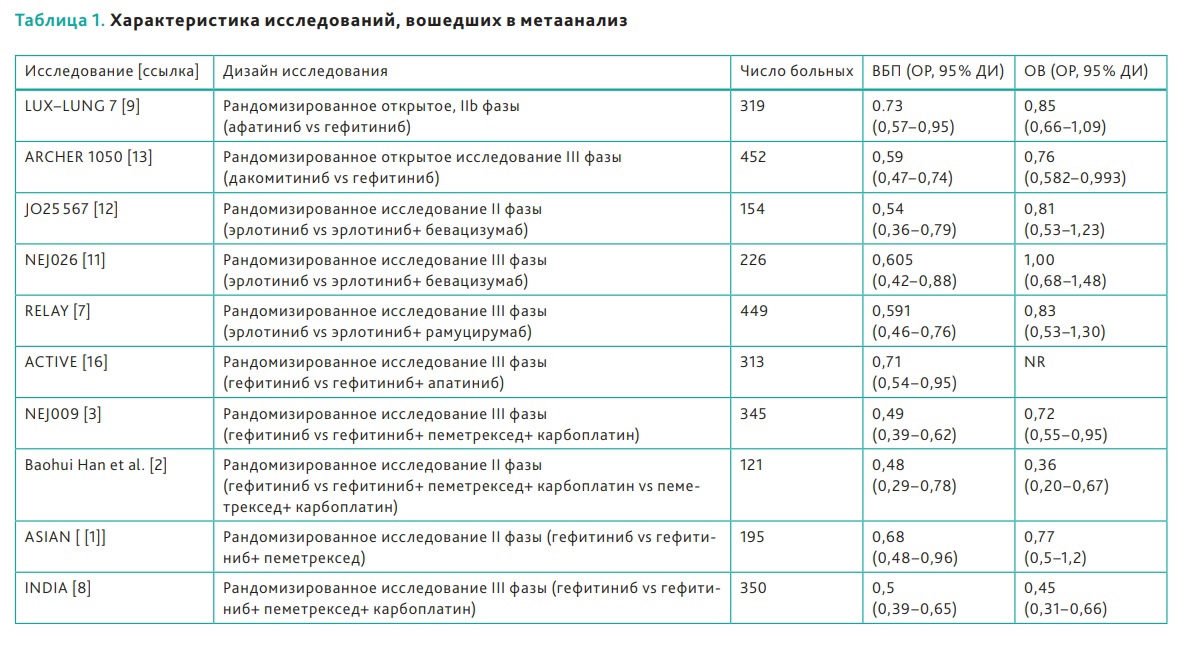 Таблица 1. Характеристика исследований, вошедших в метаанализ. hs-cTnI ZeptX System (Singulex) ультрачувствительный тест, основанный на детекции флуоресценции одиночных фотонов [20]. НПО - 0,2 нг/л, CV=10% - 1,8 нг/л, 99-ая перцентиль (у 88 здоровых лиц) - 7/нг/л (медианное значение) [21]. В дальнейшем, при обследовании 150 здоровых индивидов, значения для 99-ой перцентили составили - 10 нг/л Распределение индивидуальных значений в общей популяции – нормальное [22,23]. Затем, однако, были обнаружены вариации уровней тропонинов как кратковременные (часы) - в диапазоне от +46% до - 32%, так долговременные (8 недель) в диапазоне от +81% до – 45% [24]. Прототип метода hs-cTnI, Beckman Coulter. Обследованы 542 здоровых индивида (319 мужчин, возраст 59.9±I1.8 лет и 213 женщин, возраст 59,8 ±13,1. Нормальные уровни cTnl составляли 3,3 нг/л (CV= 10%) и 1,6 нг/л (CV = 20%). В целом, cTn качественно обнаруживался у >95% здоровых лиц и мог быть количественно оценен у 80% индивидов. Медианный уровень cTnl у здоровых лиц, старше 60 лет составлял 3,2 нг/л (99-ая перцентиль). Распределение уровней cTnI в популяции соответствовало нормальному (Гаусс), разницы между полами отмечено не было. Пограничный уровень для дискриминации между нормой и ОКС (нестабильная стенокардия или ИМ без элевации ST сегмента) составлял 6,4 нг/л, чувствительность 84% и специфичность 89,7%. При использовании cTnT с пограничным значением 30 нг/л, для диагностики ИМ чувствительность составляла 96,3%, а специфичность – 96,3%. Авторы заключили, что « hs-cTnl тест: 1) позволяет измерять концентрацию тропонина у здоровых лиц, 2) имеет большой потенциал для диагностики пациентов с подозреваемой миокардиальной ишемией и, 3) является предиктором неблагоприятных исходов при ОКС. Рис. 2.3 [25]. Access AccuTnI Beckman-Coulter. В исследовании PIVUS наблюдалось 1005 пожилых лиц, не имевших ССЗ. НПО - 0,006 мкг/л, (6 нг/л) уровни, соответствующие 99-ой перцентили находились в диапазоне 44 – 28 нг/л, см. Рис. 4, [26]. 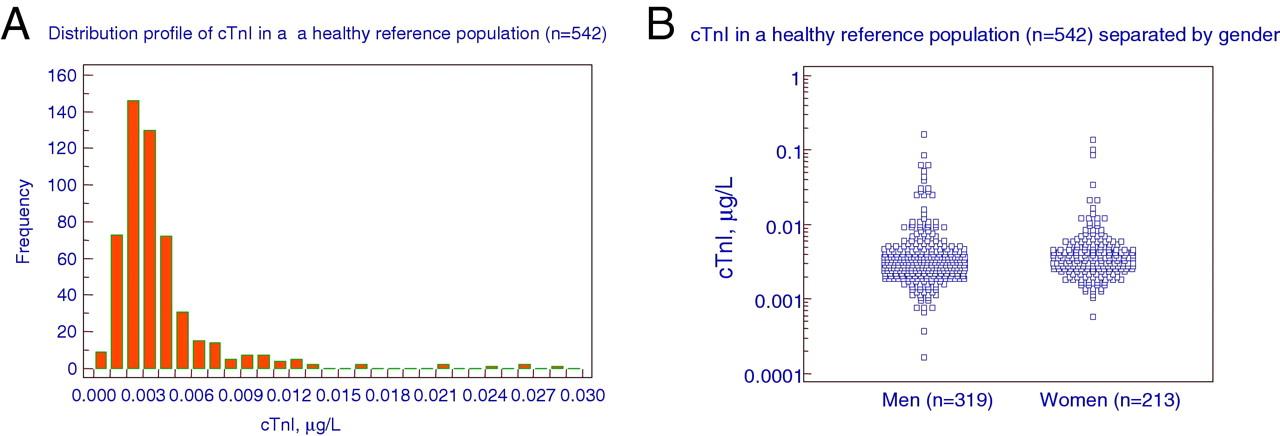 Рисунок 2. Значения концентрации cTnI в общей популяции. 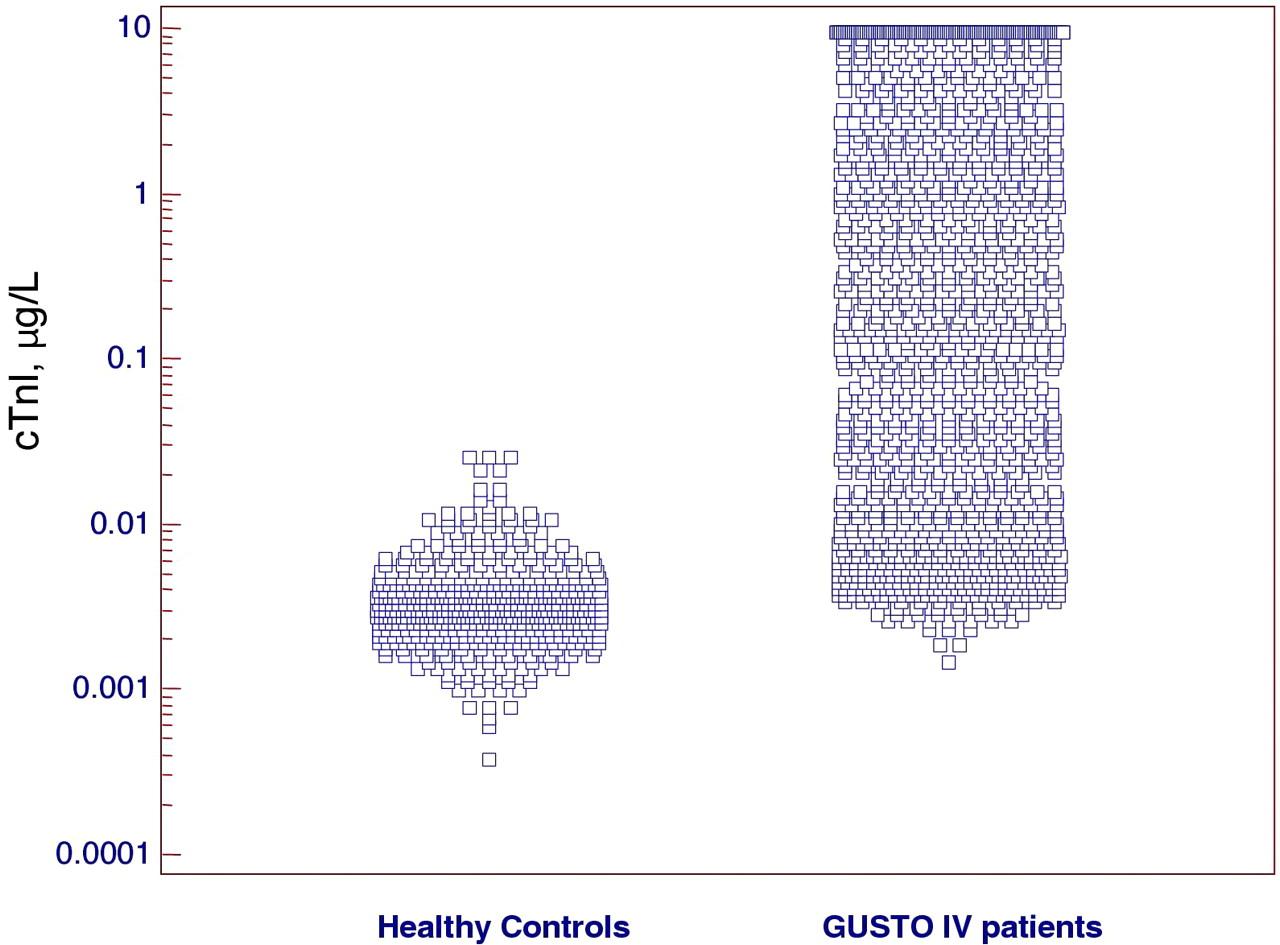 Рисунок.3. Значения концентрации cTnI в общей популяции и у пациентов с ОКС разной степени тяжести. 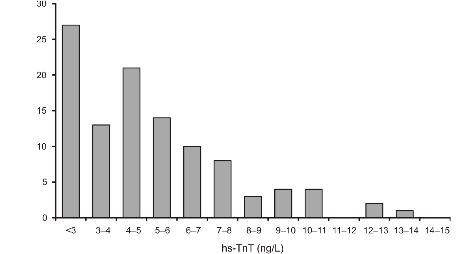 Рисунок 4. Значения концентрации cTnT в общей популяции Совсем недавно Welsh et al. [25] оценили распределение и связь между cTnT (измеренным методом ECLIA), cTnI (измеренным методом Architect) и другими сердечно-сосудистыми факторами риска в большой общей популяции (19 501 человек, возрастной диапазон: 18–98 лет). Обнаруживаемые концентрации cTnT и cTnI были выявлены у 10 395 участников (53,3%) и 14 579 (74,8%), соответственно. Женщины и молодые люди с большей вероятностью имели неопределяемую концентрацию cTns [35]. Более 50% женщин в возрастных группах ≤50–59 лет имели неопределяемый cTnT, а > 50% женщин в возрастных группах ≤30–39 лет имели неопределяемый cTnI [35]. Было выявлено 296 участников мужского пола (3,6%) и 897 участников женского пола (7,9%) с результатом cTnT выше рекомендованного 99-го процентиля (15,5 и 9,0 нг / л соответственно). Для cTnI 83 участника мужского пола (1,0%) и 115 участников женского пола (1,0%) были выше рекомендованного 99-го процентиля (34,2 и 15,6 нг / л соответственно) [35]. В среднем более высокие уровни тропонина чаще обнаруживались у пожилых людей с более высоким индексом массы тела (ИМТ), систолическим артериальным давлением и значениями креатинина, с сердечно-сосудистыми заболеваниями или диабетом в анамнезе и принимающими лекарства от холестерина [25]. В исследовании North-Trøndelag Health (HUNT) авторы измерили TnI с помощью метода Architect hs в когорте общей популяции, включающей 9005 участников. Прогностическая точность hs-TnI, оцененная с помощью C-статистики, была значительно выше, чем у стандартной модели, также включающей C-реактивный белок (0,753 против 0,644). Важно отметить, что тертиль с наивысшим риском показал пороговое значение 10 нг / л для женщин и 12 нг / л для мужчин, что является значением cTnI ниже 99-го процентиля. Marjot et al. [26] недавно сообщили, что высокочувствительные методы cTnI и cTnT способны обнаруживать повреждение сердца из-за некроза всего 40 мг миокарда, что эквивалентно 0,015% сердца, что достаточно для повышения концентрации в сыворотке выше 99-го перцентиля. Согласно этим данным, иммуноанализ cTn с пределом обнаружения менее 3 нг / л должен быть в состоянии измерить количество cTn, высвобождаемое от 6 до 8 мг ткани миокарда. Рассматривая эти данные в целом, некоторые авторы предположили, что уровни циркулирующего cTnI, измеренные с помощью высокочувствительных иммуноанализов, у здоровых взрослых людей можно рассматривать как надежную оценку риска развития ССЗ у в здоровой популяции. Более недавнее и более широкомасштабное исследование. 9698 пациентов, возраст от 54 до 74 лет, исходно ССЗ и ишемических инсультов не имели. Изучалась связь между повышенными уровнями hs cTnT и наличием сердечной недостаточности. Детектируемые уровни тропонина Т (≥0,003 мкг/л) обнаружены у 66,5%. После статистической обработки со всеми поправки оказалось, что у лиц с самыми высокими уровнями тропонина Т (≥0,014 мкг/л) по (сравнению с лицами с неопределяемыми уровнями тропонина) были повышены риски: 1) врожденных пороков сердца, отношение рисков – 2,29; 2) сердечной недостаточности - 5,95. 3) фатальных врожденных пороков сердца, отношение рисков - 7,59. Даже минимально повышенные уровни hs-cTnT (≥0,003 мкг/л) связано с повышенным риском сердечной недостаточности и смертности. Авторы делают вывод: «в общей популяции лиц, не имеющих известных врожденных пороков сердца и инсультов, уровни cTnT, детектируемые с помощью высокочувствительного определения, были связаны со случаями врожденных пороков сердца, смертностью и сердечной недостаточностью» (39). В целом, повышенные в общей популяции уровни hs-cTnT в большей степени связаны: 1) с повышенными рисками структурных патологий миокарда, 2) с сердечной недостаточностью, 3) с гипертрофией ЛЖ, 4) с кардиваскулярной и общей смертностью и, в меньшей степени, 5) с заболеваниями коронарных артерий и тяжестью атеросклероза (37). В научно-исследовательской статье Н.Г.Залевской «Современные методы лабораторного подтверждения инфаркта миокарда», автор приводит в пример современные методы диагностики инфаркта миокарда, где акцентирует свое внимание на важности определения уровня тропонинов в разны периоды ИМ. Лабораторное подтверждение острого инфаркта миокарда основано на выявлении неспецифических показателей тканевого некроза и воспалительной реакции миокарда, а также выявлении гиперферментемии, показателях миоглобина и тропонинов. Неспецифическая реакция организма на возникновение острого инфаркта миокарда связана с распадом мышечных волокон, всасыванием продуктов расщепления белков в кровь, местным асептическим воспалением сердечной мышцы. Основными клинико-лабораторными признаками, отражающими эти процессы, являются: повышение температуры тела от субфебрильных цифр до 38,5–390С (выявляется к концу первых суток от начала заболевания и при неослождённом течении инфаркта сохраняется в течение недели); проявлением неспецифической реактивности организма в ответ на повреждение миокарда является полиморфноклеточный лейкоцитоз, который возникает в течение нескольких часов после появления ангинозной боли и сохраняется в течение 3–7 суток и часто достигает значений 12–15х109/л; сдвиг лейкоцитарной формулы крови влево, за счёт палочкоядерных нейтрофилов, анэозинофилия; СОЭ увеличивается обычно спустя несколько дней от начала заболевания и может оставаться повышенной на протяжении 2–3 недель. Нормализация показателей периферической крови происходит в разное время, в зависимости от объема и степени ишемического поражения, а также от реактивности и состояния компенсаторных резервов организма пациента. Однако количество лейкоцитов снижается быстрее (к началу второй недели), тогда как СОЭ нормализуется в течение 3–4 недель. Автор статьи доказывает: 1. Лабораторными признаками неблагоприятного прогноза ИМ являются: лей- коцитоз выше 15х109/л; отсутствие снижения СОЭ после 10 дней; нейтрофилёз с выра- женным сдвигом влево; устойчивый повышенный уровень С-реактивного белка и фибриногена; гиперферментемия АсАТ более 7 суток; гиперферментемия ЛДГ более 2 недель; гиперферментемия КК более 7 суток; повышение КК более чем в 10 раз в 1–2 су- тки; гиперферментемия КК-МВ более 5 суток, повышение КК-МВ более чем в 20 раз в первые сутки; гиперферментемия ГГТ более 1,5 месяца; гипермиглобинемия в первые сутки; выраженный метаболический ацидоз (ВЕ<-10); наличие лабораторных признаков формирования ДВС синдрома. 2. У пациентов, поступивших в течение первых 24 часов после ангинозного приступа, проводится определение активности КК в крови – это следует делать даже в тех случаях, когда по клиническим и ЭКГ данным диагноз ИМ не вызывает сомнения, так как степень повышения активности КК информирует врача о размерах ИМ и прогнозе. 3. Если активность КК находится в пределах нормы или повышена незначительно (в 2–3 раза), либо у пациента имеются явные признаки поражения скелетной мускулатуры или головного мозга, то для уточнения диагноза показано определение активности МВ-КК. 4. Нормальные величины активности КК и МВ-КК, полученные при однократном заборе крови в момент поступления больного в стационар, недостаточны для исключения диагноза острого ИМ. Анализ необходимо повторить хотя бы ещё 2 раза через 12 и 24 часа. 5. Если больной поступил более чем через 24 часа после ангинозного приступа, но меньше чем через 2 недели, и уровень КК и МВ-КК нормальный, то целесообразно определить активность ЛДГ1, АсАТ вместе с АлАТ и расчётом коэффициента Ритиса. 6. Если ангинозные боли повторяются у больного после госпитализации, то рекомендуется измерять КК и МВ-КК сразу после приступа и через 12 и 24 часа. 7. Миоглобин в крови целесообразно определять только в первые часы после болевого приступа, повышение его уровня в 10 раз и больше указывает на некроз мышечных клеток, однако нормальный̆ уровень миоглобина отнюдь не исключает ИМ. 8. Определение КК, ЛДГ нецелесообразно у бессимптомных больных с нор- мальной ЭКГ, диагноз на основании одной только гиперферментемии ставить нельзя, должны быть клинические и (или) электрокардиографические признаки, указывающие на возможность ИМ. 9. Контроль количества лейкоцитов и величины СОЭ необходимо проводить при поступлении пациента и затем не реже 1 раза в неделю, чтобы не пропустить инфекционные или аутоиммунные осложнения острого ИМ. 10. Исследование уровня активности КК и МВ-КК целесообразно проводить только в течение 1–2 суток от предположительного начала заболевания. 11. Исследование уровня активности АсАТ целесообразно проводить только в течение 4–7 суток от предположительного начала заболевания. 12. Лабораторно-диагностический приоритет определения тропонина в крови не снижает значимости исследования других маркёров. В частности, при недоступности исследования кардиальных изоформ тропонина лучшей альтернативой этому диагностическому методу является количественное определение изофермента МВ-КК, а при необходимости ранней лабораторной диагностики острого ИМ может также исследоваться динамика изменений уровня миоглобина. Также подчеркнув данных трудов Велькова В.В. следует, что главное преимущество hs-cTn – тестов – раннее, в первые часы после начала сердечного приступа выявление ИМ. Именно этим высокочувствительные тропонины будут «спасать жизни» [1,2,16-18]. Можно ли доверять этим утверждениям? 103 пациента, поступивших с болевым синдромом, исходно согласно «обычному» тропонину (99-ая перцентиль - 0,10 нг/мл) все были «тропонин-отрицательными», однако «с точки зрения» hs-cTnI (99-ая перцентиль – 0,04 нг/л) «тропонин-положительными» были 64,1% пациентов. Через 6 ч количество «cTnI положительных» составило 16%, «hs-cTnI положительных» - 62%, через 12 ч - 56% и 82%, через 24 ч - 80% и 97% соответственно, см. Рис. 5. Авторы делают вывод, что «hs-cTnI имеет наилучшую диагностическую точность и потенциал выявлять повреждения миокарда раньше, чем текущие cTnI тесты» 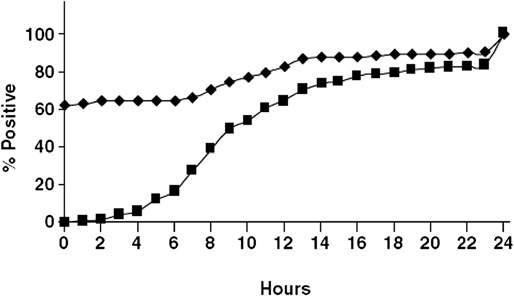 Рисунок 5. Динамика «тропонин положительных» диагнозов при развитии ОКС. Уровни hs-cTnI > 0,04 нг/л – ромбы, уровни cTnI > 0,10 нг/мл квадраты. 371 пациент, поступили с подозрением на ОКС, hs-cTnI (99-ая перцентиль – 0,04 мкг/л) измеряли при поступлении и через 6 и 24 ч. Наблюдение – 60 дней. ИМ окончательно установлен у 49 больных (13%). Чувствительность и специфичность hs- cTnI составляли при поступлении 74% и 84% соответственно и 94% и 81% в последствии. За время наблюдения у 59 пациентов были зафиксированы: кардиальных смерти – 2, не кардиальная смерть – 1,49 случаев ИМ, 7 случаев аорото-коронарного шунтирования (АКШ), 36 случаев чрезкожного коронарного вмешательства. У больных с hs-cTnI < 0,006 мкг/л количество указанных событий составляло 2,8%; в группе с hs-cTnI - 0,006-0,04 мкг/л –11,1%, в группе с hs-cTnI >0,04-0,10 мкг/л - 24,1% и с hs-cTnI >0,10 мкг/л – 55,1%. Авторы заключают: «hs-cTnI – это чувствительный ранний биомаркер ИМ и независимый предиктор неблагоприятных исходов у любых пациентов с симптомами ОКС и измеряемыми уровнями hs- cTnI» [15]. 290 пациентов поступили с симптомами кардиальной ишемии, 120 лиц в контрольной группе, hs-cTnI (НПО - 2,06 нг/л, CV 20% - 2,95 нг/л, CV 10% - 8,66 нг/л). Измерение при поступлении hs-cTnI привело к 81% положительных диагнозов, определение «обычного» cTnI - к 62% [16]. 1503 пациента, поступивших с нестабильной стенокардией или с ИМ Б ST, контрольная группа – 542 индивида. hs-cTnT, НПО при CV-10% - 0,0033 мкг/л и при CV- 20% - 0,00-16 мкг/л соответственно. hs-cTnT обнаруживался у >95% здоровых лиц (возраст < 60 лет) и составлял (медианный уровень) 0,0032 мкг/л (0,0011 - 0,0079), при 99-ой перцентили – 0,011 мкг/л. Пограничный уровень для дискриманации между здоровыми индивидами и пациентами с ИМ Б ST - 0,0064 мкг/л, чувствительность – 84,8% и специфичность – 89,7% (25). 718 пациентов поступивших с ОИМ. hs-cTn определяли с помощью тестов Abbott-Architect Troponin I, Roche High-Sensitive Troponin T, Roche Troponin I, Siemens Troponin I Ultra и стандартным тестом Roche Troponin T. Окончательный диагноз ОИМ был установлен для 123 (17%) пациентов. Значения AUC ROC для hs-cTn тестов составляли: для Abbott-Architect Troponin I, - 0.96; для Roche High-Sensitive Troponin T - 0.96; для Roche Troponin I,- 0.95; для Siemens Troponin I Ultra - 0.96 против 0.90 стандартного теста Roche Troponin. Среди пациентов, которые поступили в течение трех часов после начала болевого синдрома, значения AUC для hs- cTn тестов составляли от 0.93 против 0,76 для стандартного теста. Авторы полагают, что «диагностическая точность высокочувствительных тестов на тропонин является отличной и эти тесты смогут существенно улучшить раннюю диагностику ОИМ, в особенности у пациентов со свежим развитием болевого синдрома» [17]. 377 пациентов (средний возраст 54 года), сердечная боль. Подозрение на ОКС. hs-cTnT измеряли (99-ая перцентиль, 13 пг/мл) при поступлении, КТА проводили через 4 ч. Оказалось, ОКС имели 37 (9,8%) пациентов. Специфичность и чувствительность hs- cTnT для ранней диагностики ОКС составляли 62% и 89% соответственно, положительное предиктивное значение - 38%, отрицательное – 96%. По сравнению с «обычным» тестом на cTnT, hs-cTnT выявлял пациентов с ОКС на 27% больше. В целом, уровни hs-cTnT выше 99-ой перцентили были сильным предиктором ОКС, отношение рисков - 9,0. Данные КТА показали, что повышенные уровни hs-cTnT связаны со многими факторами, включающими: наличие и тяжесть ЗКА, массу ЛЖ, фракцию выбора ЛЖ и дисфункцию ЛЖ. Авторы полагают, что: «среди пациентов с сердечной болью, имеющих риск ОКС от низкого до умеренного, hs-cTnT обеспечивает хорошую чувствительность и специфичность по отношению к ОКС. Повышение hs-cTnT выявляет пациентов с повреждениями миокарда и со значительными структурными заболеваниями сердца и притом, безотносительно к диагнозу ОКС» [18]. 137 пациентов (возраст 66±16 лет), поступили с острой сердечной болью. Окончательный диагноз ОИМ проводился как «обычным» cTnT (99-ая перцентиль ≥ 0,04 мкг/л), так и hs-cTnT (99-ая перцентиль ≥0,014 мкг/л). Оказалось, hs-cTnT диагностировал ОИМ у 30 пациентов, а обычный – у 20 (повышение на 75%), при этом количество пациентов, с диагностируемой нестабильной стенокардией или с сердечной болью, не кардиальной этиологии значительно уменьшилось. Уровни hs-cTnT ниже НПО (<0,003 мкг/л) имели отрицательное предиктивное значение для исключения ОИМ, равное 100%. Количество сердечно-сосудистых событий в течение 6 месяцев у пациентов с hs- cTnT <0,014 мкг/л было низким, а у пациентов с cTnT ≥ 0,04 мкг/л – высоким. Самый высоким риск неблагоприятных событий был у пациентов с положительной динамикой изменения, повышение hs-cTnT>30%. Авторы делают вывод: «внедрение высоко- чувствительного измерения имеет отличные диагностические характеристики при использовании для пациентов с началом развития сердечной боли. Даже малое повышение hs-cTnT указывает на риск смерти от ОИМ» [19]. 4513 пациентов, поступивших с ОКС Б ST, измеряли сTnI-Ultra, 99-ая перцентиль - 0,04 мкг/л, 99-ая перцентиль - 0,1 мкг/л. Пациенты с исходным уровнем cTnI > или =0.04мкг/л (n = 2924) имели в течение 30 дней, высокий риск летальности или ОИМ (6,1%), а пациенты с cTnI < 0.04мкг/л – меньший - 2,0%. В целом, в данном исследовании уровни Ultra-cTnI > или=0.04 мкг/л были связаны с трехкратным повышением риска летальности или ОИМ в течение 30-ти дней. И более того, даже пациенты с небольшим повышением cTn (от 0,04 к < 0,1 мкг/л) имели значительно повышенный риск смерти или ИМ в течение 30 дней (5 % против 2,4%) и смерти в течение 12 месяцев, 6,4% против 2,4% [60]. 1452 пациентов, поступивших с ОКС, измеряли как hs-cTnT, так и «обычный». Оценивали риск смерти в течение 1 года. Показано, что: 1) 60 % пациентов имели уровни выше пограничных значений для обоих тестов, у них риск летальности составлял – 10,7%; 2) 16% имели повышенный hs-cTnT и нормальный cTnT – риск общей смертности - 9,2%; 3) 24% пациентов с низкими уровнями обоих тропонинов имели риск смерти от всех причин, составлявший 2,6%. Риски смерти от ОИМ или от всех причин в течение 30 дней: 1) оба тропонина повышены – 8,7%, 2) повышен только hs-cTnT – 5,2%; 3) оба понижены - 2,4%. Авторы полагают, что «новое hs-cTnT измерение по сравнению со старым тестом на cTnT, выявляет большее количество пациентов с повреждением миокарда, имеющих повышенный риск новых кардиальных событий» [21]. 233 пациента, сердечная боль, повышения ST-сегмента нет. Тропонины: 1) hs- cTnT Roche, пограничный уровень ≥ 14 нг/л) и обычные; 2) Roche troponin T, 4- поколение, пограничный уровень ≥ 0,04 г/л и 3) Beckman Coulter Accu-TnI, пограничный уровень ≥ 0,06 г/л измеряли при поступлении и через 2 ч. Для диагноза ОИМ применяли следующие указанные значения пограничных уровней. Оказалось, по отношению к диагностике ОИМ эффективность тестов была следующей: 1) hs-cTnT – при поступлении: чувствительность – 98%, специфичность – 82%, через 2 ч – 100% и 79% соответственно; 2) cTnT – при поступлении: чувствительность – 70%: специфичность – 91%, через 2 ч – 77% и 89% соответственно: 3) cTnI – при поступлении: чувствительность – 80%: специфичность – 92%, через 2 ч – 86% и 91% соответственно. Авторы считают, что «по сравнению с «обычными» тропониновыми тестами использование hs-cTnT, улучшает точность ранней диагностики ОИМ. С помощью измерения hs-cTnT ОИМ можно исключить уже в первые часы после поступления» [22]. 332 пациента, поступили с подозрением на ОКС. Наблюдение – 2 года. Тропонины измеряли с помощью следующих тестов: 1) Roche Elecsys hsTnT, 2) Abbott Architect cTnI3 и 3) Roche Elecsys TnT. Регистрировали основные неблагоприятные кардиоваскулярные исходы: смерть, не фатальные ИМ, реваскуляризацию. В течение 30 дней после поступления неблагоприятные исходы произошли у 14 пациентов. Исходные уровни выявляли таких пациентов следующим образом: 1) hs-cTnT выявил 11 таких больных (78,6%), 2) cTnI3 - 10 (71,4%), и 3) сTnT - 10 (71,4%). В течение двух лет неблагоприятные исходы имели место у 68 (20,5%) больных. Таких пациентов исходные уровни тропонинов выявляли следующим образом: 1) hs-сTnT вывил 43 больных (63,2%), 2) cTnI3 – 34(50,0%) и 3) сTnT - 29(42,6%). Авторы считают, что у пациентов, поступивших с подозрением на ОКС «hs-cTnT превосходит cTnT по своей способности предсказывать неблагоприятные кардиоваскулярные исходы в течение двух лет. Лица, с уровнями hs cTnT ниже предела определения относятся к группе пациентов с очень низким уровнем неблагоприятных исходов» [23]. 2506 пациентов, поступивших с подозрением на ОКС. Наблюдение 6 мес. При поступлении однократное измерение hs-cTnT и cTnT. Особенно высокую диагностическую и прогностическую эффективность hs-cTnT имел у «обычных тропонин- отрицательных» пациентов. Авторы полагают: «измерение hs-cTnT дает лучшую диагностическую и прогностическую информацию и поэтому должно быть внедрено в рутинную клиническую практику в качестве стандартного теста» [24]. 447 пациентов, поступивших с ОКС Б ST, наблюдение 4 года. Измерение hs-cTnT привело к повышению количество пациентов с ИМ Б ST на 33% (с 201 до 268). Пациенты (67 лиц), диагноз которых был изменен от нестабильной стенокардии к ИМ Б ST имели такую же смертность в течение 4 лет (25,1%) как и пациенты с исходно диагностированным ИМ Б ST (23,6%). Авторы считают, что «применение hs-cTnT вместо cTnT повышает долю пациентов с ИМ Б ST среди пациентов с ОКС Б ST и значительно улучшает стратификацию риска смертности в течение 4 лет» [25]. Многоцентровое исследование, 1098 пациентов (37% из них старше 70 лет). Диагноз ОИМ установлен у 24% пациентов. Среди пожилых пациентов без ОИМ уровни hs-cTnT были повышены у 51%, уровни TnI-Ultra Siemens были повышены у 17%, уровни cTnI Abbott-Architect – у 13% . Пограничные уровни для диагностики ОИМ у пожилых пациентов составляли: 1) Roche hs-TnT Roche (99-ая перцентиль, - 0.014 мкг/л) - 0,054 мкг/л, 2) TnI-Ultra Siemens ( 99-ая перценитль -0,040 мкг/л) – 0,045 мкг/л, 3) cTnI Abbott- Architect (99-ая перцентиль, 0,028 мкг/л) – 0,032 мкг/л. Авторы заключают, что «высокочувствительные измерения тропонинов имеют высокую диагностическую точность так же и для пожилых лиц. Мягкое повышение тропонинов является обычным для пожилых пациентов, не имеющих ОИМ, поэтому оптимальные пограничные уровни высокочувствительных тропонинов для пожилых пациентов, должны быть существенно выше, чем для более молодых» [26]. Заключение Результаты проведенных ранее контролируемых клиннических испытаний позволяют утвержать, что кардиальные тропонины являются важными регуляторами сократительной функции миокарда, а незначительные их мутации вызывают развитие кардиомиопатий. Кардиальные тропонины являются ценными диагностическими биомаркерами для диагностики острого инфаркта миокарда, миокардита, сердечной недостаточности. Дальнейшее изучение фундаментальных биохимических аспектов сердечных тропонинов является важным направлением для улучшения лечебно–диагностических стратегий при сердечно–сосудистых заболеваниях. Была доказана высокая эффективность сердечных тропонинов при идентификации ИМ, миокардии, СН. По мнению некоторых авторов: «измерение hs-cTnT дает лучшую диагностическую и прогностическую информацию и поэтому должно быть внедрено в рутинную клиническую практику в качестве стандартного теста». Авторы заключают, что «высокочувствительные измерения тропонинов имеют высокую диагностическую точность так же и для пожилых лиц. Мягкое повышение тропонинов является обычным для пожилых пациентов, не имеющих ОИМ, поэтому оптимальные пограничные уровни высокочувствительных тропонинов для пожилых пациентов, должны быть существенно выше, чем для более молодых» Также стоит подчеркнуть выше упомянутые выводы Н.Г. Залевской автора статьи « Современные методы лабораторного подтверждения ИМ», что у пациентов, поступивших в течение первых 24 часов после ангинозного при- ступа, проводится определение активности КК в крови – это следует делать даже в тех случаях, когда по клиническим и ЭКГ данным диагноз ИМ не вызывает сомнения, так как степень повышения активности КК информирует врача о размерах ИМ и прогнозе. В целом, значение повышенных уровней hs-cTn можно суммировать так: 1) в общей популяции hs-cTn выявляет лиц с повышенным риском структурных заболеваний миокарда и риском смертности от всех причин, 2) короткий период ишемии, не связанный с явным ИМ, вызывает высвобождение небольшого количества hs-cTn, 3) при стабильных заболеваниях коронарных артерий, уровни hs-cTn связаны с риском кардиоваскулярной смерти и сердечной недостаточности, но не с риском ИМ, 4) у пациентов с симптомами ОКС hs-cTn – это ранний маркер ИМ, который, по сравнению со «стандартным cTn», выявляет большее количество пациентов с повреждением миокарда и является независимым предиктором неблагоприятных исходов, 5) с помощью серийного измерения hs-cTn диагноз ИМ можно исключить уже в первые часы после поступления, 6) для диагностики ИМ абсолютные значения динамики концентрации hs-cTn имеют более высокую точность, чем относительные значения, 7) повышенные после ОКС уровни hs-cTn преимущественно связаны с дисфункцией ЛЖ, 8) снижение hs-cTnT связано со снижением морбидности и смертности. 9) отсутствие необходимости измерения других кардиальных биомаркеров. Список литературы: 1.Чаулин А. М., Карслян Л. С., Дупляков Д. В. Некоронарогенные причины повышения тропонинов в клинической практике // Клиническая практика. 2019. Т. 10. No4. C. 81-93. https://doi.org/10.17816/clinpract16309 2. Takeda S., Yamashita A., Maeda K., Maéda Y. Structure of the core domain of human cardiac troponin in the Ca 2+-saturated form // Nature. 2003. V. 424. No6944. P. 35-41. https://doi.org/10.1038/nature01780 3. Dhoot G. K., Gell P. G., Perry S. V. The localization of the different forms of troponin I in skeletal and cardiac muscle cells. 1978. https://doi.org/10.1016/0014-4827(78)90149-0 4. Чаулин А. М., Карслян Л. С., Григорьева Е. В., Нурбалтаева Д. А., Дупляков Д. В. Особенности метаболизма сердечных тропонинов (обзор литературы) // Комплексные проблемы сердечно-сосудистых заболеваний. 2019. Т. 8. No4. C. 103-115. https://doi.org/10.17802/2306-1278-2019-8-4-103-115 5. Dhoot G. K., Perry S. V. Distribution of polymorphic forms of troponin components and tropomyosin in skeletal muscle // Nature. 1979. V. 278. No5706. P. 714-718. https://doi.org/10.1038/278714a0 6. Филатов В. Л., Катруха А. Г., Буларгина Т. В. и др. Тропонин: строение, свойства и механизм функционирования // Биохимия. 1999. Т. 64. No9. C. 1115-1174. 7. Schreier T., Kedes L., Gahlmann R. Cloning, structural analysis, and expression of the human slow twitch skeletal muscle/cardiac troponin C gene // Journal of Biological Chemistry. 1990. V. 265. No34. P. 21247-21253. http://www.jbc.org/content/265/34/21247 8. Чаулин А. М., Карслян Л. С., Григорьева Е. В., Нурбалтаева Д. А., Дупляков Д. В. Клинико-диагностическая ценность кардиомаркеров в биологических жидкостях человека // Кардиология. 2019. Т. 59. No11. С. 66-75. https://doi.org/10.18087/cardio.2019.11.n414 9. Чаулин А. М., Карслян Л. С., Нурбалтаев Д. А., Григорьев Е. В., Дупляков Д. В. Метаболизм кардиальных тропонинов в нормальных и патологических условиях // Сибирское медицинское обозрение. 2019. No6. P. 5-14. https://doi.org/10.20333/2500136-2019- 6-5-14 10. Bhavsar P. K., Brand N. J., Yacoub M. H., Barton P. J. Isolation and characterization of the human cardiac troponin I gene (TNNI3) // Genomics. 1996. V. 35. No1. P. 11-23. https://doi.org/10.1006/geno.1996.0317 11. Schiaffino S., Gorza L., Ausoni S. Troponin isoform switching in the developing heart and its functional consequences // Trends in cardiovascular medicine. 1993. V. 3. No1. P. 12-17. https://doi.org/10.1016/1050-1738(93)90022-X 12. Sasse S., Brand N. J., Kyprianou P., Dhoot G. K., Wade R., Arai M., Barton P. J. et al. Troponin I gene expression during human cardiac development and in end-stage heart failure // Circulation research. 1993. V. 72. No5. P. 932-938. https://doi.org/10.1161/01.RES.72.5.932 13. Perry S. V. Troponin T: genetics, properties and function // Journal of Muscle Research & Cell Motility. 1998. V. 19. No6. P. 575-602. https://doi.org/10.1023/A:1005397501968 14. Breitbart R. E., Nguyen H. T., Medford R. M., Destree A. T., Mahdavi V., Nadal-Ginard B. Intricate combinatorial patterns of exon splicing generate multiple regulated troponin T isoforms from a single gene // Cell. 1985. V. 41. No1. P. 67-82. https://doi.org/10.1016/0092-8674(85)90062- 5 15. Solaro R. J., Powers F. M., Gao L., Gwathmey J. K. Adaptive and Maladaptive Processes: Control of Myofilament Activation in Heart Failure // Circulation. 1993. V. 87. No6S. P. 38-43. 16. Anderson P. A., Greig A., Mark T. M., Malouf N. N., Oakeley A. E., Ungerleider R. M., Kay B. K. Molecular basis of human cardiac troponin T isoforms expressed in the developing, adult, and failing heart // Circulation research. 1995. V. 76. No4. P. 681-686. https://doi.org/10.1161/01.RES.76.4.681 17. Дупляков Д. В., Чаулин А. М. Мутации сердечных тропонинов, ассоциированные с кардиомиопатиями // Кардиология: новости, мнения, обучение. 2019. Т. 7. No3. С. 8-17. https://doi.org/10.24411/2309-1908-2019-13001 18.Чаулин А. М., Григорьева Ю. В., Дупляков Д. В. Участие катехоламинов в патогенезе диабетической кардиомиопатии // Медицина в Кузбассе. 2020. No1. С. 11-18. https://10.24411/2687-0053-2020-10003. 19.Чаулин А. М., Дупляков Д. В. Повышение кардиальных тропонинов, не ассоциированное с острым коронарным синдромом. Часть 1 // Кардиология: новости, мнения, обучение. 2019. Т. 7. No2. С. 13-23. https://10.24411/2309-1908-2019-12002. 20.Чаулин А. М., Дупляков Д. В. Повышение кардиальных тропонинов, не ассоциированное с острым коронарным синдромом. Часть 2 // Кардиология: новости, мнения, обучение. 2019. Т. 7. No 2. С. 24-35. https://10.24411/2309-1908-2019-12003 21. Чаулин А. М., Милютин И. Н., Тимофеев Н. В., Дупляков Д. В. Некоронарогенные причины повышения сердечных тропонинов в практике врача (литературный обзор) // Вестник медицинского института «РЕАВИЗ». 2019. No5 (41). С. 201-214. 22. Thygesen K., Alpert J. S., Jaffe A. S., Chaitman B. R., Bax J. J., Morrow D. A., White H. D. Fourth universal definition of myocardial infarction (2018) // Journal of the American College of Cardiology. 2018. V. 72. No18. P. 2231-2264. https://10.1016/j.jacc.2018.08.1038 23. Чаулин А. М., Мазаев А. Ю., Григорьева Е. В., Нурбалтаева Д. А., Александров А. Г. Клинико-диагностическое значение определения кардиальных тропонинов в крови при сепсисе и септическом шоке (обзор литературы) // Евразийское Научное Объединение. 2019. No2-2. С. 113-116. 24. Soongswang J., Durongpisitkul K., Nana A., Laohaprasittiporn D., Kangkagate C., Punlee K., Limpimwong N. Cardiac troponin T: a marker in the diagnosis of acute myocarditis in children // Pediatric cardiology. 2015. V. 26. No1. P. 45-49. https://doi.org/10.1007/s00246-004-0677-6 25. Bessière F., Khenifer S., Dubourg J., Durieu I., Lega J. C Prognostic value of troponins in sepsis: a meta-analysis // Intensive care medicine. 2013. V. 39. No7. P. 1181-1189. 26. Смолянинов, А.Б. Клинико-лабораторная и функциональная диагностика внутрен- них болезней / А.Б.Смолянинов. – СПб: СпецЛит, 2012. – 143 с. |
