концентрация. 1. Концентрации (1). Не посвящается никому. Ибо нефиг. Предисловие
 Скачать 211.71 Kb. Скачать 211.71 Kb.
|
|
Не посвящается никому. Ибо нефиг. Предисловие. Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты. Тема специфична. Требуются навыки счёта, желательно в уме, но можно и на калькуляторе, главное быстро. Поскольку навыки счёта у студента РНИМУ, как правило, прокачаны плохо, будет сложно. Дорогой любитель химии, обрати пристальнейшее внимание на введение. Приведенные формулы желательно выучить. Не то, чтобы они такие уж необходимые, просто так намного легче решить тест. Вначале мы изложили основную концепцию, дальше разобрали кучу примеров. Примеры были нами разделены на разновидности, в соотвествии нашими представлениями о типах задач. На каждый вид вопросов мы постарались дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь представляем свой труд для использования широкой общественностью, надеюсь, наше творение сможет послужить к чьей-нибудь пользе. Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно. Удачи, ни пуха, ни пера, дорогие любители химии. Алексей «Леша-химик» Федоров, 11.08.2017.-05.09.2018 Тема 1. Способы выражения концентрации растворов. Введение: Договоримся об основных понятиях. Раствор — система, состоящая из растворенного вещества и растворителя. Растворенным веществом может быть что угодно (соль, сахар, мочевина, кислота, щелочь и так далее). Растворителем всегда будет вода. Следует отличать растворитель и растворенное вещество! У них разные массы и моли, да и вообще, это разные вещества. Тест по этой теме по большей части состоит из задач. Для успешной сдачи теста требуется: Уметь читать и понимать (!) условия задач. Это самое сложное, как нам кажется. Знать формулы, понимать, что означают буквы в них Уметь математику. Запасите калькулятор. Успокойтесь, дышите глубже. П Ху = 100500*10 = 1005000 хуиты Ху = 100500*10 = 1005000 хуиты редполагается, что читать и считать более-менее вы умеете, а научить понимать условия мы не можем. Поэтому остановимся более подробно на формулах. Обратите внимание на размерности, граммы, литры и т. д. Это важно. Доступны следующие формулы: Массовая доля 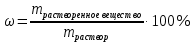 Здесь ω – массовая доля в % mрастворенное вещество — масса растворенного вещества, в граммах mраствор — масса раствора (неожиданно, правда?), в граммах. Это разные массы, блять! 100% = 100 Формула имеет вариацию 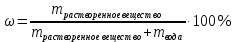 mвода — масса воды (какая неожиданность), тоже в граммах. Не забывайте переводить всё в граммы! Молярная концентрация 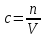 Здесь с — молярная концентрация (также называется молярность), выраженная в моль/литр. Может использоваться обозначение М, например с = 0,01 моль/л, то же самое, что с = 0,01 М (читать как молярность равна 0,01 моль на литр). n — количество молей растворенного вещества, выраженное в моль. V — объем раствора, выраженный в литрах. Внимание! Должны быть именно литры. Если в условиях даны миллилитры, то надо переводить. Для этого цифру в мл делят на 1000, например 500 мл = 0,5 литра. Моляльность 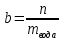 Здесь b — моляльность, выраженная в моль/кг n — количество моль растворенного вещества mвода — масса воды, в килограммах. Внимание! Именно килограммы, если даны граммы, то нужно переводить. Перевод аналогичен мл-литры. Олдскульные формулы Разговор о формулах будет неполным, если мы не приведем еще школьные формулы, а то вдруг кто-то не помнит. Моли через массу 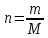 Здесь n — количество молей, моль m — масса любого вещества, в граммах. Обычно имеется в виду растворенное вещество. M — молярная масса этого же вещества Моли через объем (внимание! Только для газов) 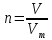 Здесь n — количество молей, моль V — объем газа, в литрах. Внимание! Только объём газа! Объем раствора не вставлять!!! Vm — молярный объем, 22,4 литра/моль, константа, короче. Масса раствора через объем и плотность  Здесь mраствор — масса раствора (неожиданно, правда?), в граммах. V — объем раствора в мл. ρ — плотность, в граммах/мл., эта странная загогулина читается как буква «ро». Преобразования Отдельно рассмотрим вопрос, что делать, когда из формулы надо что-то выразить. Например, из формулы 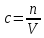 надо выразить V, объем. В таком случае нам кажется удобным использовать способ, предложенный одной блондинкой. Мысленно заменим буквы на цифры n=6, V=3 и c=2: надо выразить V, объем. В таком случае нам кажется удобным использовать способ, предложенный одной блондинкой. Мысленно заменим буквы на цифры n=6, V=3 и c=2: 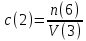 . Ведь 6 делить на 3 равно 2, не так ли? Чтобы выразить 3 (мы так обозначили V), очевидно надо 6 делить на 2: . Ведь 6 делить на 3 равно 2, не так ли? Чтобы выразить 3 (мы так обозначили V), очевидно надо 6 делить на 2: 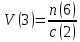 , а теперь, убрав цифры, вернемся к буквам: , а теперь, убрав цифры, вернемся к буквам: 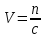 . Попробуйте сами, аналогичной чуши достаточно много. . Попробуйте сами, аналогичной чуши достаточно много.Лирическое отступление о сайте https://ks.rsmu.ru/ В данном случае, по нашим наблюдениям, феерическая, мягко говоря невнимательность первокурсников накладывается на вырвиглазный дизайн сайта. Результат плачевный, поэтому расскажем, как пользоваться сайтом. Выбираем самостоятельные тесты  Видим это. Курсы не берем, они пока не работают, идем в дисциплины  Разворачиваем меню, клацаем по нужной теме  Жмём «Запустить». Задрачиваем скилл решения тестов, пока не надоест. Удачи! Типичные вопросы: Задачи с массовой долей. Посчитать массовую долю если даны массы веществ. Пример: 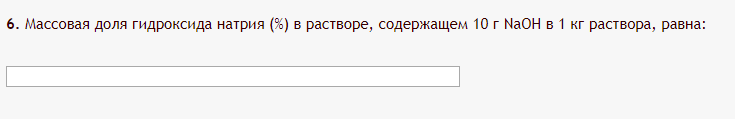 Легкий пример… Как с этим бороться: В одно действие. Читаем и понимаем условие. Нужно понять, что нам даны гидроксид натрия как растворенное вещество, масса его mрастворенное вещество=10 грамм и mраствор=1 кг. Приводим оба числа к одной размерности, 1 кг = 1000 грамм. Ищем ω, подбираем такую формулу, чтобы данные подходили. Это будет 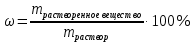 , ,хернем туда цифры, получится 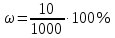 = 1% = 1%Как мы и говорили, требовалось понять условие (по нашим наблюдениям, это самое сложное), подобрать формулу и посчитать числа. Обращаем внимание на перевод в одну размерность. Масса по массовой доле. Пример: 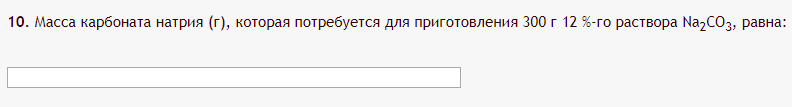 Немного сложнее. Как с этим бороться: В одно действие. Читаем условие, понимаем, что дано: ω=12% и mраствор=300 грамм. Хотят mрастворенное вещество-?. Подбираем формулу 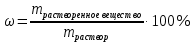 Преобразуем её блондиночным способом, чтобы выразить mрастворенное вещество 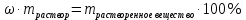 От % избавимся сокращением на 100%: 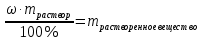 Ну и всё, можно числа ставить:  (грамм, в ответ нужно только число) (грамм, в ответ нужно только число)Подобные задачи в больших количествах решались в ЕГЭ как 27-ые задачи, поэтому проблем быть не должно. Если Вы привыкли к какому-либо иному способу решения, то можете пользоваться им, ответы всё равно будут получаться. Например, если сердцу вашему милее пропорции, а не формулы – да ради Бога. Массовая доля / масса, если даны масса, объем и плотность. Пример:  . Как с этим бороться: Почти аналогично прошлой задаче, но надо использовать плотность. Как обычно, читаем условия, понимаем их и видим, что дано ω=5%, Vраствора=1025 мл, ρ=0,976 г/мл, хотят m растворенного вещества. Для формулы с ω не хватает массы раствора, ищем её: 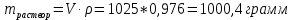 Дальше, как в прошлой задаче, формула: 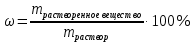 Опять преобразования: 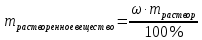 Вставляем цифры 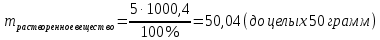 Массовая доля и моли Пример:  И еще немного сложнее. Как с этим бороться: В два действия, строго по формулам. Читаем условия, понимаем, что дано: n=0,2 моль (растворенного вещества), mраствор=100 грамм. Удачно есть М=58,5 грамм/моль – молярная масса. Хотят ω-?. Подбираем формулу для ω: 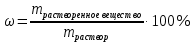 Однако, неприятность, m растворенного вещества чёт не дано. Зато есть n, применим её. Массу и моли связывает вот такая формула: 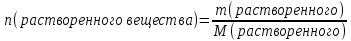 Применив блондиночные преобразования, получим: 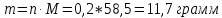 Дальше возвращаемся к первой формуле, бахнем цифры туда: 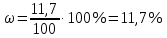 Массовая доля и разбавление Пример: 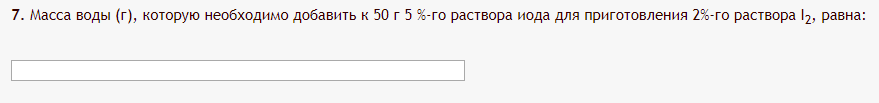 Наиболее сложная разновидность. Как с этим бороться: Сложная разновидность, прямое применение формул не вполне канает, следует немного подумать мозгом. Правда, в ЕГЭ такого было много, 27 задание, если мы не путаем. Расчеты надо вести с учётом, что есть два разных состояния: до добавления воды и после добавления воды. Их надо различить. Снова прочтём и поймем условие: даны ωдо добавления=5%, ωпосле добавления=2%, mраствор до добавления=50 грамм и mводы, но не та, которая в растворе, а та, которую к раствору собираются добавить – надо искать. Подбираем формулу: 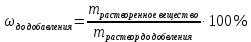 Преобразовав, найдем отсюда 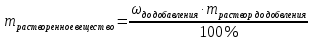 Не будем утомлять расчётами, масса растворённого вещества = 2,5 грамма. После того, как добавили воды, масса раствора изменилась, а масса растворённого вещества осталась прежней, ведь добавляли только воду. 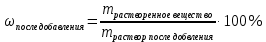 Так как всё остальное известно, найдем массу раствора после добавления воды. Применив блондиночные преобразования, получим: 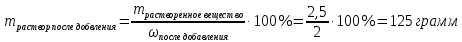 Ежу понятно, что если раствор весил 50 грамм до разбавления, а после разбавления 125 граам, то воды очевидно добавили 75 грамм. В ЕГЭ это делалось намного проще, если Вы владеете этим, то даже лучше. Составляем уравнение 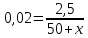 И решаем его. В этом уравнении 0,02 – это 2%, массовая доля, которую нужно получить. 2,5 – масса растворённого вещества. 50 – масса исходного раствора, х – масса воды, которую нужно добавить. 50+х – это масса раствора после разбавления. Примечание. Для любознательных химиков можем рекомендовать несложный эксперимент. Возьмите 10 грамм водки, там как раз 40% спирта. Залейте туда 90 грамм воды. Получится, согласно расчетам, 4% раствор спирта, то есть почти пиво, а на самом деле какое-то говно, пить невкусно, только продукт перевели, блин, мамкины химики, тоже мне. Задачи с молярной концентрацией. Молярная концентрация и моли Пример: 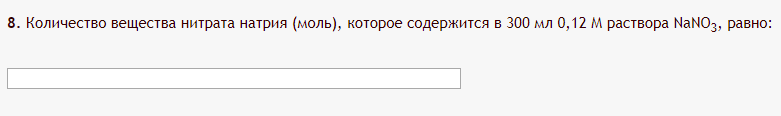 Лёгкая разновидность. Как с этим бороться: В одно действие. Читаем условие, понимаем, что есть с=0,12М (0,12 моль/литр), V=300 мл (0,3 литра, в этой формуле должны быть литры, помните?), хотят n-? Оно ищется в одну формулу, вот эту: 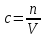 НО нужны преобразования  Молярная концентрация и объем растворённого газа Пример: 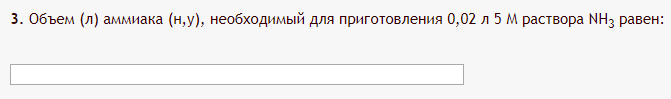 Внимание, подводные грабли. Как с этим бороться: Бывает, что растворённое вещество — газ. Тогда в задаче есть два объема. Один — объем жидкого раствора, а второй — объем газообразного растворенного газа. Их не надо путать, это разные числа. Задачи такого типа видно по примечанию (н.у.). Читаем задачу, видим, что дан V=0.02 л, это раствор, с=5М, просят найти объем аммиака. 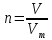 Но чтобы ей пользоваться, нужно n, его нет, но можно найти из: 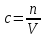 Используя блондиночные преобразования, получим: 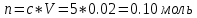 Возвращаемся к первой формуле, применим блондиночные преобразования к ней также, чтобы получить V (газа): 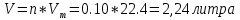 Задача может быть обратной, дан объем газа, найти молярную концентрацию. Это лече, преобразования формул не нужны, поэтому не рассматриваем. Молярная концентрация и масса Пример: 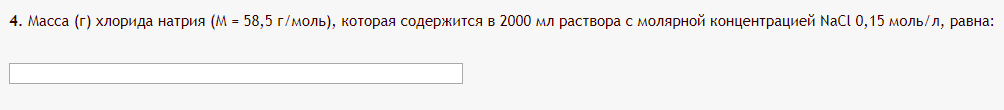 Аналог прошлой задачи, даже легче. Как с этим бороться: Аналогично прошлому примеру, но вместо объема будет масса. Из условия понимаем, что дано V = 2000 мл = 2 литра, с=0,15 моль/литр, М=58,5 г/моль. Искать будем массу растворенного вещества. Массу проще будет найти через 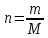 Массу надо выразить отсюда через блондиночные преобразования 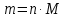 Молярная масса как раз есть, а моли щас найдем, как в прошлом примере через 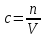 Снова применим преобразования (2000 мл = 2 л) 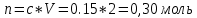 Вернемся к первой формуле, преобразуем и вставим цифры: 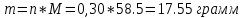 Также возможна обратная задача. Молярная концентрация и массовая доля Пример: НЕТ ИЗОБРАЖЕНИЯ УВЫ, СКРИН БЕЗВОЗВРАТНО ПОТЕРЯН. Как с этим бороться: Затруднительно. Чтобы не делать кучу преобразований, умные люди давно связали две концентрации, с и ω, вот такой формулой:  с—молярная концентрация, ω—массовая доля в %, ρ—плотность, М-молярная масса. Как это выведено лучше не знать. Поскольку скрин мы не приводим. Разбора задачи не будет. Задачи про моляльность. Моляльность и масса Пример:  Аналог прошлых задач с чуть другой формулой. Как с этим бороться: Как и в предыдущих задачах, читаем и понимаем условие. Из него видно, что b=0.5 моль/кг, mвода = 100 грамм = 0,1 кг, М=166 г/моль. Предлагают найти m растворенного вещества. Проще использовать формулу 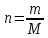 Для неё нужно n, которое может быть получено из формулы моляльности. 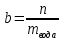 Преобразуем 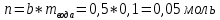 Возвращаемся к первой формуле, преобразуем, подставляем 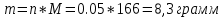 Вопросы без расчетов. Вопросы про размерность Пример:  Такие дела. Как с этим бороться: Масса — килограммы или граммы. Объем — литры или милилитры Плотность — г/мл Количество вещества — моли Массовая доля — доли единицы или % или ‰ или мг% Молярная концентрация — моль/л или М, бывает и ммоль/л. Моляльность — моль/кг Массовая концентрация – г/л Разная теоретическая фигня. Пример:  Мда. Как с этим бороться: Затруднительно. Плохо поддается какой бы то ни было классификации, поэтому приведем то, что встретилось нам. Растворы — однородные гомогенные системы. Растворение — физико-химический процесс, так-то. Растворимость газов и твёрдых зависит от природы вещества и растворителя, температуры, наличия других растворенных веществ и, для газов еще от давления. Не зависит от объема или массы воды, массы тв., объема газа. При растворении газов — выделение теплоты. Растворимость газов — литр/литр воды, растворимость тв. — моль/литр или г/литр. Массовая доля — масса на 100 гр. раствора. Молярная концентрация — количество моль на 1 литр раствора. Моляльность — количество моль на 1 кг растворителя (не раствора). Растворимость газов увеличивается при увеличении давления. Всё мы не опишем, там много,. Бойтесь. Формульные вопросы Пример:  Как с этим бороться: Это просто те же формулы, что и в начале текста, из них надо выбрать правильную. Формулы могут быть даны в преобразованном виде. Начало формулы написано не как буква, а как текст. Знаками (Х) смущаться не нужно, (Х) — обозначение растворенного вещества в таких вопросах, например m(Х) читается как масса растворенного вещества. В примере просят подобрать формулу для мольной доли. Такой ебанины, как в примере, наше пособие не содержит (задач таких нет), а формулу можно найти в кафедральной методичке. Ответ 1). Иногда требуется сильно подумать, формула может быть преобразованной. Также бойтесь. Ряды Пример:  Как с этим бороться: Дьявольское порождение изощренного разума. Для ответов следует произвести некие преобразования, далеко не такие простые, как блондиночные. Но не стоит унывать, преобразования мы уже произвели за вас, и теперь предлагаем их итоги. В каждом таком вопросе нужно установить зависимость между молярной массой и одной из концентраций. Зависимости: А) чем ↑молярная масса, тем ↑массовая доля при постоянном количестве вещества Б) чем ↑молярная масса, тем ↓молярная концентрация при постоянной массе растворенного В) чем ↑молярная масса, тем ↓моляльность при постоянной массе растворенного Короче, если нужно расположить в порядке уменьшения молярной концентрации, то располагают в порядке увеличения молярной массы: Li Проверка теории на себе  Спасибо за внимание |
