регуляция активности ферментов. срс Клиническая Биохимия (3). Непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель
 Скачать 59.82 Kb. Скачать 59.82 Kb.
|
|
Введение……..……………………………………………….2 Виды регуляция Ферментов….………..…………………………………3 Список литературы………………………………………….14 Как регулируется активность ферментов? Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – предоставить клетке шанс выжить. Способы регуляции активности ферментов В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны. 1.Доступность субстрата или кофермента
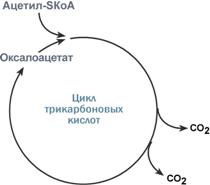
Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА. Именно из-за недостатка оксалоацетата (относительного или абсолютного) при голодании и инсулинзависимом сахарном диабете развивается состояние под названием кетоацидоз. 2. Компартментализация Компартментализация – это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) – в эндоплазматическом ретикулуме, митохондриях, лизосомах, ядре, плазматической мембране и т.п. Например, ферменты цикла трикарбоновых кислот и β-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка – в рибосомах. 3. Генетическая регуляция Генетическая регуляция (изменение количества фермента) может происходить в результате увеличения или снижения его синтеза. С этой точки зрения ферменты можно подразделить на три группы: Конституитивные – такие ферменты, которые образуются в клетке постоянно, независимо от наличия субстрата (нейрональная NO-синтаза, ферменты гликолиза, β-окисления жирных кислот, репарации ДНК). Индуцируемые – синтез этих ферментов возрастает при наличии соответствующих стимулов - индукторов. Репрессируемые – образование таких ферментов в клетке при необходимости подавляется. Изменение скорости синтеза фермента (индукция или репрессия) обычно зависит от количества определенных гормонов или метаболитов процесса. Примеры индуцируемых ферментов: гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови при длительном голоданиии и устойчивость ЦНС к стрессу, исчезновение пищеварительных ферментов при длительном голодании и индукция их синтеза в восстановительный период в результате возобновления секреции гормонов ЖКТ, при беременности и после родов в молочной железе индуцируется синтез фермента лактозосинтазы под воздействием лактотропного гормона, токсические субстраты (например, этанол и барбитураты) стимулируют в печени синтез "своего" изофермента цитохрома Р450, который окисляет и обезвреживает эти вещества, при активации цитокинами моноцитов и макрофагов в них начинается синтез индуцируемой NO-синтазы. Примеры репрессируемых ферментов: в печени репрессия фермента синтеза холестерола ГМГ-SKoA-редуктазы под влиянием холестерина и желчных кислот, в печени репрессия синтеза ферментов глюконеогенеза под действием инсулина, подавление синтеза триптофана бактериями при деятельности триптофанового оперона. 4. Ограниченный (частичный) протеолиз проферментов Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывающей системы крови, лизосомальных ферментов (катепсины). Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок в плазме крови до наступления определенного момента (факторы свертывания крови, белки системы комплемента, калликреин-кининовой и ренин-ангиотензиновой систем). 5. Аллостерическая регуляция Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. Общий принцип аллостерической регуляции В качестве отрицательного регулятора может выступать конечный или промежуточный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким то образом связанных с данной реакцией. Например, фермент энергетического окисления глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. Еще примеры: В большинстве клеток организма (кроме печени) при регуляции синтеза холестерола аллостерическим ингибитором ключевого фермента этого процесса ГМГ-КоА-редуктазы выступает сам холестерол, что быстро и точно регулирует его количество, Фермент ЦТК изоцитрат-дегидрогеназа активируется при помощи АМФ и АДФ и ингибируется влияниями АТФ и НАДН. В то же время в адипоцитах синтез нейтрального жира (триацилглицеролов) никак не ограничивается количеством конечного продукта, что позволяет клетке накапливать жир в гигантском количестве. 6. Белок-белковое взаимодействие Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. 1. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона). Более подробно механизм активации G-белка можно посмотреть здесь. 2. Еще примером белок-белкового взаимодействия может быть регуляция активности протеинкиназы А через механизм ассоциации-диссоциации. Протеинкиназа А является тетрамерным ферментом, состоящим из 2 каталитических (С) и 2 регуляторных (R) субъединиц. Активатором для протеинкиназы А является цАМФ. Присоединение цАМФ к регуляторным субъединицам фермента вызывает их отхождение от каталитических субъединиц. Каталитические субъединицы при этом активируются. 7. Ковалентная (химическая) модификация Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Изменение активности фермента при фосфорилировании-дефосфорилировании Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна. активной, фосфорилаза – неактивной Мультиферментные комплексы Наиболее эффективно происходит регуляция в так называемых мульти- ферментных комплексах. Эти комплексы представляют собой несколько ферментов, катализирующих ряд согласованных реакций, причем конечные продукты одной ферментативной реакции являются исходными субстратами для следующей ферментативной реакции. Различают три типа мультиферментных комплексов: • ферменты растворены в цитоплазме и контакт субстратов с ними осуществляется посредством диффузии; • ферменты соединены друг с другом за счет белок-белковых взаимодействий; • ферменты соединены друг с другом и иммобилизованы на внутриклеточных или цитоплазматических мембранах. В каждом мультифсрмснтном комплексе имеется, по крайней мере, один аллостерический фермент, осуществляющий регуляцию суммарной реакции всего ферментного ансамбля. Чаше всего этот фермент катализирует скорость первой (самой медленной) реакции, а его отрицательным модулятором является конечный продукт всего процесса в целом. Ниже представлена схема, изображающая мультиферментную систему, в которой продукт последней реакции является отрицательным эффектором аллостерического фермента Е,: Мультиферментные системы могут включать в себя до 20 различных ферментов, функционирующих в определенной последовательности. В настоящее время изучены многие мультиферментные комплексы, функционирующие на разных этапах метаболизма. Одним из таких комплексов является совокупность ферментов, катализирующих синтез пиримидинов из ас- партата в бактериальных клетках. Аллостерическим ферментом в данном случае является аспартат-карбомоилаза, катализирующая первую стадию процесса, а именно превращение аспартата в карбомоиласпартат. Регуляция ферментативной активности может осуществляться за счет ограниченного протеолиза. Многие протеиназы, функционирующие вне клеток, например в крови или в пищеварительном тракте, синтезируются в виде неактивных предшественников. Активация их связана с гидролизом некоторых пептидных связей в полипептидной цепи. В качестве примера можно привести ферменты свертывания крови, а также такие ферменты пищеварительного тракта, как трипсин и химотрипсин и др. Регуляция ферментативной активности может осуществляться за счет ковалентной обратимой модификации новосинтезированных белковых макромолекул. Это связано в первую очередь с ферментативным присоединением к ним низкомолекулярных химических группировок в результате фосфорилирования, гликозилирования, метилирования и т. д. Присоединение фосфатной группы к гидроксилу аминокислотного остатка полипептидной цепи может как увеличить, так и снизить ферментативную активность. Примером тому может служить гликогенфосфорилаза — фермент, катализирующий отщепление остатков глюкозы от гликогена. В исходном состоянии он неактивен, но при фосфорилировании, осуществляемом посредством фермента протеинкиназы, происходит его активация и вовлечение в процесс метаболизма глюкозы. Напротив, фермент гликогенсинтаза активен в исходном состоянии, а при фосфорилировании его активность резко снижается. (Т) Эффективным инструментом регуляции каталитической активности является молекулярная гетерогенность ферментов, обусловленная как генетическими, так и эпигенетическими факторами. В настоящее время около половины идентифицированных ферментов находятся в клетках и тканях в виде множественных молекулярных форм, имеющих единую субстратную специфичность, но отличающихся по физико-химическим или иммунологическим свойствам. Генетическая основа молекулярной гетерогенности обусловлена наличием нескольких генов, каждый из которых кодирует одну субъединицу фермента или одну его молекулярную форму. Кроме того, различные молекулярные формы одного и того же фермента могут кодироваться в одном генном локусе, имеющем множественные аллели. Генетически детерминированные молекулярные формы называются изоэнзимами. Посттрансляционные модификации ферментов, обусловленные локальным протеолизом, ковалентными модификациями, бслок-белковыми взаимодействиями и т. д., являются причиной образования множественных молекулярных форм, не являющихся истинными изоэнзимами, но играющими существенную роль в метаболических процессах. Наиболее часто встречаются так называемые конформеры — молекулярные формы, имеющие одинаковую первичную структуру, но отличающиеся по своей конформации. Это возможно в том случае, если эти конформации достаточно устойчивы, т. е. соответствуют уровню свободной энергии, близкой к минимальной. Только такие кон- формационные варианты белков, которые воспроизводимо фиксируются посредством электрофоретических, хроматографических или иных методов, могут рассмагриваться как конформеры. Множественные молекулярные формы ферментов Участие множественных молекулярных форм ферментов в регуляции метаболизма можно проиллюстрировать на примере синтеза аминокислот у бактерий. У Е. coli аспартаткиназная реакция предшествует синтезу трех аминокислот: треонина, лизина, метионина. Имеются три изоэнзима аспартаткина- зы (АК-1, АК-2 и АК-3), которые по принципу обратной связи ингибируются соответствующими аминокислотами. Вообще регуляция метаболизма изоферментами основана на различии их некоторых свойств, влияющих на скорости каталитического процесса (табл. 6.2). Таблица 6.2. Различия свойств изоферментов, влияющих на скорости ферментных реакций
Известны случаи, когда два изоэнзима одного фермента катализируют разнонаправленную ферментативную реакцию. Например, один из изоэнзимов лактатдегидрогеназы катализирует реакцию образования лактата из пиру- вата, а другой — образование пирувата из лактата. ПРИМЕНЕНИЕ ФЕРМЕНТОВ Общая характеристика Ферменты в течение многих лет применяются в различных областях практической деятельности человека: в кожевенной, пищевой, текстильной, фармацевтической и других отраслях промышленности, а также в медицине, сельском хозяйстве, химическом синтезе. Эффективность действия ферментов многократно выше по сравнению с химическими катализаторами, однако их промышленное применение затруднено из-за неустойчивости при хранении и температурных воздействиях. Кроме того, многократное применение ферментов практически невозможно в связи с технологическими трудностями их отделения от продуктов реакции. Иммобилизованные ферменты Новые возможности открылись перед прикладной энзимологией в связи с созданием иммобилизованных ферментов. Термин иммобилизованные ферменты был впервые применен в 1971 г. на первой конференции по инженерной энзимологии в США и в настоящее время получил повсеместное распространение. Иммобилизация означает взаимодействие ферментов или их активных фрагментов с растворимыми или нерастворимыми носителями, в результате чего происходит ограничение движения ферментов в пространстве. Иммобилизованные ферменты имеют ряд преимуществ при использовании их в практических целях. Основными из них являются: • значительное увеличение стабильности ферментов; • возможность остановки реакции в любой момент времени; • многократное использование биокатализатора; • получение продукта реакции, не загрязненного ферментом; • проведение непрерывного процесса, например, в проточных колоннах; • целенаправленное изменение свойств фермента (оптимуму pH и температуры, специфичности и др.) для оптимизации каталитического процесса. Для получения иммобилизованных ферментов используют многочисленные носители различной природы. Носители должны быть устойчивы к воздействию химических и биологических факторов, иметь высокую проницаемость для ферментов и субстратов, а также легко переходить в активированное состояние. Органические полимерные носители разделяют на природные и синтетические. К природным носителям относятся полисахариды, белки и липиды. Наиболее часто для иммобилизации на основе полисахаридов используют агарозу, целлюлозу, декстран и их производные. Целлюлоза, представляющая собой поли-1,4-р-0-глюкопироназил-0-глюкопиранозу, высоко гидрофильна, легко активируется и поэтому часто используется в качестве носителя. Нередко для целей иммобилизации используют хитин, представляющий собой целлюлозу, в которой СН2ОН-группа заменена ацетамидным остатком. Из других носителей полисахаридной природы можно отметить декстран (поли- 1,6-а-о-глюкопиранозил-о-глюкопираноза), представляющий собой разветвленный полисахарид микробного происхождения. Гели на основе декст- рана, сшитые эпихлоргидрином, выпускаются под названием «сефадексы» и имеют самостоятельное значение в качестве носителей для выделения и очистки различных веществ. Агароза (поли-р-галактопиранозил-3,6-ангидро-а-Ь-галактопираноза) также часто используется в качестве носителя для иммобилизации. Белки как носители представляют наибольший интерес для использования в медицине, однако необходимо учитывать высокую иммуногенность и быструю их деградацию при применении in vivo. Наиболее часто для иммобилизации ферментов применяют фибриллярные белки, например кератин и коллаген. К синтетическим полимерным носителям относятся полимеры на основе стирола, производные акриловой кислоты, а также полиамидные носители. Ферменты находят разнообразное применение в различных отраслях промышленности, а также в медицине, например: • в медицине — в качестве противовоспалительных, тромболитических и фибринолитических препаратов; • в химии — в качестве катализаторов при проведении различных технологических процессов; • в фармации — при анализе лекарственных веществ белковой природы; • в промышленности — в качестве активных компонентов стиральных и моющих средств, в дубильных процессах, в пищевых производствах, например при обработке мяса Заключение Ферменты как биополимеры очень важны в жизни человека. Использование ферментов в медицине сводится к выпуску новых лекарственных средств, в составе которых вещества уже находятся в нужных количествах. Ученые еще не нашли способ стимулирования синтеза недостающих энзимов в организме, однако сегодня широко распространены препараты, которые могут на время восполнить их недостаток. Ферменты используются в виноделии, пивоварении, получении многих кисломолочных продуктов. Для получения спирта из глюкозы могут использоваться дрожжи, однако для удачного протекания этого процесса достаточно и экстракта из них. Спустя 100 лет после открытия этого класса веществ человечество узнало о ферментах очень много, но это не является точкой в исследованиях, т.к. технологии с каждым днём улучшаются, и, может быть, скоро мы узнаем что-то новое о ферментах. Список литературы 963. — 65 с. 2. Асатиани B.C. Ферментные методы анализа. -М .: Наука. -1969. — 740 с. Колб В.Г., Камышников B.C. Клиническая биохимия. -Минск: Беларусь. -1976. — 310 с. Биохимия : учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп. - М. : ГЭОТАР-Медиа, 2014. - 768 с. : ил. http://www.studentlibrary.ru Интернет-ресурс http://ebooks.grsu.by - В.И. Резяпкин, В.Н. Бурдь «Основы биохимии» |