Химия. Номер варианта соответствует порядковому номеру в списке слушателей
 Скачать 1.34 Mb. Скачать 1.34 Mb.
|
|
ЧАСТЬ 2. ХИМИЯ ЭЛЕМЕНТОВ Методические советы Для всех тем второй части программы предлагается следующий план рассмотрения свойств элементов: 1. Из положения элементов в периодической системе определить: а) общее количество электронов, равное порядковому номеру элемента; б) количество электронных слоев, соответствующее номеру периода, в котором расположен элемент; в) число валентных электронов, связанное с номером группы. 2. Составить электронную формулу атома элемента с распределением электронов по уровням и подуровням. 3. С учетом правила Гунда представить распределение электронов графически. Для частично заполненных уровней обозначить свободные орбитали. 4. На основании распределения электронов в атоме сделать вывод о преобладании металлических или неметаллических свойств (тенденции к потере или к присоединению электронов). 5. С учетом свободных орбиталей и неспаренных электронов определить валентности, которые может проявлять элемент. Указать его возможные степени окисления. 6. Для всех положительных степеней окисления составить формулы оксидов элемента, определить их характер. Составить формулы соответствующих гидроксидов и подтвердить их характер (кислотный, основной или амфотерный) уравнениями диссоциации. 7. Рассмотреть свойства водородного соединения элемента. Указать возможную кислотность и охарактеризовать устойчивость. 8.Указать, как изменяется окислительная и восстановительная способность элемента при изменении его степени окисления. Написать уравнения реакций окисления и восстановления на примере водородных и кислородных соединений элемента. 9. Кратко охарактеризовать способы получения элемента и его соединений и основные области его применения. Для примера в соответствии с изложенным планом, охарактеризуем свойства мышьяка: Контрольные задания 111-120. В соответствий с предложенным в методических советах планом опишите свойства элемента, соответствующего вашему заданию. 111. Бор. 112. Алюминий. 113. Углерод. 114. Азот. 115. Фосфор. 116. Сера. 117. Фтор. 118. Хлор. 119. Марганец. 120. Железо. ПРИЛОЖЕНИЯ Приложение 1 НОМЕНКЛАТУРА СОЛЕЙ НЕОРГАНИЧЕСКИХ КИСЛОТ
Название солей составляется из названий соответствующей кислоты я металла, независимо от числа атомов металла и кислотных остатков, входящих в формулу соли. Пример: Са3(РО4)2 — фосфат кальция, или фосфорно-кислый кальций. Название солей ряда кислот приведены в таблице.
II. Кислые соли Название кислой соли образуется добавлением к названию средней соли приставки «гидро», означающей наличие одного незамещенного атома водорода в кислотном остатке. Если в кислотном остатке содержится два незамещенных атома водорода, то используется приставка «дигидро». Примеры: CuHP04 — гидрофосфат меди; Са(НСO3)2 — гидрокарбонат кальция; NaH2PO4 — дигидрофосфат натрия; Са (Н2РО4)2 — дигидрофосфат кальция. III. Основные соли Название основной соли образуется добавлением к названию средней соли приставки «гидроксо», означающей наличие незамещенной гидро-ксильной группы, связанной с атомом металла. Если с одним атомом металла связаны две незамещенные гидроксильные группы, то используется приставка «дигидроксо». Примеры: CuOHNO3 — гидроксонитрат меди; А1(OН)2С1 — дигидроксохлорид алюминия; (CuOH)2SO4 — гидроксосульфат меди; (АlOН)3(Р04)2 — гидроксофосфат алюминия. Приложение 2 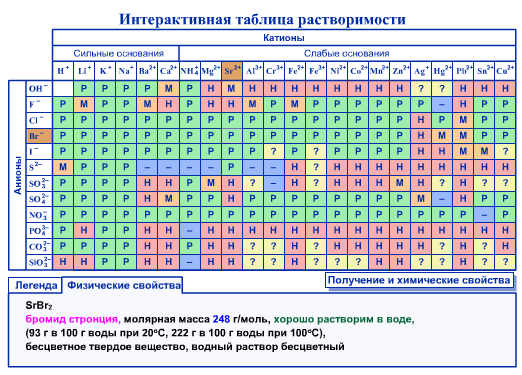 Приложение 3 Степень диссоциации кислот, оснований и солей в водных растворах при 18° С
Приложение 4 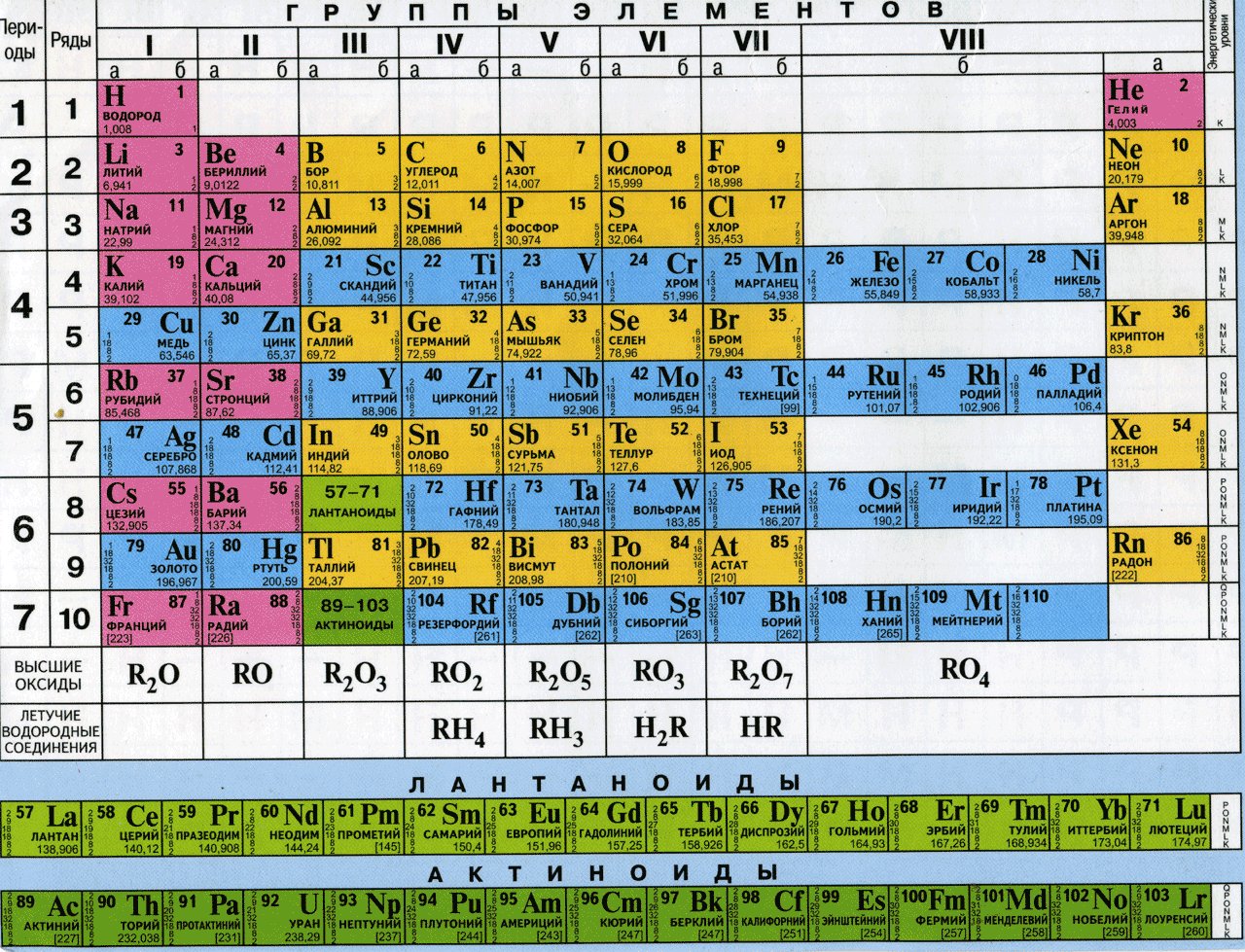 |
