бх. Нуклеотидыэто органические молекулы, состоящие из нуклеозида и фосфата. Каждый нуклеотид содержит 3 химически различных компонента гетероциклическое азотистое основание, моносахарид (пентозу), остаток фосфорной кислоты.
 Скачать 179.71 Kb. Скачать 179.71 Kb.
|
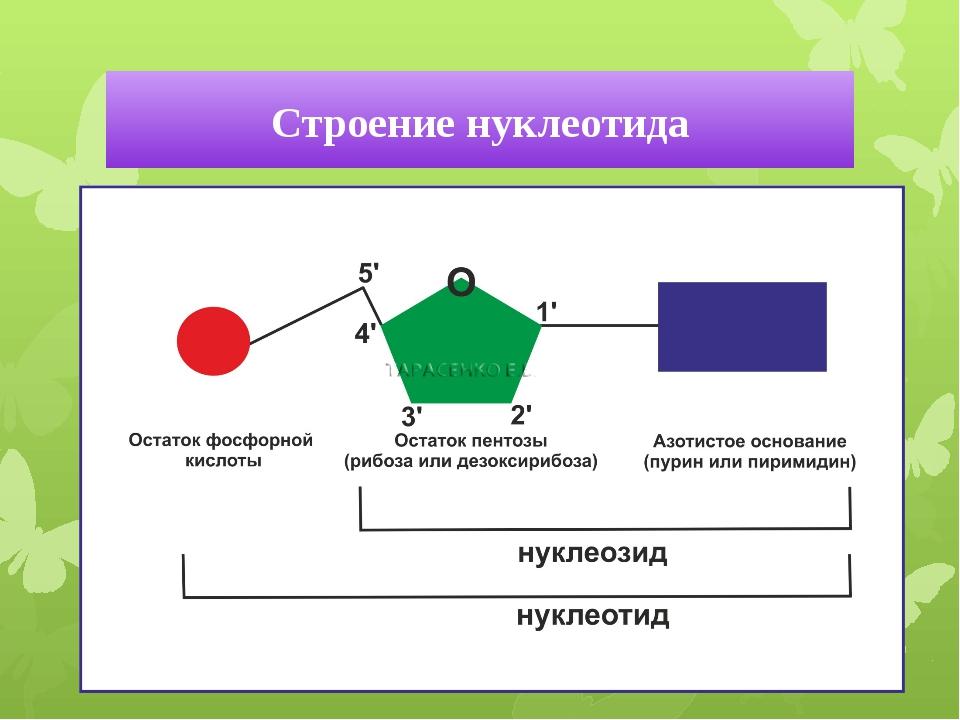 Нуклеотиды-это органические молекулы, состоящие из нуклеозида и фосфата. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу), остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ). Нуклеотиды-это органические молекулы, состоящие из нуклеозида и фосфата. Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу), остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ).Нуклеотиды, состоящие из одной молекулы А.О, пентозы, фосфорной кислоты, называются мононуклеотидами. Мононуклеотиды могут содержать одну молекулу фосфорной кислоты, две или три молекулы фосфорной кислоты, соединенных друг с другом. Комбинация из двух мононуклеотидов называется динуклеотидом. В составе динуклеотида обычно присутствуют разные азотистые основания или одно другое циклическое соединение. Особую роль в биохимических процессах играют циклические мононуклеотиды. Биологическая роль нуклеотидов: Мономер ДНК и РНК. Форма запасания энергии в клетке (например, АТФ, ГТФ). Источник фосфатной группы (например, при фосфорилировании глюкозы). Коферментная функция (НАД, НАДФ, ФАД). Могут служить активаторами ферментов (это, в основном характерно для цАМФ и цГМФ). Для активирования различных субстратов, в результате чего соединения с мононуклеотидом они приобретают макроэргическую связь и могут вступать в химические реакции: а) для активирования глюкозы – необходим УТФ, получается УДФ-глюкоза; б) для холина и других азотистых соединений, а также глицеролсодержащих соединений – ЦТФ, получается ЦДФ-холин и др.; в) для аминокислот – АТФ, получается аминоациладенилат. Нуклеотиды могут выполнять регуляторную функцию (например, гуанозинтетрафосфат участвует в матричных синтезах).  1 - ФРДФ синтетаза; 2 - амидофоофорибозилтрансфераза; 3 - ИМФ дегидрогеназа; 4 - аденилосукцинатсинтетаза. О 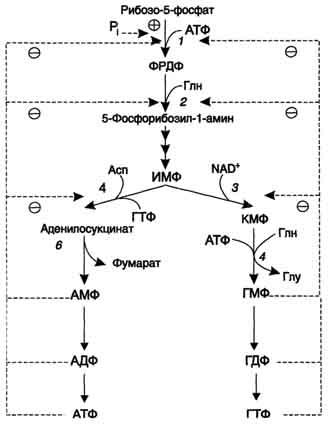 сновным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы - фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов. Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза - аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем порядке: сновным показателем, от которого зависит синтез пуриновых нуклеотидов, служит концентрация ФРДФ, которая, в свою очередь, зависит от скорости его синтеза, утилизации и разрушения. Количество ФРДФ определяется доступностью рибозо-5-фосфата и активностью ФРДФ синтетазы - фермента, чувствительного к концентрации фосфата и пуриновых нуклеотидов. Внутриклеточная концентрация ФРДФ строго регулируется и обычно низкая. ФРДФ синтетаза - аллостерический фермент. Он активируется неорганическим фосфатом (Рi) и ингибируется пуриновыми нуклеозид- моно-, ди- и трифосфатами, которые по эффективности ингибирования распределяются в следующем порядке:НМФ > НДФ > НТФ (рис. 10-8). ФРДФ служит не только субстратом, но и аллостерическим активатором второй реакции синтеза пуринонуклеотидов de novo, которую катализирует амидофосфорибозилтрансфераза. Пуриновые нуклеотиды, особенно АМФ и ГМФ по механизму отрицательной обратной св1язи ингабируют амидофосфорибозилтрансферазу, которая катализирует первую специфическую реакцию синтеза пуриновых нуклеотидов de novo. Метаболическая цепь образования АМФ и ГМФ de novo регулируется также в месте её разветвления: АМФ ингибирует аденилосукцинатсинтетазу, а ГМФ - реакцию образования ксантиловой кислоты, которую катализирует ИМФ дегидрогеназа. Перекрёстная регуляция путей использования ИМФ служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого. Помимо ферментов основного пути синтеза пуриновых нуклеотидов de novo, регулируется также активность ферментов "запасных" путей: аденинфосфорибозилтрансфераза ингибируется АМФ, а гипоксантин-гуанинфосфорибозилтрансфераза - ИМФ и ГМФ. Пуриновые (аденин, гуанин) и пиримидиновые (цитозин, урацил и тимин) основания входят в состав нуклеиновых кислот — РНК и ДНК. Нарушение их обмена приводит к повышению уровня мочевой кислоты и наблюдается при различных заболеваниях почек, лейкозах, но особенно отчетливо при подагре, известной еще со времен Гиппократа. Подагра — хроническое заболевание, обусловленное нарушением обмена пуринов. Оно характеризуется отложением солей мочевой кислоты в тканях с развитием в них вначале воспалительных, а затем деструктивно-склеротических изменений. Проявляется, главным образом, рецидивирующим артритом, образованием подкожных узелков, симптомами мочекаменной болезни. В настоящее время термином «подагра» обозначают группу заболеваний, проявляющихся: гиперурикемией; повторными приступами острого артрита, при котором в лейкоцитах из синовиальной жидкости обнаруживаются кристаллы урата натрия; повреждением почек, включая интерстициальные ткани и кровеносные сосуды; образованием камней из мочевой кислоты. Подагру относят к мультифакториальным заболеваниям. В силу того, что две специфические причины подагры (недостаточность гипоксантингуанинфосфорибозилтрансфера-зы и гиперактивность 5-фосфорибозил-1-пирофосфатсинтетазы) сцеплены с Х-хромосомой, то подагра — это болезнь пожилых мужчин; на долю женщин приходится до 5% случаев заболевания. Дети и подростки болеют редко. Оротацидурия — наследственная болезнь, обусловленная недостаточностью ферментов, переводящих оротовую кислоту в цитидиловую; характеризуется тяжелой мегалобластической анемией и отложением в тканях и органах кристаллов оротовой кислоты. Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовой кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата кислоты; наследуется по аутосомно-рецессивному типу. Синдром Лёша — Найхана — наследственное заболевание, характеризующееся увеличением синтеза мочевой кислоты (у детей) вызванное дефектом фермента гипоксантин-гуанинфосфорибозилтрансферазы, который катализирует реутилизацию гуанина игипоксантина— в результате образуется большее количество ксантина и, следовательно, мочевой кислоты. Частота встречаемости 1:300000. Ферментативный дефект приводит к нарушению пуринового обмена и повышенной продукции мочевой кислоты. Гиперурикемия вызывает дефицит дофамина во всех подкорковых структурах, за исключением черной субстанции, что, вероятно, является следствием нарушения ветвления (арборизации — от лат. arbus, т.е. дерево) терминалей дофаминергических нейронов, в том числе в стриатуме. В результате развивается гиперчувствительность D1-рецепторов на стриарных нейронах, с которой можно частично связать аутоагрессивные действия. |
