Обмен липидов. обмен липидов. Обмен липидов Обмен липидов
 Скачать 4.54 Mb. Скачать 4.54 Mb.
|
|
Ацидоз – это смещение кислотно-щелочного баланса организма в сторону увеличения кислотности (уменьшению рН). Диабетический кетоацидоз (кетоацидоз) – это вариант метаболического ацидоза, связанный с нарушением углеводного обмена, возникшего вследствие дефицита инсулина: высокой концентрацией глюкозы и кетоновых тел в крови (значительно превышающей физиологические значения), образованных в результате усиленного катаболизма жирных кислот (липолиза) и дезаминирования аминокислот. Диабетический кетоацидоз занимает первое место среди острых осложнений эндокринных болезней, смертность достигает 6-10%. Все случаи данного состояния можно разделить на две группы: диабетический кетоз – это состояние, характеризующееся повышением уровня кетоновых тел в крови и тканях без выраженного токсического эффекта и явлений дегидратации; диабетический кетоацидоз – в случаях, когда недостаток инсулина вовремя не компенсирован экзогенным введением или не устранены причины, способствующие повышенному липолизу и кетогенезу, патологический процесс прогрессирует и приводит к развитию клинически выраженного кетоацидоза. В зависимости от значения водородного показателя: компенсированный ацидоз: рН крови не опускается ниже границы физиологической нормы (7,35). Усиливается сердцебиение, учащается дыхание и повышается кровяное давление; субкомпенсированный ацидоз: уровень pH крови находится в пределах 7,34-7,25. Может вызвать угнетение сердечной деятельности вплоть до сердечных аритмий. Появляется одышка, нередко рвота и понос; некомпенсированный ацидоз: водородный показатель ниже границы физиологической нормы (менее 7,24). декомпенсированный ацидоз. Вызывает расстройства функций (головокружение, сонливость, потеря сознания), сердечно-сосудистой системы, ЖКТ и др. По происхождению: газовый ацидоз – возникает при гиповентиляции или вдыхании воздуха с повышенным содержанием углекислого газа (дыхательный, респираторный); негазовый ацидоз: метаболический ацидоз – возникает из-за накопления кислых продуктов в тканях, недостаточного их связывания или разрушения (кетоацидоз, лактатацидоз) (обменный ацидоз); выделительный ацидоз – возникает при затруднениях выведения нелетучих кислот почками (почечный ацидоз) или увеличенной потере оснований через ЖКТ (гастроэнтеральный ацидоз); экзогенный ацидоз – наступает при введении в организм большого количества кислот или веществ, образующих кислоты в процессе метаболизма; смешанный ацидоз – сочетание различных видов ацидозов. Например, при патологии сердечно-сосудитой или дыхательной систем затруднено выведение углекислого газа, что вызывает уменьшение кислорода в крови и последующее накопление недоокисленных продуктов метаболизма. 3. Пальмитатсинтазный комплекс: строение, последовательность реакций. Источники восстановительных эквивалентов Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды. Условно можно выделить 4 этапа биосинтеза жирных кислот: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль: может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрий высшие жирные кислоты, но здесь транспорт идет в другом направлении, обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. 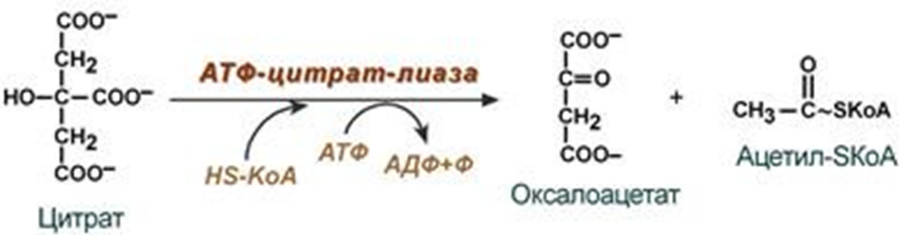 3. Образование малонил-SКоА из ацетил-SКоА Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов. 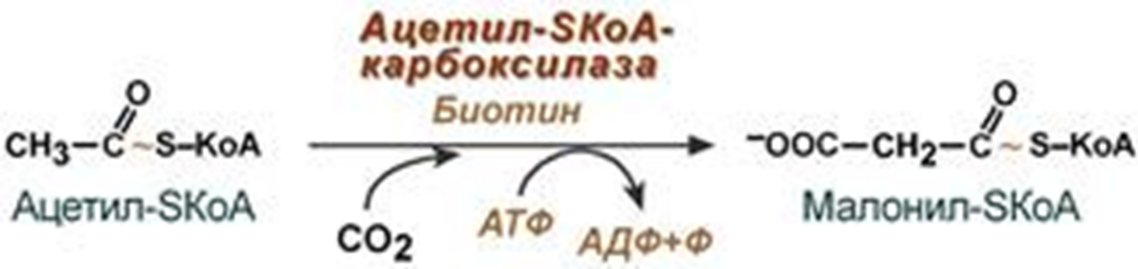 4. Синтез пальмитиновой кислоты Осуществляется мультиферментным комплексом "синтаза жирных кислот" в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ) Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН. Удлинение цепи жирных кислот Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Присоединение углеродов идет по карбоксильной группе (С1). Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ω3- и ω6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников. Молекулы НАДФН также используются: для синтеза жирных кислот (печень, жировая ткань), для синтеза холестерола и других стероидов (например, желчных кислот), в реакциия восстановительного аминирования для образования глутаминовой кислоты из α-кетоглутаровой кислоты, для восстановления окисленного тиоредоксина и окисленного глутатиона в системе антиоксидантной защиты клетки от свободно-радикального окисления, для восстановления железа (III) в метгемоглобине в железо (II) нормального гемоглобина (эритроциты), для реактивации фолиевой кислоты и витамина К. Обмен полиненасыщенных жирных кислот. Образование эйкозаноидов, их биологическая роль Аэробная десатурация – это наиболее распространённый путь синтеза ненасыщенных жирных кислот. Он используется всеми эукариотами и некоторыми прокариотами. В реакциях синтеза ненасыщенных жирных кислот из полноразмерных насыщенных жирных кислот этого пути используются десатуразы. Эйкозаноиды – окисленные производные полиненасыщенных жирных кислот, содержащих 20 углеродных атомов: дигомо-γ-линоленовой (эйкозатриеновой, С20:3), арахидоновой (эйкозатетраеновой, С20:4), тимнодоновой (эйкозапентаеновой, С20:5). Эйкозаноиды участвуют во множестве процессов, таких как рост мышечной ткани, раздражение и реакциях иммунитета на введенные токсины и патогены. Некоторые эйкозаноиды являются нейромедиаторами и гормонами. Выделяют несколько семейств эйкозаноидов, как воспалительных, так и противовоспалительных Простаноиды – это группа семейств эйкозаноидов, объединенных общими промежуточными метаболитами арахидоновой кислоты – PGG2 и PGH2: Простагландины Простациклины Тромбоксаны. Лейкотриены Эоксины Гепоксилины Эпоксиэйкозатриеновые кислоты Липоксины Резрвины Протектины Марезины Простагландины (PG) – вызывают сокращение или расслабление гладкой мускулатуры, оказывают влияние на давление крови, деятельность сердечной мышцы, эндокринной системы, состояние бронхов, кишечника, матки. Простациклины или простагландин I (PGI) – является мощным фактором, препятствующим агрегации тромбоцитов, выступая в роли биологического антагониста тромбоксина А2, образуются в эндотелиальных клетках эндокарда и сосудов. Тромбоксаны (TX) – особая разновидность простаноидов образующихся в тромбоцитах – влияют на свертываемость крови. Тромбоксан А2 (TXА2) — один из наиболее значимых участников воспалительного процесса. Локальный тромбоз, возникающий вследствие активации тканевого тромбопластина, сопровождается агрегацией тромбоцитов и усилением синтеза TXА2, который привлекает и активирует новые кровяные пластинки. Лейкотриены (LT) – их физиологическое действие выражается в сильном сокращении гладких мышц в некоторых органах, что ведет к сужению их полости, например сужение кровеносных сосудов в определенных ситуациях или как участники развития аллергических реакций и «провокаторы» бронхоспазма при бронхиальной астме, вызывают секрецию слизи. Эоксины (EX) – этот класс эйкозаноидов очень близок по структуре и функции к лейкотриенам. Биологические эффекты эоксинов связаны с развитием аллергии: они вызывают повышение проницаемости сосудов и экссудацию плазмы, что приводит к появлению местного отека тканей. Гепоксилины (Hx) – еще одно семейство эйкозаноидов, представляющих собой мощные воспалительные медиаторы. Принимают активное участие в развитии воспалительной реакции, вызывая миграцию нейтрофилов, повышая проницаемость капилляров и способствуя экссудации плазмы. Эпоксиэйкозатриеновые кислоты (EET) – короткоживущие тканевые гормоны, регулирующие многие важные функции организма. Они оказывают сосудорасширяющее (на уровне артериол) и дезагрегационное действие, улучшая микроциркуляцию и способствуя восстановлению тканей после ишемического повреждения (в частности, после инфаркта миокарда и ишемического инсульта). Липоксины (Lx) – относятся к особому классу специализированных субстанций, индуцирующих разрешение воспалительной реакции. По сути, липоксины являются ответвлением от семейства лейкотриенов. Они подавляют воспалительную реакцию. Резолвины (Rv) – характеризуются различными биологическими эффектами, направленными на прекращение агрессии клеток воспалительного ответа и прогрессирования воспалительной реакции: предотвращают хемотаксис и миграцию макрофагов и нейтрофилов в область воспаления; способствуют апоптозу «отработавших» нейтрофилов, эозинофилов, базофилов и лимфоцитов; стимулируют фагоцитоз подвергшихся апоптозу клеток «воспалительного ответа» (эффероцитоз); стимулируют «невоспалительный» фагоцитоз адипоцитов макрофагами, ассоциированными с жировой тканью. Протектины (Pt) – синтезируются во многих клетках, в частности нейронах, клетках мозга, Т-хелперах, эпителии сетчатки, активированных нейтрофилах и др. Это вещество обладает противовоспалительным и нейропротекторным потенциалом. Марезины – стимулируют эффероцитоз, активацию Трег-лимфоцитов, снижают синтез воспалительных цитокинов и выраженность гипералгезии за счет стабилизации нейрональных каналов. Синтез и распад триацилглицеролов и глицерофосфолипидов: последовательность реакций. Взаимопревращение глицерофосфолипидов Реакции биосинтеза липидов (липогенез) могут идти в гладкой эндоплазматической сети клеток всех органов. Субстратом для синтеза жиров de novoявляется глюкоза. Пируват переходит в митохондрии, декарбоксилируется вацетил-SКоА и вступает в ЦТК. Однако в состоянии покоя, при отдыхе, при наличии избыточного количества энергии в клетке реакции ЦТК (в частности, изоцитратдегидрогеназная реакция) блокируются избытком АТФ и НАДН. Синтез фосфолипидов и триацилглицеролов тесно связаны Начальные реакции синтеза триацилглицеролов и фосфолипидов совпадают и происходят при наличии глицерола и жирных кислот. В реакциях биосинтеза можно выделить следующие события: Образование глицерол-3-фосфата Биосинтез фосфатидной кислоты – требует наличия глицерол-3-фосфата и жирных кислот. Далее фосфатидная кислота может превращаться двумя путями – в ЦДФ-ДАГ (цитидиндифосфат-диацилглицерол) или дефосфорилироваться до 1,2-ДАГ. 3. Синтез триацилглицерола (липогенез) – идет из 1,2-ДАГ после дефосфорилирования фосфатидной кислоты. Образованный 1,2-ДАГ ацилируется до ТАГ. 4. Синтез фосфолипидов. Образование глицерол-3-фосфата В начале всего процесса происходит образование глицерол-3-фосфата. В абсорбтивный период поступающий в печень из кишечника глицерол фосфорилируется глицеролкиназой. В мышцах, жировой ткани и других тканях глицеролкиназа отсутствует, поэтому здесь глицерол-3-фосфат образуется из диоксиацетонфосфата, метаболита гликолиза. В печени этот второй путь используется тоже. Жирные кислоты, поступающие из крови при распаде ХМ, ЛПОНП или синтезированные в клетке из глюкозы, также должны активироваться. Они превращаются в ацил-SКоА в АТФ-зависимой реакции 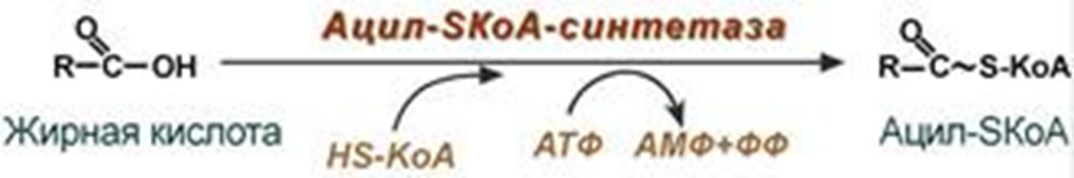 При наличии глицерол-3-фосфата и ацил-SКоА синтезируется фосфатидная кислота. 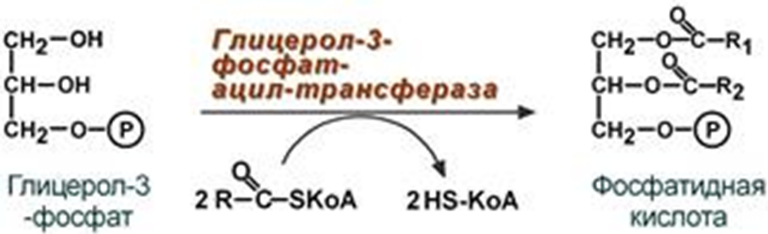 Следует отметить, что жирнокислотный состав фосфатидной кислоты определяет ее дальнейшую судьбу. Синтез ТАГ – это запасание энергии. Отсутствие тормозящего влияния продукта реакции позволяет жировой клетке накапливать жиры практически в любых количествах. Синтез триацилглицеролов (липогенез) заключается в дефосфорилировании фосфатидной кислоты, полученной из глицерол-3-фосфата, и присоединении ацильной группы. 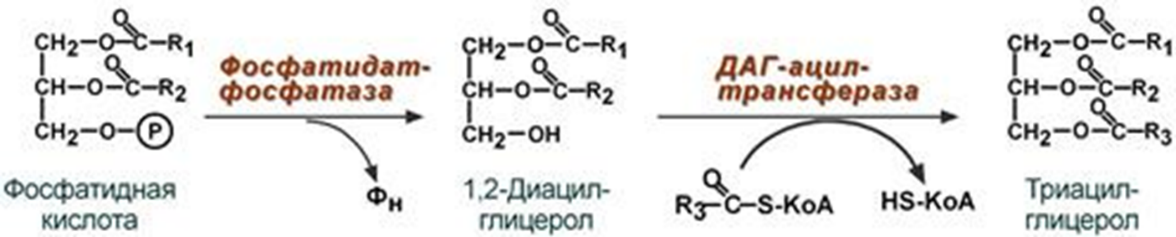 Синтез ТАГ увеличивается при соблюдении хотя бы одного из следующих условий, которые обеспечивают появление избытка ацетил-SКоА: 1) наличие источника "дешевой" энергии. Например, диета богатая простыми углеводами (глюкоза, сахароза). наличие этанола, высокоэнергетичного соединения, который окисляется до ацетил-SКоА. 2) повышение концентрации жирных кислот в крови. 3) высокие концентрации инсулина и низкие концентрации глюкагона. Для синтеза фосфолипидов нужны липотропные факторы Синтез фосфолипидов Биосинтез фосфолипидов по сравнению с синтезом ТАГ имеет существенные особенности. Они заключаются в дополнительной активации компонентов фосфолипидов – фосфатидной кислоты или холина и этаноламина 1 путь – "спасательный" Благодаря этому пути холин и этаноламин используются повторно и не катаболизируют. 2 путь – основной, синтез de novo Активация фосфатидной кислоты заключается в присоединении к ней ЦМФ с образованием ЦДФ-ДАГ. Далее к нему присоединяется шестиатомный спирт инозитол или серин с образованием фосфатидилинозитола и фосфатидилсерина. Синтезированный фосфатидилсерин подвергается декарбоксилированию с образованием фосфатидилэтаноламина. Последний метилируется при участии S-аденозилметионина в фосфатидилхолин. 3 путь – обратное превращение Между фосфатидилэтаноламином и серином может происходить реакция с образованием в результате реакции фосфатидилсерина и свободного этаноламина. Распад триацилглицеролов (липолиз) Распад триацилглицеролов (триглицеридов) по-другому называется липолизили мобилизация жира. Он идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ. Мобилизация триацилглицеролов и окисление жирных кислот активируется: при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертиреоз). Мобилизация триацилглицеролов и окисление жирных кислот активируется: при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания (гиперкортицизм, гипертиреоз). Глицерол с кровью доставляется в печень и почки, здесь фосфорилируется и окисляется в метаболит гликолиза диоксиацетонфосфат. Жирные кислоты транспортируются в крови в комплексе с альбуминами плазмы: при физической нагрузке – в мышцы, в обычных условиях и при голодании – в мышцы и большинство тканей, однако при этом около 30% жирных кислот захватывается печенью. Общая характеристика мобилизации ТАГ В целом мобилизацию жира можно представить как последовательность следующих событий: Липолиз – гормонзависимый распад ТАГ в жировой ткани или резервных ТАГ в самой клетке. Транспорт жирных кислот из жировой ткани по крови в комплексе с альбумином. Проникновение жирной кислоты в цитозоль клетки-мишени. Активация жирной кислоты через присоединение HS-КоА. Карнитин-зависимое перемещение жирной кислоты в митохондрию. |
