Обмен липидов. обмен липидов. Обмен липидов Обмен липидов
 Скачать 4.54 Mb. Скачать 4.54 Mb.
|
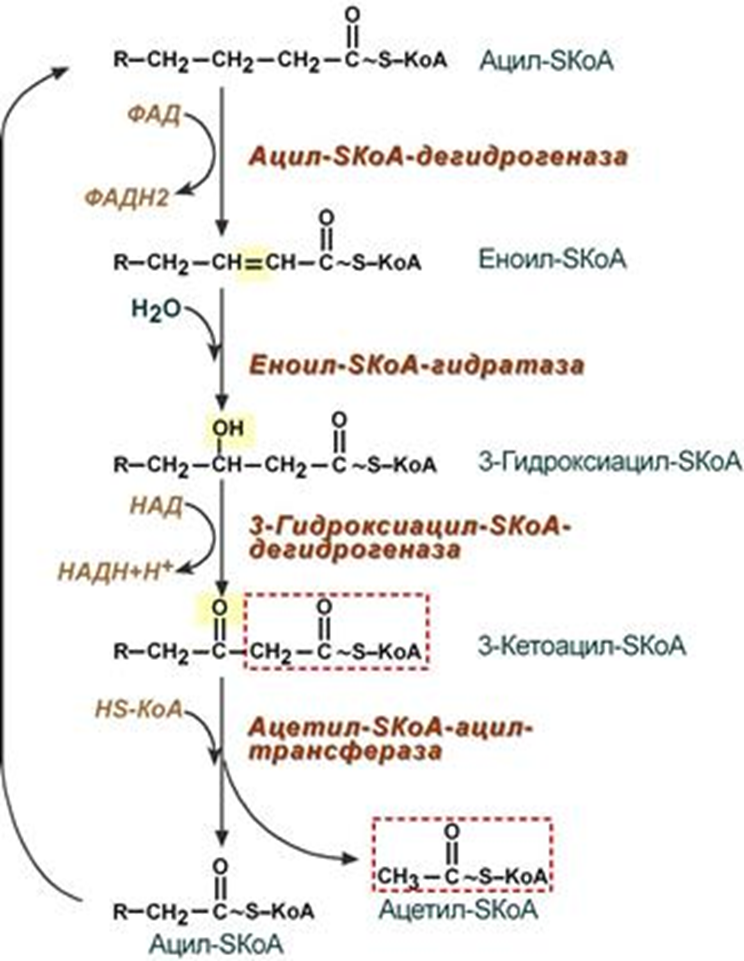
SКоА + карнитинОбмен липидов Обмен липидов – это сложный биохимический и физиологический процесс, происходящий в клетках живых организмов. Липидный обмен включает в себя следующие процессы: расщепление, переваривание и всасывание липидов в пищеварительном тракте, поступающих вместе с пищей; транспорт жиров из кишечника с помощью хиломикронов; обмен триацилглицеролов; обмен фосфолипидов; обмен холестерола; взаимопревращения жирных кислот и кетоновых тел; липогенез; катаболизм липидов (липолиз); окисление жирных кислот; образование эйкозаноидов. Особое значение имеет знание процессов регуляции липидного обмена и патологий, связанных с его нарушением. Основную массу липидов в организме составляют жиры (триацилглицеролы), служащие формой депонирования энергии. Фосфолипиды, являясь амфифильными молекулами, формируют бислойную структуру мембран, в которую погружены белки. Холестерол – это важный компонент мембран и регулятор свойств гидрофобного слоя; такие производные холестерола, как жёлчные кислоты, необходимы для переваривания жиров; стероидные гормоны, синтезируемые из холестерола, участвуют в регуляции многих функций организма человека. Катаболизм липидов – это совокупность всех катаболических процессов липидов, включающая такие процессы, как липолиз, β-окисление жирных кислот, окисление кетоновых тел, перекисное окисление липидов и др. Липолиз – это катаболический процесс, результатом которого является расщепление жиров, происходящее под действием фермента липазы. В результате стимулированного липолиза в адипоцитах образуются свободный глицерол и жирные кислоты. Процесс β-окисления высших жирных кислот – это очень важный процесс, обеспечивающий образование большого количества энергии (АТФ) и может быть представлен последовательными этапами: активация жирных кислот, транспорт жирных кислот внутрь митохондрий, внутримитохондриальное окисление жирных кислот. При длительном голодании в печени синтезируются кетоновые тела, которые становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга, окислялись, снижая его потребности в глюкозе. Липогенез – это процесс синтеза жирных кислот и триацилглицеролов, основным источником которых является ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде. Полиненасыщенные жирные кислоты являются предшественниками физиологически активных соединений – эйкозаноидов. Они участвуют во множестве процессов, таких как рост мышечной ткани, раздражение и реакциях иммунитета на введенные токсины и патогены, некоторые являются нейромедиаторами и гормонами. Процессы синтеза триацилглицеролов и фосфолипидов совпадают на начальных этапах и происходят при наличии глицерола и жирных кислот. Синтез холестерина происходит в клетках печени (50 %), кишечнике и коже и служит основой синтеза других стероидных соединений. Синтезированные в печени липиды могут транспортироваться в другие органы в составе липопротеинов (ЛПНП, ЛПВП). Процессы обмена липидов находятся под контролем таких гормонов, как глюкагон, адреналин, тироксин, инсулин. Нарушения регуляции обмена липидов приводят к различным патологиям: атеросклерозу, гепатозам. Для нормализации обмена липидов необходимы липотропные факторы: полиненасыщенные жирные кислоты, инозитол, серин, холин, этаноламин, метионин, витамины. Глоссарий Процесс β-окисления – это специфический путь деградации жирных кислот (в результате от молекулы жирной кислоты последовательно отщепляются двууглеродные фрагменты со стороны карбоксильной группы). Активация жирных кислот – это процесс образования ацил-КоА при участии АТФ, кофермента А (HS-КoA) и ионов Mg2+. Карнитин-ацилтрансфераза I – это фермент, осуществляющий транспортировку жирных кислот с длинной цепью через митохондриальную мембрану посредством карнитина с образованием ацилкарнитина. Карнитинацилтрансферазы II – это фермент, катализирующий расщепление ацилкарнитина с образованием ацил-КоА и карнитина. Кетоновые тела – это группа продуктов обмена веществ (ацетоацетат, 3-гидроксибутират и ацетон), которые образуются в печени из ацетил-КоА. Гиперкетонемия – это повышенное содержание кетоновых тел в крови. Кетонурия, ацетонурия – это состояние, когда кетоновые тела появляются в моче. Ацидоз – это смещение кислотно-щелочного баланса организма в сторону увеличения кислотности (уменьшению рН). Диабетический кетоацидоз (кетоацидоз) – это вариант метаболического ацидоза, связанный с нарушением углеводного обмена, возникшего вследствие дефицита инсулина. Диабетический кетоз – это состояние, характеризующееся повышением уровня кетоновых тел в крови и тканях без выраженного токсического эффекта и явлений дегидратации. Компенсированный ацидоз: рН крови не опускается ниже границы физиологической нормы (7,35). Усиливается сердцебиение, учащается дыхание и повышается кровяное давление. Субкомпенсированный ацидоз: уровень pH крови находится в пределах 7,34-7,25. Может вызвать угнетение сердечной деятельности вплоть до сердечных аритмий. Некомпенсированный ацидоз: водородный показатель ниже границы физиологической нормы (менее 7,24). Декомпенсированный ацидоз. Вызывает расстройства функций (головокружение, сонливость, потеря сознания), сердечно-сосудистой системы, ЖКТ и др. Газовый ацидоз – возникает при гиповентиляции или вдыхании воздуха с повышенным содержанием углекислого газа (дыхательный, респираторный). Метаболический ацидоз – возникает из-за накопления кислых продуктов в тканях, недостаточного их связывания или разрушения (кетоацидоз, лактатацидоз) (обменный ацидоз). Выделительный ацидоз – возникает при затруднениях выведения нелетучих кислот почками (почечный ацидоз) или увеличенной потере оснований через ЖКТ (гастроэнтеральный ацидоз). Экзогенный ацидоз – наступает при введении в организм большого количества кислот или веществ, образующих кислоты в процессе метаболизма. Аэробная десатурация – это наиболее распространённый путь синтеза ненасыщенных жирных кислот, осуществляющийся с помощью феремнтов десатураз. Эйкозаноиды – это окисленные производные полиненасыщенных жирных кислот, содержащих 20 углеродных атомов. Участвуют во многих процессах. Выделяют несколько семейств эйкозаноидов. Простаноиды – это группа семейств эйкозаноидов, объединенных общими промежуточными метаболитами арахидоновой кислоты. Простагландины – это эйкозаноиды, вызывающие сокращение или расслабление гладкой мускулатуры, оказывающие влияние на давление крови, деятельность сердечной мышцы, эндокринной системы, состояние бронхов, кишечника, матки. Простациклины – это эйкозаноиды, являющиеся мощным фактором, препятствующим агрегации тромбоцитов. Тромбоксаны – особая разновидность простаноидов образующихся в тромбоцитах – влияют на свертываемость крови. Лейкотриены – это эйкозаноиды, физиологическое действие которых выражается в сильном сокращении гладких мышц в некоторых органах, например, происходит сужение кровеносных сосудов в определенных ситуациях, или проявляют активность как участники развития аллергических реакций, вызывают бронхоспазмы при бронхиальной астме, а также вызывают секрецию слизи. Липогенез – это процесс синтеза триацилглицеролов (жира), осуществляющийся во многих клетках. Липолиз – это процесс распада (мобилизация) триацилглицеролов (жира). Гепатозы ‒ это группа заболеваний печени, в основе которых лежит нарушение обмена веществ в гепатоцитах и развитие в этих клетках дистрофических изменений. Стеатоз печени ‒ это наиболее распространённый гепатоз, при котором в печёночных клетках происходит накопление жира. Липотропные вещества ‒ это важные факторы (инозитол, серин, холинр, этаноламин, полиненасыщенные жирные кислоты, метионин, пиридоксин, цианкобаламин), способствующие нормализации обмена липидов и холестерола в организме, стимулирующие мобилизации жира из печени и его окисление, что ведёт к уменьшению степени выраженности жировой инфильтрации печени. Липопротеины ‒ это комплексы, состоящие из белков (аполипопротины) и липидов. Различают 4 основных класса липопротеинов (ЛПВП, ЛПНП, ЛПОНП, хиломикроны). Атеросклероз – это хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного и белкового обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеинов в просвете сосудов. Коэффициент атерогенности ‒ это показатель состава крови, который отражает соотношение между липопротеидами высокой плотности и низкомолекулярными липопротеидами. Активация и транспорт жирных кислот в митохондрии. Роль карнитина. β-окисление насыщенных жирных кислот с четным числом атомов углерода Процесс β-окисления представляет собой специфический путь деградации жирных кислот. Он является одним из главных источников энергии, служащей для синтеза АТФ. β-Окисление было открыто в 1904 году немецким химиком Францем Кноопом. Этот путь называется β-окисление, т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С1 и С2 исходной жирной кислоты Элементарная схема β-окисления 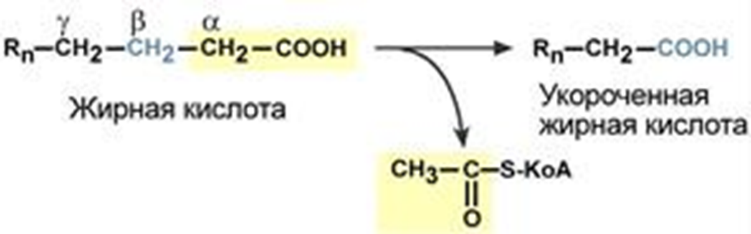 Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом: Пальмитоил-SКоА + 7ФАД + 7НАД+ + 7Н2O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН2 + 7НАДН β-Окисление представляет собой последовательность процессов: Активацию жирных кислот, происходящую в цитоплазме клетки с образованием ацил-КоА Транспортировку ацил-КоА через двойную мембрану митохондрии посредством карнитина (трансмембранный перенос) Внутримитохондриальное β-окисление (происходит в матриксе). Активация жирных кислот Жирные кислоты, которые образовались в клетке путём гидролиза триацилглицеридов или поступившие в неё из крови, должны быть активированы, так как сами по себе они являются метаболическими инертными веществами, и вследствие этого не могут быть подвержены биохимическим реакциям, включая и окисление Процесс их активирования происходит в цитоплазме при участии АТФ, кофермента А (HS-КoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой жирных кислот с длинной цепью, процесс является эндергоническим, то есть протекает за счёт использования энергии гидролиза молекулы АТФ. 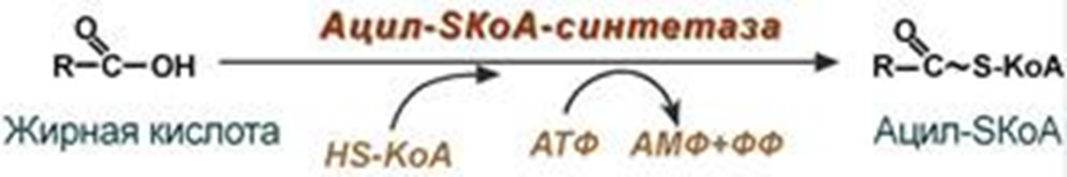 Выделившийся в ходе реакции пирофосфат гидролизуется ферментом пирофосфатазой: Н4Р2О7 + Н2О → 2 Н3РО4 Поскольку процесс активации жирных кислот происходит в цитоплазме, то далее необходим транспорт ацил-SКоА через мембрану внутрь митохондрии. Транспортировка жирных кислот через митохондриальную мембрану Транспортировка жирных кислот с длинной цепью через плотную митохондриальную мембрану осуществляется посредством карнитина (витамин В11). В наружной мембране митохондрий находится фермент карнитин-ацилтрансфераза I, катализирующий реакцию с образованием ацилкарнитина, который диффундирует через наружную митохондриальную мембрану: R-CO |