мр. Текст к лекции 2 Липиды (окончание) (1). Синтез жиров в жировой ткани и печени
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
СИНТЕЗ ЖИРОВ В ЖИРОВОЙ ТКАНИ И ПЕЧЕНИ Обмен триацилглицеролов Приём пищи человеком происходит иногда со значительными интервалами, поэтому в организме выработались механизмы депонирования источников энергии. Жиры (триглицериды) - наиболее выгодная и основная форма депонирования энергии. Запасы гликогена в организме не превышают 300 г и обеспечивают организм энергией не более суток. Депонированный жир может обеспечивать организм энергией при голодании в течение длительного времени (до 7-8 нед). Синтез жиров активируется в абсорбтивный период и происходит в основном в жировой ткани и печени. Но если жировая ткань - место депонирования жира, то печень выполняет важную роль превращения части углеводов, поступающих с пищей, в жиры, которые затем секретируются в кровь в составе ЛПОНП и доставляются в другие ткани (в первую очередь, в жировую). Синтез жиров в печени и жировой ткани стимулируется инсулином. Мобилизация жира активируется в тех случаях, когда глюкозы недостаточно для обеспечения энергетических потребностей организма: в постабсорбтивный период, при голодании и физической работе под действием гормонов глюкагона, адреналина, соматотропина. Жирные кислоты поступают в кровь и используются тканями как источники энергии. Синтез жиров происходит в абсорбтивный период в печени и жировой ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата. Биосинтез жирных кислот С пищей в организм поступают разнообразные жирные кислоты, в том числе и незаменимые. Значительная часть заменимых жирных кислот синтезируется в печени, в меньшей степени - в жировой ткани и лактирующей молочной железе. Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при распаде глюкозы в абсорбтивном периоде. Таким образом, избыток углеводов, поступающих в организм, трансформируется в жирные кислоты, а затем в жиры. 1. Синтез пальмитиновой кислоты Образование ацетил-КоА и его транспорт в цитозоль Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы: Ацетил-КоА + Оксалоацетат → Цитрат + HS-KoA. Затем транслоказа переносит цитрат в цитоплазму.  Перенос ацетильных остатков из митохондрий в цитозоль. Действующие ферменты: 1 - цитрат-синтаза; 2 - транслоказа; 3 - цитратлиаза; 4 - малатдегидрогеназа; 5 - малик-фермент. Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы: Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат. Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот, а оксалоацетат в цитозоле подвергается следующим превращениям (см. схему).  Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH - окислительные стадии пентозофосфатного пути катаболизма глюкозы. Образование малонил-КоА из ацетил-КоА - регуляторная реакция в биосинтезе жирных кислот. Первая реакция синтеза жирных кислот - превращение ацетил-КоА в малонил-КоА. Фермент, катализирующий эту реакцию (ацетил-КоА-карбоксилаза), относят к классу лигаз. Он содержит ковалентно связанный биотин (рис. 8-36).  Роль биотина в реакции карбоксилирования ацетил-КоА. В первой стадии реакции СО2 ковалентно связывается с биотином за счёт энергии АТФ, во второй стадии СОО- переносится на ацетил-КоА с образованием малонил-КоА. Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот. После образования малонил-КоА синтез жирных кислот продолжается на мультиферментном комплексе - синтазе жирных кислот (пальмитоилсинтетазе). Этот фермент состоит из 2 идентичных протомеров, каждый из которых имеет доменное строение и, соответственно, 7 центров, обладающих разными каталитическими активностями. Этот комплекс последовательно удлиняет радикал жирной кислоты на 2 углеродных атома, донором которых служит малонил-КоА. Конечный продукт работы этого комплекса - пальмитиновая кислота, поэтому прежнее название этого фермента - пальмитоилсинтетаза.  Строение мультиферментного комплекса - синтазы жирных кислот. Комплекс - димер из двух идентичных полипептидных цепей, каждый из которых имеет 7 активных центров и ацилпереносящий белок (АПБ). SH-группы протомеров принадлежат различным радикалам. Одна SH-группа принадлежит цистеину, другая - остатку фосфопантетеиновой кислоты. SH-группа цистеина одного мономера расположена рядом с SH-группой 4-фосфопантетеината другого протомера. Таким образом, протомеры фермента расположены «голова к хвосту». Хотя каждый мономер содержит все каталитические центры, функционально активен комплекс из 2 протомеров. Поэтому реально синтезируются одновременно 2 жирных кислоты. Для упрощения в схемах обычно изображают последовательность реакций при синтезе одной молекулы кислоты. Первая реакция - перенос ацетильной группы ацетил-КоА на тиоловую группу цистеина ацетилтрансацилазным центром. Затем от малонил-КоА остаток малонила переносится на сульфгидрильную группу ацилпереносящего белка малонилтрансацилазным центром. После этого комплекс готов к первому циклу синтеза. Ацетильная группа конденсируется с остатком малонила по месту отделившегося СО2. Реакция катализируется кетоацилсинтазным центром. Образовавшийся радикал ацетоацетила последовательно восстанавливается кетоацилредуктазой, затем дегидратируется и опять восстанавливается еноилредуктазой - активными центрами комплекса. В результате первого цикла реакций образуется радикал бутирила, связанный с субъединицей синтазы жирных кислот.  Синтез пальмитиновой кислоты. Синтаза жирных кислот: в первом протомере SH-группа принадлежит цистеину, во втором - фосфопантетеину. После окончания первого цикла радикал бутирила переносится на SH-группу первого протомера. Затем повторяется та же последовательность реакций, что и в первом цикле. Пальмитоил-Е - остаток пальмитиновой кислоты, связанный с синтазой жирных кислот. В синтезированной жирной кислоте только 2 дистальных атома углерода, обозначенные *, происходят из ацетил-КоА, остальные - из малонил-КоА. Перед вторым циклом радикал бутирила переносится из позиции 2 в позицию 1 (где находился ацетил в начале первого цикла реакций). Затем остаток бутирила подвергается тем же превращениям и удлиняется на 2 углеродных атома, происходящих из малонил-КоА. Аналогичные циклы реакций повторяются до тех пор, пока не образуется радикал пальмитиновой кислоты, который под действием тиоэстеразного центра гидролитически отделяется от ферментного комплекса, превращаясь в свободную пальмитиновую кислоту (пальмитат). Ацетильная группа конденсируется с остатком малонила по месту отделившегося СО2. Реакция катализируется кетоацилсинтазным центром. Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид: CH3-CO-SKoA + 7 HOOC-CH2-CO-SKoA + 14 (NADPH + H+) → C15H31COOH + 7 CO2 + 6 H2O + 8 HSKoA + 14 NADP+.  Общая схема реакций синтеза пальмитиновой кислоты. Основные источники водорода для синтеза жирных кислот В каждом цикле биосинтеза пальмитиновой кислоты проходят 2 реакции восстановления, донором водорода в которых служит кофермент NADPH. Восстановление NADP+ происходит в реакциях: • дегидрирования в окислительных стадиях пентозофосфатного пути катаболизма глюкозы; • дегидрирования малата малик-ферментом; • дегидрирования изоцитрата цитозольной NADP-зависимой дегидрогеназой. Регуляция синтеза жирных кислот Регуляторный фермент синтеза жирных кислот - ацетил-КоА-карбоксилаза. Этот фермент регулируется несколькими способами. Ассоциация/диссоциация комплексов субъединиц фермента. В неактивной форме ацетил-КоА-карбоксилаза представляет собой отдельные комплексы, каждый из которых состоит из 4 субъединиц. Активатор фермента - цитрат; он стимулирует объединение комплексов, в результате чего активность фермента увеличивается. Ингибитор - пальмитоил-КоА; он вызывает диссоциацию комплекса и снижение активности фермента.  Ассоциация/диссоциация комплексов ацетил-КоА-карбоксилазы. Фосфорилирование/дефосфорилирование ацетил-КоА-карбоксилазы. В постабсорбтивном состоянии или при физической работе глюкагон или адреналин через аденилат-циклазную систему активируют протеинкиназу А и стимулируют фосфорилирование субъединиц ацетил-КоА карбоксилазы. Фосфорилированный фермент неактивен, и синтез жирных кислот останавливается. В абсорбтивный период инсулин активирует фосфатазу, и ацетил-КоА карбоксилаза переходит в дефосфорилированное состояние.  Регуляция ацетил-КоА-карбоксилазы. Затем под действием цитрата происходит полимеризация протомеров фермента, и он становится активным. Кроме активации фермента, цитрат выполняет и другую функцию в синтезе жирных кислот. В абсорбтивный период в митохондриях клеток печени накапливается цитрат, в составе которого остаток ацетила транспортируется в цитозоль. Индукция синтеза ферментов. Длительное потребление богатой углеводами и бедной жирами пищи приводит к увеличению секреции инсулина, который стимулирует индукцию синтеза ферментов: ацетил-КоА-карбоксилазы, синтазы жирных кислот, цитратлиазы, глюкозо-6-фосфатдегидрогеназы. Следовательно, избыточное потребление углеводов приводит к ускорению превращения продуктов катаболизма глюкозы в жиры. Голодание или богатая жирами пища приводит к снижению синтеза ферментов и, соответственно, жиров.  Удлинение пальмитиновой кислоты в ЭР. Радикал пальмитиновой кислоты удлиняется на 2 углеродных атома, донором которых служит малонил-КоА. Синтез жирных кислот из пальмитиновой кислоты Удлинение жирных кислот. В ЭР происходит удлинение пальмитиновой кислоты с участием малонил-КоА. Последовательность реакций сходна с той, что происходит при синтезе пальмитиновой кислоты, однако в данном случае жирные кислоты связаны не с синтазой жирных кислот, а с КоА. Ферменты, участвующие в элонгации, могут использовать в качестве субстратов не только пальмитиновую, но и другие жирные кислоты, поэтому в организме могут синтезироваться не только стеариновая кислота, но и жирные кислоты с большим числом атомов углерода. Основной продукт элонгации в печени - стеариновая кислота (С18:0), однако в ткани мозга образуется большое количество жирных кислот с более длинной цепью - от С20 до С24, которые необходимы для образования сфинголипидов и гликолипидов. В нервной ткани происходит синтез и других жирных кислот - α-гидроксикислот. Оксидазы со смешанными функциями гидроксилируют С22 и С24 кислоты с образованием лигноцериновой и цереброновой кислот, обнаруживаемых только в липидах мозга. Образование двойных связей в радикалах жирных кислот. Включение двойных связей в радикалы жирных кислот называется десатурацией. Основные жирные кислоты, образующиеся в организме человека в результате десатурации, - пальмитоолеиновая (С16:1) и олеиновая (С18:1).  Образование ненасыщенных жирных кислот. Образование двойных связей в радикалах жирных кислот происходит в ЭР в реакциях с участием молекулярного кислорода, NADН и цитохрома b5. Ферменты десатуразы жирных кислот, имеющиеся в организме человека, не могут образовывать двойные связи в радикалах жирных кислот дистальнее девятого атома углерода, т.е. между девятым и метильным атомами углерода. Поэтому жирные кислоты семейства ω-3 и ω-6 не синтезируются в организме, являются незаменимыми и обязательно должны поступать с пищей, так как выполняют важные регуляторные функции. Для образования двойной связи в радикале жирной кислоты требуется молекулярный кислород, NADH, цитохром b5 и FAD-зависимая редуктаза цитохрома b5. Атомы водорода, отщепляемые от насыщенной кислоты, выделяются в виде воды. Один атом молекулярного кислорода включается в молекулу воды, а другой также восстанавливается до воды с участием электронов NADH, которые передаются через FADH2 и цитохром b5. Образование глицерол-3-фосфата Синтез жиров в печени и жировой ткани идёт через образование промежуточного продукта - фосфатидной кислоты. Предшественник фосфатидной кислоты - глицерол-3-фосфат, образующийся в печени двумя путями: • восстановлением дигидроксиацетонфосфата - промежуточного метаболита гликолиза; • фосфорилированием глицеролкиназой свободного глицерола, поступающего в печень из крови (продукт действия ЛП-липазы на жиры ХМ и ЛПОНП). В жировой ткани глицеролкиназа отсутствует, и восстановление дигидроксиацетонфосфата - единственный путь образования глицерол-3-фосфата. Следовательно, синтез жиров в жировой ткани может происходить только в абсорбтивный период, когда глюкоза поступает в адипоциты с помощью белка-переносчика глюкозы ГЛЮТ-4, активного только в присутствии инсулина, и распадается по пути гликолиза. Синтез жиров в жировой ткани В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП. Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацил-глицерол, который ацилируется с образованием триацил-глицерола.  Синтез жиров в печени и жировой ткани. Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот. Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг. 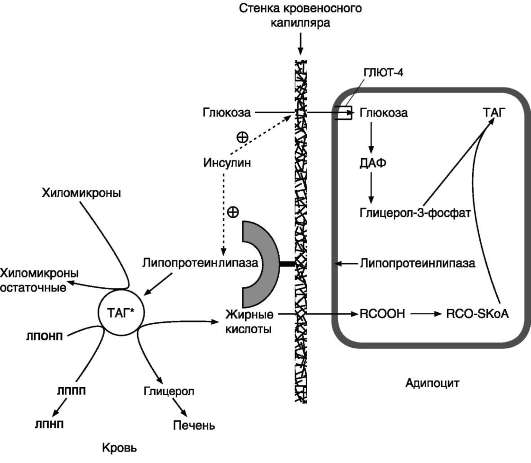 Депонирование жира в адипоцитах в абсорбтивном периоде. После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4, синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-II на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах. Сокращения: ТАГ* - триацилглицеролы в составе ХМ и ЛПОНП; ДАФ - дигидроксиацетонфосфат. |
