мр. Текст к лекции 2 Липиды (окончание) (1). Синтез жиров в жировой ткани и печени
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Характеристика биологического действия основных типов эйкозаноидов 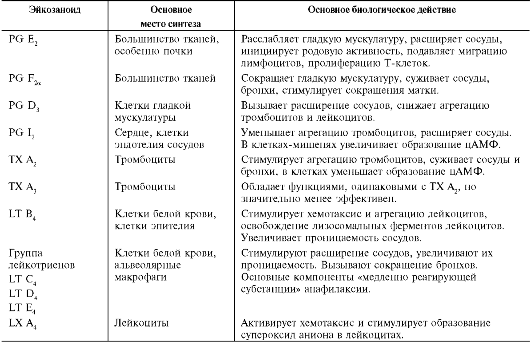 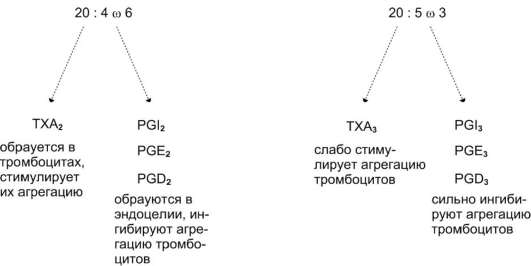 Синтез тромбоксанов и простагландинов из арахидоновой и эйкозапентаеновой кислот. Все типы эйкозаноидов быстро инактивируются. T1/2 эйкозаноидов составляет от нескольких секунд до нескольких минут. Простагландины инактивируются путём окисления гидроксильной группы в положении 15, важнейшей для их активности, до кетогруппы. Двойная связь в положении 13 восстанавливается. Затем происходит β-окисление боковой цепи, а после него - ω-окисление. Конечные продукты (дикарбоновые кислоты) выделяются с мочой. Активный ТХ А2 быстро превращается в биологически неактивный ТХ В2 путём разрыва кислородного мостика между 9-м и 11-м атомами углерода с образованием гидроксильных групп. ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ - ИНГИБИТОРЫ СИНТЕЗА ЭЙКОЗАНОИДОВ Аспирин - препарат, подавляющий основные признаки воспаления. Механизм противовоспалительного действия аспирина стал понятен, когда обнаружили, что он ингибирует циклооксигеназу. Следовательно, он уменьшает синтез медиаторов воспаления и, таким образом, уменьшает воспалительную реакцию. Циклооксигеназа необратимо ингибируется путём ацетилирования серина в положении 530 в активном центре. Однако эффект действия аспирина не очень продолжителен, так как экспрессия гена этого фермента не нарушается и продуцируются новые молекулы фермента. Другие нестероидные противовоспалительные препараты (ибупрофен) действуют по конкурентному механизму, связываясь в активном центре фермента, и также снижают синтез простагландинов.  Механизм инактивации циклооксигеназы аспирином. Ацетильный остаток переносится с молекулы аспирина на ОН-группу фермента и необратимо ингибирует его. Стероидные препараты обладают гораздо более сильным противовоспалительным действием, чем препараты нестероидного ряда. Механизм их действия заключается в индукции синтеза белков - липокортинов (или макрокортинов), которые ингибируют активность фосфолипазы А2 и уменьшают синтез всех типов эйкозаноидов, так как препятствуют освобождению субстрата для синтеза эйкозаноидов - арахидоновой кислоты (или её аналога). Использование стероидных противовоспалительных препаратов особенно важно для больных, страдающих бронхиальной астмой. Развитие симптомов этого заболевания (бронхоспазм и экссудация слизи в просвет бронхов) обусловлено, в частности, избыточной продукцией лейкотриенов тучными клетками, лейкоцитами и клетками эпителия бронхов. Приём аспирина у больных, имеющих изоформу липоксигеназы с высокой активностью, может вызвать приступ бронхиальной астмы. Причина «аспириновой» бронхиальной астмы заключается в том, что аспирин и другие нестероидные противовоспалительные препараты ингибируют только циклооксигеназный путь превращений арахидоновой кислоты и, таким образом, увеличивают доступность субстрата для действия липоксигеназы и, соответственно, синтеза лейкотриенов. Стероидные препараты ингибируют использование арахидоновой кислоты и по липоксигеназному и по циклооксигеназному пути, поэтому они не могут вызывать бронхоспазма. Хотя действие всех типов эйкозаноидов до конца не изучено, имеются примеры успешного использования лекарств - аналогов эйкозаноидов для лечения различных заболеваний. Например, аналоги PG E1 и PG E2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы II типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2-блокаторы, ускоряют заживление язв желудка и двенадцатиперстной кишки. Способность PG E2 и PG F2α стимулировать сокращение мускулатуры матки используют для стимуляции родовой деятельности. Перекисное окисление липидов, роль в патогенезе повреждений клетки Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы. К активным формам кислорода относят: - ОН* - гидроксильный радикал; - О2- - супероксидный анион; - Н2О2 - пероксид водорода. Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций – вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ). ЦПЭ – источник активных форм кислорода. Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток. Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона - KoQH'. 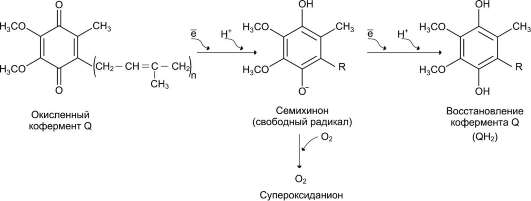 Реакции последовательного восстановления убихинона в дыхательной цепи. Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион О2-, который, в свою очередь, может превращаться в другие активные формы кислорода: 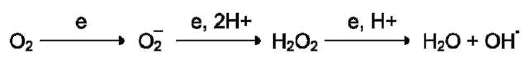 Реакции, катализируемые оксидазами и оксигеназами Многие оксидазы - ферменты, непосредственно восстанавливающие кислород, образуют пероксид водорода - Н2О2. Оксидазы образуют пероксид водорода по схеме: О2 + SH2 → S + H2O2, где SH2 - окисляемый субстрат. Примеры таких оксидаз - оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксисом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях. Монооксигеназы, например цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода. Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода - гидроксильного радикала (ОН*) по следующей реакции: Fe2+ + H2O2 → Fe3+ + OH- + OH*. Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона. ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ Свободнорадикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалентные «сшивки», всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал. Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления. Стадии перекисного окисления липидов 1) Инициация: образование свободного радикала (L•) 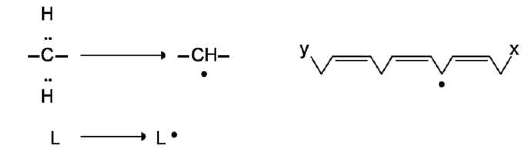 Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала. 2) Развитие цепи: L• + O2 → LOO• LOO• + LH → LOOH + L• Развитие цепи происходит при присоединении О2, в результате чего образуется липопероксирадикал LOO» или пероксид липида LOOH. ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других. 3) Разрушение структуры липидов Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты. 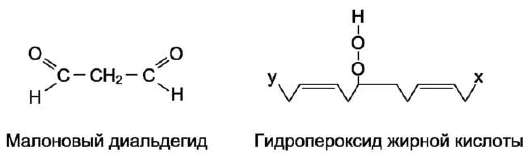 4) Обрыв цепи - взаимодействие радикалов между собой: LOO• + L• → LOOH + LH L• + vit E → LH + vit Ε• vit Ε• + L• → LH + vit Εокисл. Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму. ПОВРЕЖДЕНИЕ КЛЕТОК В РЕЗУЛЬТАТЕ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении. Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления. Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ковалентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции. ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липиды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи. СИСТЕМЫ ЗАЩИТЫ КЛЕТОК ОТ АКТИВНЫХ ФОРМ КИСЛОРОДА Ферменты антиоксидантного действия К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода: 2 О2- + 2 Н+ → Н2О2 + О2. Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление. Пероксид водорода, который может инициировать образование самой активной формы ОН*, разрушается ферментом каталазой: 2 Н2О2 → 2 Н2О + О2. Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва». Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода, и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамил-цистеинилглицин). Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу: Н2О2 + 2 GSH → 2 H2O + G-S-S-G. Окисленный глутатион восстанавливается глутатионредуктазой: GS-SG + NADPH + H+ → 2 GSH + NADP+. Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается. Витамины, обладающие антиоксидантным действием Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (LOO*), восстанавливая его до гидропероксида (LOOH) и таким образом останавливает развитие ПОЛ. Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму - токоферолхинон. 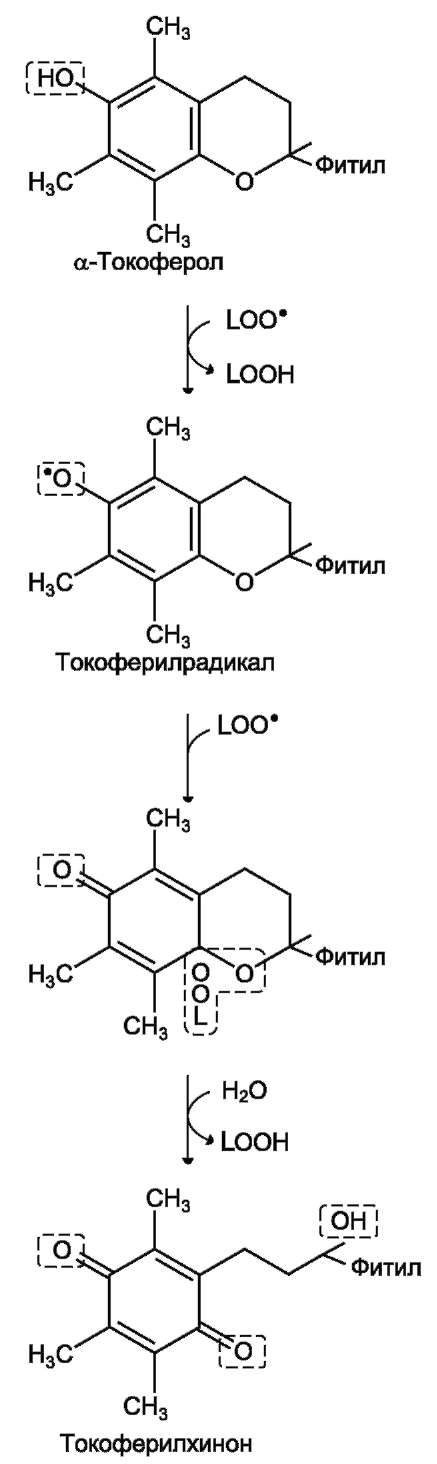 Механизм антиоксидантного действия витамина Е. Витамин Е (aльфа-токоферол) ингибирует свободнорадикальное окисление путём отдачи электрона, что приводит к инактивации радикала липида, а витамин Е превращается в стабильный, полностью окисленный токоферолхинон. Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода - О2-, Н2О2, ОН* и инактивирует их. β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, каротиноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток. |
