мр. Текст к лекции 2 Липиды (окончание) (1). Синтез жиров в жировой ткани и печени
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Вторичное ожирение Ожирение, развивающееся в результате какого-либо основного заболевания, чаще всего эндокринного. Например, к развитию ожирения приводят гипотиреоз, синдром Иценко-Кушинга, гипогонадизм и многие другие заболевания. ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ Желчнокаменная болезнь - патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол. Выделение холестерола в жёлчь должно сопровождаться пропорциональным выделением жёлчных кислот и фосфолипидов, удерживающих гидрофобные молекулы холестерола в жёлчи в мицеллярном состоянии. 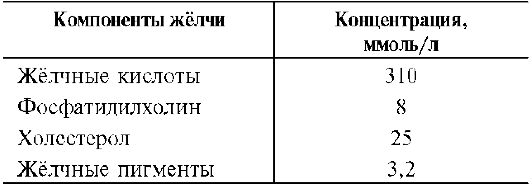 У большинства больных желчнокаменной болезнью активность ГМГ-КоА-редуктазы повышена, следовательно, увеличен синтез холестерола, а активность 7-а-гидроксилазы, участвующей в синтезе жёлчных кислот, снижена. В результате синтез холестерола увеличен, а синтез жёлчных кислот из него замедлен, что приводит к диспропорции количества холестерола и жёлчных кислот, секретируемых в жёлчь. Если эти пропорции нарушены, то холестерол начинает осаждаться в жёлчном пузыре, образуя вначале вязкий осадок, который постепенно становится более твёрдым. Иногда он пропитывается билирубином - продуктом распада гема, белками и солями кальция. Камни, образующиеся в жёлчном пузыре, могут состоять только из холестерола (холестериновые камни) или из смеси холестерола, билирубина, белков и кальция. Холестериновые камни обычно белого цвета, а смешанные камни - коричневого цвета разных оттенков. Причин, приводящих к изменению соотношения жёлчных кислот и холестерола, в жёлчи много: пища, богатая холестеролом, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушение энтерогепатической циркуляции, нарушение синтеза жёлчных кислот, инфекции жёлчного пузыря. Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает как приступ сильной боли. Если камень перекрывает проток некоторое время, то нарушается поступление жёлчи в кишечник, жёлчные пигменты проходят через мембраны гепатоцитов в сторону синусоидов и попадают в кровь, что приводит к развитию обтурационной (подпечёночной желтухи). ДИСЛИПОПРОТЕИНЕМИИ. ГИПЕРХОЛЕСТЕРОЛЕМИЯ И РАЗВИТИЕ АТЕРОСКЛЕРОЗА Дислипопротеинемии - нарушения обмена ЛП крови и, соответственно, нарушения обмена липидов, транспортируемых ЛП. Дислипопротеинемии проявляются чаще всего повышением концентрации либо одного типа ЛП, либо сочетанным увеличением содержания нескольких типов ЛП. В настоящее время имеется несколько классификаций дислипопротеинемий. Наиболее распространены нарушения обмена холестерола и триацилглицеролов. 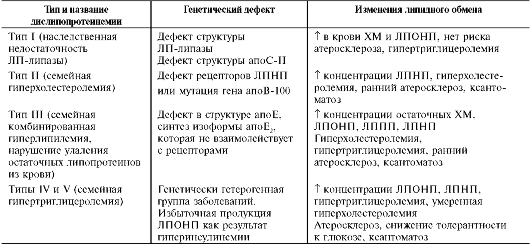 Нарушения обмена холестерола чаще всего приводят к гиперхолестеролемии и последующему развитию атеросклероза. При атеросклерозе происходит образование на стенках артерий, так называемых атеросклеротических бляшек, представляющих собой в основном отложения холестерола. Атеросклеротические бляшки разрушают клетки эндотелия сосудов, и в таких местах часто образуются тромбы. Атеросклероз - полигенное заболевание. Одна из основных причин развития атеросклероза - нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. Выведение холестерола ограничено, не превышает 1,2-1,5 г/сут, а поступление с пищей при неправильном питании может превысить этот барьер, поэтому с возрастом постепенно происходит накопление холестерола в организме. Важным фактором развития атеросклероза являются генетические дефекты белков и ферментов, участвующих в обмене холестерола. Гиперхолестеролемия Концентрация холестерола в крови взрослых людей должна быть <200 мг/дл (<5,2 ммоль/л) и, часто, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией. Гиперхолестеролемия обычно развивается вследствие избыточного поступления холестерола с пищей, а также углеводов и жиров. Гиперкалорийное питание - один из распространённых факторов развития гиперхолестеролемии, так как для синтеза холестерола необходимы только ацетил-КоА, АТФ и NADРН. Все эти субстраты образуются при окислении глюкозы и жирных кислот, поэтому избыточное поступление этих компонентов пищи способствует развитию гиперхолестеролемии. В норме поступление холестерола с пищей снижает синтез собственного холестерола в печени, однако с возрастом эффективность регуляции у многих людей снижается. Правильное питание в течение всей жизни важнейший фактор профилактики гиперхолестеролемии. Доказана корреляция между увеличением концентрации холестерола в плазме крови и смертностью от инфаркта миокарда и инсульта, развивающихся в результате атеросклероза. Семейная гиперхолестеролемия Любой дефект рецептора ЛПНП или белка апоВ-100, взаимодействующего с ним, приводит к развитию наиболее распространённого наследственного заболевания - семейной гиперхолестеролемии. Причиной этого аутосомно-доминантного заболевания выступают указанные выше мутации в гене рецептора ЛПНП. Гетерозиготы, имеющие один нормальный ген, а другой дефектный, встречаются с частотой 1:500 человек, у некоторых народностей Африки - даже 1:100 человек. Количество рецепторов ЛПНП на поверхности клеток у гетерозигот снижено вдвое, а концентрация холестерола в плазме, соответственно, вдвое повышается. У гетерозигот концентрация холестерола в крови в 35-40 лет достигает 400-500 мг/дл, что приводит к выраженному атеросклерозу и ранней смерти в результате инфаркта миокарда или инсульта. Гомозиготы встречаются редко - 1:1 000 000 человек. Концентрации холестерола и ЛПНП в крови таких больных уже в раннем детском возрасте увеличены в 5-6 раз. ЛПНП захватываются макрофагами путём фагоцитоза. Макрофаги, нагруженные избытком холестерола и других липидов, содержащихся в ЛПНП, откладываются в коже и даже сухожилиях, образуя так называемые ксантомы. Холестерол откладывается также и в стенках артерий, образуя атеросклеротические бляшки. Такие дети без экстренных мер лечения погибают в возрасте 5-6 лет. Лечение данной формы заболевания проводят путём удаления ЛПНП из крови с помощью плазмафереза, но наиболее радикальный метод лечения - трансплантация печени. Печень донора с нормальным количеством рецепторов ЛПНП существенно понижает концентрацию холестерола в крови и предотвращает раннюю смерть от атеросклероза. Кроме генетических дефектов рецептора ЛПНП, причинами гиперхолестеролемии и, следовательно, атеросклероза являются наследственные дефекты в структуре апоВ-100, а также повышенные синтез или секреция апоВ-100 в случае семейной комбинированной гиперлипидемии, при которой в крови повышены концентрации и холестерола и триацилглицеролов. ЭЙКОЗАНОИДЫ Эйкозаноиды - биологически активные вещества, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов (слово «эйкоза» по гречески означает 20). Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, - высокоактивные регуляторы клеточных функций. Они имеют очень короткий T1/2, поэтому оказывают эффекты как «гормоны местного действия», влияя на метаболизм продуцирующей их клетки по аутокринному механизму, и на окружающие клетки - по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям. Субстраты для синтеза эйкозаноидов Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота (20:4, ω-6), так как её содержание в организме человека значительно больше остальных полиеновых кислот-предшественников эйкозаноидов. В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты. Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются из незаменимых (эссенциальных) жирных кислот с 18 атомами углерода, также поступающими с пищей. Полиеновые жирные кислоты, которые могут служить субстратами для синтеза эйкозаноидов, входят в состав глицерофосфолипидов мембран. Под действием ассоциированной с мембраной фосфолипазы А2 жирная кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов. Структура, номенклатура и биосинтез простагландинов и тромбоксанов Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полиеновые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простАгландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды. Структура и номенклатура простагландинов и тромбоксанов Простагландины обозначают символами, например PG A, где PG обозначает слово «простагландин», а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида. 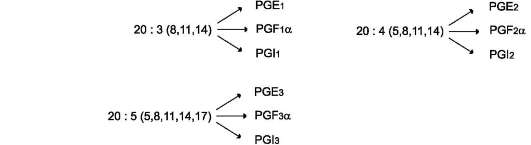 Семейства простагландинов. Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, PG E2. Число двойных связей в боковых цепях простагландинов зависит от структуры предшественника - полиеновой кислоты, из которой образовались простагландины. Две двойные связи полиеновой кислоты используются при образовании кольца в молекуле простагландина, а количество оставшихся двойных связей в радикалах, связанных с кольцом, определяет серию простагландина: 1 - если одна двойная связь, 2 - если две двойные связи и 3 - если в радикалах имеются три двойных связи. PG I - простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое - с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (PG I2, PG I3). Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба. Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода. Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2 или ТХ А3, отличающиеся по активности. ТХ В2 - продукт катаболизма ТХ А2 и активностью не обладает.  Структура тромбоксанов. ТХ А2 синтезируется из арахидоновой кислоты; ТХ А3 синтезируется из эйкозапентаеновой кислоты. Простагландины и тромбоксаны синтезируются с помощью циклооксигеназный пути. Активация фосфолипаз. Синтез простагландинов начинается только после отделения полиеновых кислот от фосфолипида мембраны под действием ферментов. Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия. Связывание стимулирующего агента с рецептором может активировать или фосфолипазу А2 или фосфолипазу С. Это зависит от типа клетки и типа рецепторов. 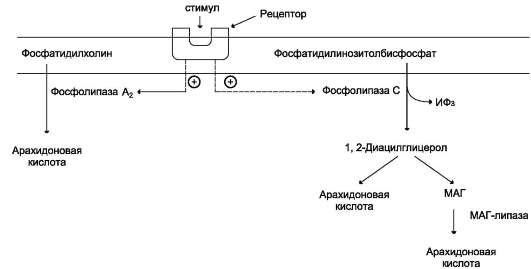 Отделение арахидоновой кислоты от глицерофосфолипидов. МАГ - моноацилглицерол; ИФ3 - инозитолтрифосфат. После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: ЦИКЛООКСИГЕНАЗНЫЙ, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и ЛИПОКСИГЕНАЗНЫЙ, заканчивающийся образованием лейкотриенов или других эйкозаноидов. 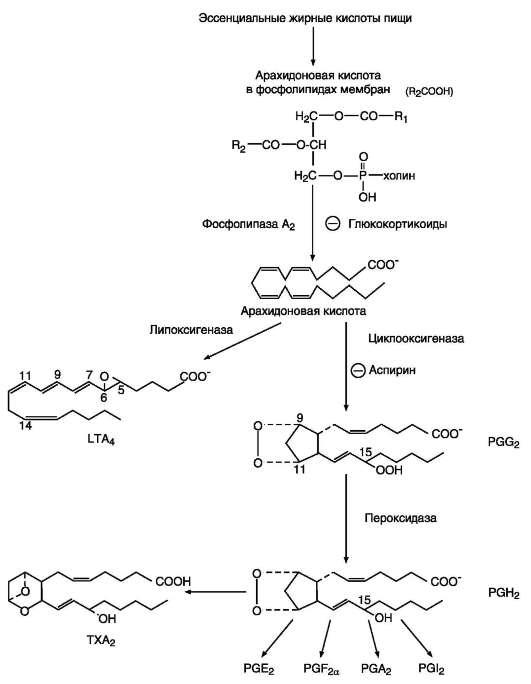 Синтез эйкозаноидов из арахидоновой кислоты. Глюкокортикоиды ингибируют синтез всех типов эйкозаноидов, так как ингибируют фосфолипазу А2, и таким образом уменьшают количество субстрата для их синтеза. Аспирин и другие противовоспалительные препараты нестероидного действия ингибируют только циклооксигеназный путь. Синтез простагландинов. Фермент, катализирующий первый этап синтеза простагландинов, называется PG Н2-синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой - пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин, в активном центре пероксидазы - простетическая группа - гем. В организме имеются 2 типа циклооксигеназ (PG Н2-синтаз). Циклооксигеназа 1 - конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами - цитокинами. Оба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое PG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием PG H2. До образования PG H2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения PG H2 специфичны для каждого типа клеток. Например, PG H2 в клетках ГМК может быть восстановлен под действием PG E синтазы с образованием PG E2 или под действием PG D синтазы с образованием PG D2. В тромбоцитах содержится фермент тромбоксансинтаза, превращающий тот же исходный PG H2 в ТХ А2, обладающий сильным сосудосуживающим действием. В клетках эндотелия под действием фермента простациклинсинтазы из PG H2 синтезируется PG I2 (простациклин), имеющий сосудорасширяющее действие. СТРУКТУРА И СИНТЕЗ ЛЕЙКОТРИЕНОВ, ГЭТЕ, ЛИПОКСИНОВ Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше. Наличие 3 сопряжённых двойных связей обусловливает название «лейкотриен». Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицил-цистеина или цистеина, соответственно. Липоксигеназный путь синтеза, приводящий к образованию большого количества разных эйкозаноидов, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидропероксидов - гидропероксидэйкозатетраеноатов (ГПЭТЕ). Далее гидропероксиды превращаются в соответствующие гидроксиэйкозатетроеноаты (ГЭТЕ). ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например: 5-ГЭТЕ, 12-ГЭТЕ. Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в ПЯЛ содержится в основном 5-липоксигеназа, в тромбоцитах - 12-липоксигеназа, в эозинофилах - 15-липоксигеназа. В лейкоцитах и тучных клетках 5-ГПЭТЕ превращается в эпоксид-лейкотриен А4 (LT A4), где нижний индекс 4 обозначает общее количество двойных связей. Другие типы лейкотриенов образуются из LТ А4. LТ В4 образуется под действием эпоксид гидролазы в лейкоцитах и клетках эпителия сосудов. Липоксины (например, основной липоксин А4) включают 4 сопряжённых двойных связи и 3 гидроксильных группы. Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4. 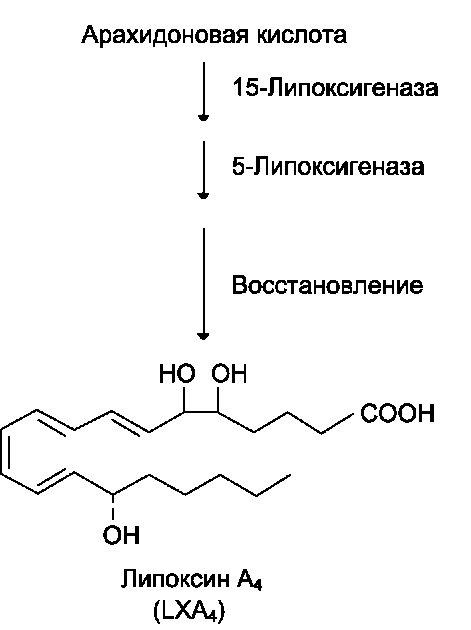 Строение и синтез липоксина А4 МЕХАНИЗМЫ ДЕЙСТВИЯ ЭЙКОЗАНОИДОВ, ОСНОВНЫЕ БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ Эйкозаноиды - гормоны местного действия по ряду признаков: • образуются в различных тканях и органах, а не только в эндокринных железах; • действуют по аутокринному или паракринному механизмам; • концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях. Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов. Один и тот же тип эйкозаноида может действовать по паракринному и по аутокринному механизму. Например, ТХ А2 (тромбоксан), продуцируемый тромбоцитами при их активации, действует на сами тромбоциты, увеличивая их способность к агрегации, и в то же время действует на окружающие ГМК кровеносных сосудов, способствуя их сокращению. Таким образом создаются условия для образования тромба и предотвращения кровотечения в области повреждения сосудов. Эйкозаноиды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозаноидов связаны с аденилатциклазной системой и протеинкиназой А - это рецепторы PGE, PG D, PC I. PG F2α, ТХ А2, эндоперекиси (ГПЭТЕ) и лейкотриены действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток-мишеней. Во многих клетках эйкозаноиды влияют на степень активации аденилатциклазной системы в ответ на действие других факторов, например гормонов. В этих случаях эйкозаноиды влияют на конформацию G-белков в плазматической мембране клеток. Если эйкозаноид связывается со стимулирующими Gs-белками, то эффект основного стимулирующего агента увеличивается; если с Gi-ингибируюигими - эффект снижается. Воспаление - реакция организма на повреждение или инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления - эйкозаноидов, гистамина, кининов (пептидных гормонов местного действия) - активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей. Фактором, лимитирующим скорость синтеза эйкозаноидов, служит освобождение жирной кислоты под действием фосфолипазы А2. Фосфолипаза А2связана с мембранами клеток и активируется многими факторами: гистамином, кининами, механическим воздействием на клетку, контактом комплекса антиген-антитело с поверхностью клетки. Активация фосфолипазы А2 приводит к увеличению синтеза эйкозаноидов. Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц. Свёртывание крови можно рассматривать как процесс, который поддерживается в состоянии равновесия противодействующими системами: свёртывания и противосвёртывания. В условиях патологии или при действии фармакологических средств это равновесие может смещаться в ту или другую сторону. В норме клетки эндотелия сосудов продуцируют простациклин I2, который препятствует агрегации тромбоцитов и сужению сосудов. При разрушении клеток эндотелия (например, в результате образования атеросклеротической бляшки) синтез PGI2 снижается. Тромбоциты контактируют с повреждённой стенкой сосуда, в результате чего активируется фосфолипаза А2. Это приводит к увеличению секреции ТХ стимулирующего агрегацию тромбоцитов и образование тромба в области повреждения сосуда, что часто приводит к развитию инфаркта. |
