Общая этиология заболеваний печени
 Скачать 1.75 Mb. Скачать 1.75 Mb.
|
|
Печень выполняет многообразные функции, поэтому нарушение ее деятельности влечет за собой ряд патологических изменений в организме. При патологии печени, с одной стороны, нарушается пищеварение, развивается интоксикация, изменяется сосудистый тонус, снижается свертываемость крови, нарушаются кроветворение, иммунологическая реактивность. С другой стороны, различные заболевания, связанные с инфекционно-токсическими факторами, нарушениями диеты, приводят к развитию патологии печени. Поэтому знание причин, вызывающих патологию печени, патологических процессов, протекающих в ней, необходимо, чтобы правильно оценить и предвидеть все многообразие изменений, наступающих в организме при заболеваниях печени. ОБЩАЯ ЭТИОЛОГИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ 1. Инфекционные агенты – гепатотропные вирусы (А, В, С, D, Е, F, G, TTV) – вирус Эпштейна-Барр, цитомегаловирус, вирус простого герпеса, вирус Коксаки и др. – некоторые инфекции вызывающие вторично нарушение функций печени (бруцеллез, лептоспироз, сальмонеллез и др.) 2. Токсические вещества: – алкоголь – промышленные яды (производные бензола, свинца, хлороформ, четыреххлористый углерод) – лекарственные препараты (антибиотики, сульфаниламиды, снотворные средства) – грибной яд (фаллоидин, фаллоин, содержащийся в бледной поганке) и афлатоксины плесневых грибов – продукты распада тканей при некрозе 3. Нарушение кровообращения в печени (гипоксия гепатоцитов) 4. Алиментарные факторы (белковое и витаминное голодание, жирная пища) 5. Эндокринные и обменные нарушения (сахарный диабет, гипертиреоз, ожирение) 6. Опухолевые поражения печени — первичные (гепатокарцинома) и метастатические (при раке желудка, легких, молочной железы, лейкозах) 7. Наследственные нарушения метаболизма(при болезни Вильсона-Коновалова, гемохроматозе, недостаточности а1-антитрипсина) и врожденные пороки анатомического положения и структуры печени Роль гепатотропных ядов в патогенезе дистрофических, онкологических и алкогольных поражений печени Имеются данные, что практически у всех пациентов, получающих тетрациклин, в гепатоцитах появляются мелкие липидные капли (мелкокапельное ожирение) — жировая дистрофия. Передозировка парацетамола ведет к некрозу печеночной паренхимы. Гепатоцеллюлярная карцинома — самая частая из всех злокачественных опухолей печени. В ее развитии патогенетическую роль приписывают афлатоксинам (канцерогенам грибкового происхождения), распространенным в ряде развивающихся стран. В некоторых странах Африки ( Мозамбик) и Юго-Восточной Азии (Корея, Тайвань, южная часть Китая) заболеваемость достигает 150 на 100 000 населения. Мужчины болеют чаще, чем женщины; в эндемичных странах Азии и Африки соотношение частоты заболеваемости по полу составляет 9:1. Алкогольный гепатит Основным метаболитом этанола является ацетальдегид (85% этанола превращается в ацетальдегид под влиянием цитозольного фермента алкогольдегидрогеназы). Ацетальдегид — химически активная молекула, способная связываться с альбумином, гемоглобином, тубулином, актином и др., формируя соединения, которые способны сохраняться в ткани печени длительный период даже после завершения метаболизма этанола. Связь ацетальдегида с белками цитоскелета может приводить к необратимым клеточным повреждениям, нарушая секрецию белка и способствуя формированию баллонной дистрофии гепатоцитов (задержка белков и воды). Кроме того, в механизме повреждения гепатоцитов под влиянием этанола выделяют следующие основные эффекты: 1. Усиление перекисного окисления липидов: повреждение клеточных мембран, повышение их проницаемости, нарушение трансмембранного транспорта, повреждениеклеточных рецепторов, мембраносвязанных ферментов. 2. Нарушение функций митохондрий (хроническое употребление алкоголя снижает активность митохондриальных ферментов, возникает разобщение окисления и фосфорилирования, что сопровождается снижением синтеза АТФ). 3. Подавление репарации ДНК в клетках и активация апоптоза. 4. Активация системы комплемента и стимуляция продукции супероксида нейтрофилами и т.д. В ряде случаев играют роль иммунные механизмы, которые включаются в том случае, если лекарства или метаболиты, выступая в качестве гаптенов, превращают белки гепатоцита в иммуногены. ОБЩИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ГЕПАТОЦИТОВ Патогенез вирусного поражения печени В патогенезе вирусного поражения необходимо учитывать взаимоотношения факторов хозяина и вируса. Факторы хозяина (генетические, возраст, исходное состояние противовирусного иммунитета) определяют тот или иной ответ на инфекцию, возможность элиминации или персистенции вируса, характер иммунного ответа. 1. Прямое повреждение: – цитолитическое действие(полное разрушение клетки вследствие репликации вирусных частиц внутри) – цитопатическое действии(повреждение клеточных органелл при сохранении клетки). 2. Иммуноопосредованное повреждение: – активация макрофаговпечени – активация цитотоксических лимфоцитов – синтез специфических антител (M- и G-классов), опосредующих комплементзависимый лизис иммунных комплексов или антителозависимую клеточную цитотоксичность. 3. Индукция апоптоза: – присоединение цитотоксических лимфоцитов к Fas-рецепторам зараженных клеток – активация апоптоза вирусными белками – повышение чувствительности инфицированных гепатоцитов к цитокинам (ФНО-α) 4. Аутоиммунный механизм: – приобретение клетками печени аутоантигеных свойств – нарушение контроля за выработкой антител (образуются аутоантитела IgM и G — маркеры аутоиммунного гепатита) – существование молекулярной мимикрии между АГ вируса и эпитопами клеток хозяина, что вызывает сенсибилизацию лимфоцитов к липопротеину печеночных мембран, митохондриальным и другим аутоантигенам. Механизм повреждения гепатоцитов токсическими агентами – прямоеповреждение гепатоцитов, в результате чего развиваются дистрофические изменения вплоть до необратимого некроза (так действует яд бледной поганки) – образованием в результате биотрансформации метаболитов, оказывающих повреждающий эффект (так действует тетрациклин, салицилаты, этанол). НАРУШЕНИЕ КРОВОСНАБЖЕНИЯ ПЕЧЕНИ 1. Нарушение артериального кровоснабжения — снижениепритока крови по a. hepatica. Тромбоз, компрессия, облитерация a. hepatica могут вызвать некроз печени, однако, чаще всего, не приводят к неблагоприятным последствиям благодаря трофической роли портального кровообращения. Особенностью архитектоники печени (описаны выше) приводит к тому, что ишемия может привести к некрозу гепатоцитов, расположенных в центральной зоне. Клетки третьей зоны активно участвуют в метаболизме и выведении лекарств, и, следовательно, гепатотоксичные препараты приводят к некрозу гепатоцитов этой зоны. 2. Нарушением портального кровоснабжения Выключение печени из портального кровообращения (при циррозе печени, облитерации ветвей воротной вены) ведет к развитию синдрома портальной гипертензии. ГЕПАТИТЫ Острые гепатиты — воспалительные заболевания печени различной этиологии, протекающие с выраженным цитолитическим и часто с мезенхемально-воспалительным синдромом. Обычно острые гепатиты заканчиваются благоприятно, небольшая часть переходит в хронические и очень малая (молниеносные формы) может заканчиваться летально. Если острый гепатит длится более 6 месяцев без заметного улучшения, то может перейти в хронический. Причины острых гепатитов – гепатотропные вирусы (А, В, С, D, Е, G, TTV) – некоторые инфекции вызывающие вторично нарушение функций печени (вирус простого герпеса, вирус Эпштейна-Барр, цитомегаловирус, вирус Коксаки, стафилококки, бруцеллез, лептоспироз, сальмонеллез и др.) – токсические факторы – лекарственные средства – алкогольное поражение  Варианты взаимоотношения вируса и клетки организма Литическая инфекция. Вирус проникает в клетку, где он освобождается от белковой оболочки и повреждает клеточный цитоплазматичеекий аппарат. В клетке синтезируется вирусный геном, и начинается размножение вируса. Вначале этот процесс идет внутри клетки, затем вирус выходит из клетки с повреждением самой клетки и ее гибелью. Это наиболее тяжелый вариант, так как идет образование большого количества антигенов, сопровождающееся гибелью собственных клеток и запуском иммунной реакции, носящей характер, как обычного иммунного ответа, так и образования большого числа аутоантигенов в связи с гибелью гепатоцитов. Таким образом, формируется аутоиммунный процесс. Персистенции инфекции. Вирус также проникает в клетку, также освобождается от белковой оболочки, также происходит узурпация аппарата клетки, но при этом, наряду с делением частиц вируса и образованием новых клеток, одновременно осуществляется и деление самой клетки. Особенностью процесса является сохранение вируса, а также частиц, внутри клетки. То же наблюдается при делении клетки: в каждой дочерней клетке оказываются частицы вируса, а выход, как в первом варианте, осуществляется только из отдельных клеток. Таким образом, этот вариант связан с образованием меньшего количества антигена, он идет с гораздо менее выраженной аутоиммунной реакцией. Острота таких процессов гораздо меньшая. Латентная инфекция. Также происходит проникновение вируса в клетку, освобождение от белковой оболочки, включение генома вируса в ядро. Далее сама клетка при своем делении копирует и себя, и вирус. Образуется большое количество клеток печени или любого друга органа, куда проник вирус, с сохранением вируса в клетке. Такое латентное течение при гепатитах встречается очень часто. Оно может быть неопределенно долгим, латентным, и только на каком-то этапе происходит «взрыв», активация размножения вируса и выброс, т.е. на данном этапе этот вариант становится идентичен первому. Исходы острых гепатитов 1. Полное выздоровление 2. Выздоровление с остаточными явлениями (постгепатитный синдром, дискинезия желчных путей, гепатофиброз) 3. Переход в хронический гепатит 4. Развитие цирроза печени 5. Риск возникновения гепатоцеллюлярной карциномы Хронический гепатит — характеризуются дистрофией гепатоцитов, гистиолимфоплазмоцитарной инфильтрацией и умеренным фиброзом портальных трактов, гиперплазией звездчатых эндотелиоцитов при сохранении дольковой структуры печени. Длительность его течения — месяцы, годы, десятки лет. Этиологическая классификация хронических гепатитов (по С.Д. Подымовой, 1993): 1. Вирусный гепатит (В, С, D, G) 2. Лекарственный гепатит 3. Токсический гепатит 4. Алкогольный гепатит 5. Генетически детерминированный или метаболический гепатит (при болезни Вильсона-Коновалова, гемохроматозе) 6. Идиопатический (аутоиммунный и др.) 7. Неспецифический реактивный гепатит 8. Вторичный билиарный гепатит при внепеченочном холестазе Аутоиммунный гепатит — одна из этиологических форм хронического гепатита, во многом сходная с аутоиммунными заболеваниями (раньше называли волчаночным, или люпоидным за сходство с СКВ). ЦИРРОЗ ПЕЧЕНИ — хроническое полиэтиологическое прогрессирующее заболевание, характеризующееся значительным уменьшением количества функционирующих гепатоцитов, нарастающим фиброзом, перестройкой нормальной структуры паренхимы и сосудистой системы печени, появлением узлов регенерации и развитием в последующем печеночной недостаточности и портальной гипертензии. Как правило, воспалительные (гепатиты) и обменно-дистрофические (гепатозы) поражения печени завершаются развитием цирроза. Наиболее частые причины смерти больных распространенными формами цирроза печени — печеночная недостаточность, осложнения портальной гипертензии, первичный рак печени и присоединение бактериальной инфекции. Этиология цирроза печени: вирусный гепатит В, С; алкоголизм, длительный холезтаз, нарушение венозного оттока из печени (синдром Бадда-Киари), иммунные нарушения («люпоидный» гепатит), интоксикации, токсическое действие лекарств (метотрексат), метаболические нарушения (болезнь Вильсона-Коновалова, гликогеноз IV типа), детский индийский цирроз, криптогенный цирроз (неясной этиологии). Классификация циррозов печени (по А.С. Логинову, Ю.Е. Блок, 1987) – по этиологии: вирусный, алкогольный, аутоиммунный, токсический, генетически обусловленный, кардиальный, вследствие внутрипеченочного холестаза, криптогенный; – по морфологии: микронодулярный, макронодулярный, смешанный, неполный септальный, билиарный; – в зависимости от стадии печеночной недостаточности: компенсированный, субкомпенсированный, декомпенсированный. Патогенез цирроза Формирование цирроза происходит в течение многих месяцев, лет и может характеризоваться как иммуновоспалительный, поддерживаемый чужеродными антигенами. Роль антигена играют, например, вирус гепатит В, алкогольный гиалин, ряд лекарств и др. Определенное значение приобретает и прямое токсическое действие ряда агентов (алкоголь и др.) на печень. В результате прямого действия этиологического фактора и развивающегося иммунного ответа наступает гибель гепатоцитов, могут возникать массивные некрозы паренхимы → на месте погибших клеток спадается ретикулиновый остов и образуется рубец; сосуды портального тракта приближаются к центральной вене, формируются сосудистые анастомозы благодаря которым кровь, минуя паренхиму долек, поступает сразу в систему печеночной вены → это приводит к ишемии с и некрозу в неповрежденных участках → продукты распада гепатоцитов стимулируют воспалительную реакцию и распространение воспалительных инфильтратов → медиаторы воспаления, стимулирующие регенерацию печени и фиброзообразование → образуются узлы регенерации → которые сдавливают сосуды и способствуют еще большему нарушению кровотока. ОСНОВНЫЕ КЛИНИКО – ЛАБОРАТОРНЫЕ СИНДРОМЫ ЦИРРОЗА: 1. Желтуха— могут диагностироваться безжелтушные формы, но при билиарном циррозе желтуха наблюдается всегда). 2. Портальная гипертензия — синдром, возникающий вследствие нарушения кровотока в воротной вене. Выделяют 3 вида портальной гипертензии: – надпеченочная — при компрессии или тромбозе печеночных вен, правожелудочковой недостаточности, перикардите; характеризуется затруднением венозного оттока от печени – внутрипеченочная — при циррозе, опухолях, эхинококкозе и других поражениях печени.
– подпеченочная — связана с тромбозом или компрессией воротной вены (рубцы, сдавление асцитической жидкостью, опухолью) либо с аномалиями ее развития. Механизм портальной гипертензии Застой крови в системе воротной вены → повышение давления в воротной вене → открытие порто-кавальных анастомозов (шунтов) → компенсаторное шунтирование крови→ последующее варикозное расширение этих сосудов → это делает стенки сосудов уязвимыми к механическим повреждениям, исходом которых могут быть желудочно-кишечные кровотечения, нередко заканчивающиеся летально. Расположение порто-кавальных анастомозов в: – нижней трети пищевода – кардиальной части желудка – передней брюшной стенке в области пупка – системе геморроидальных вен. Также характерно нарушение обезвреживание токсических веществ образующихся и всасывающихся из кишечника в печени. Развитие асцита нарушает общую гемодинамику. Проявления портальной гипертензии: Дать патогенетическую оценку симптомов портальной гипертензии значит охарактеризовать, выражением каких основных проявлений болезни – патологических или компенсаторных реакций организма – служит каждый изних. 1. Варикозное расширение вен передней брюшной стенки в области пупка (симптом «голова Медузы»): 2. Спленомегалия(увеличение размеров селезенки) и гиперспленизм(повышение функции селезенки), следствием чего являются панцитопения. 3. Асцит(скопление жидкости в брюшной полости) вследствие: – повышение давления в воротной вене; – снижение онкотического давления крови в связи с нарушением белок-синтезирующей функции печени; – нарушение лимфообращения; – вторичный альдостеронизм (вследствие снижения метаболизма в печени), что сопровождается гипернатриемией, гипокалиемией, гиперволемией. 3.Астеновегетативный синдром — слабость, утомляемость, лабильность настроения, нервозность, исхудание. 4.Геморрагический синдром — вследствиенарушения печеночного синтеза факторов коагуляционного гемостаза и неадекватной абсорбции витамина К; недостаточного ингибирования печеночных активаторов плазмина*; спленомегалии и гиперспленизма возникает тромбоцитопения. Геморрагический синдром характеризуется петехиальными кровоизлияними в коже, носовыми и маточными кровотечениями. *При поражениях печени возрастает активность фибринолитической системы (недостаточное ингибирование печеночных активаторов плазмина), может развиваться ДВС-синдром. 3. Кожный зуд является наиболее ранним и постоянным, а иногда единственным проявлением цирроза. Установлено, что медиаторами зуда являются протеазы, высвобождаемые в коже при действии желчных кислот. НАРУШЕНИЕ ЖЕЛЧЕОБРАЗОВАНИЯ И ЖЕЛЧЕВЫДЕЛЕНИЯ ЖЕЛТУХА — симптомокоплекс, сопровождающийся желтым окрашиванием кожи, склер, слизистых оболочек, возникающий при повышении содержания билирубина в крови. Прежде всего, гипербилирубинемия приводит к иктеричности склер, так как они содержат много эластина, обладающего высоким сродством к билирубину. В зависимости от происхождения желтухи делят на 3 вида: – надпеченочные (гемолитические) – печеночные (паренхиматозные) – подпеченочные (механические)  Надпеченочная — не связана с поражением печени, возникает в связи с повышенным гемолизом эритроцитов и нарушением метаболизма билирубина Причины: повышенный гемолиз эритроцитов, вследствие нарушения плазменного транспорта билирубина альбумином. Механизмы: При усиленном разрушении циркулирующих эритроцитов отмечается повышенная продукция непрямого билирубина. Печень способна метаболизировать и выделять в желчь количество билирубина, в 3-4 раза превышающее его нормальный физиологический уровень. При усиленном гемолизе эритроцитов печень не справляется ни с процессом конъюгации, с транспортом образующегося в избытке билирубина. При этом варианте желтухи билирубин, казалось бы, должен быть только неконъюгированный, поскольку речь идет о накоплении непрямого билирубина. Однако необходимо учитывать, что в печеночную клетку поступает избыточное количество билирубина, он конъюгируется, а транспортная система выведения его из клетки может оказаться недостаточной, и тогда в крови диффундирует, наряду с непрямым билирубином (увеличенное содержание которого будет обязательно преобладать) и прямого билирубина. Печеночная (паренхиматозная, гепатоцеллюлярная) — развивается при повреждении гепатоцитов. Причины: острые и хронические заболевания печени любой этиологии, тяжело протекающие инфекции, сепсис, отравления грибами, фосфором, хлороформом и другими ядами. Механизмы: 1. Нарушение захвата билирубина гепатоцитами – уменьшение в печеночной клетке содержания белков Y и Z, обеспечивающих перенос билирубина через цитоплазматическую мембрану из крови в клетку (при белковом голодании) – генетически детерминированное нарушения структуры мембраны васкулярного полюса гепатоцита, отщепления в ней свободного билирубина от связи с альбумином и перенос билирубина в гепатоцит (наследственный синдром Жильбера) → вторично не происходит конъюгация билирубина и возникает непрямая гипербилирубинемия. 2. Нарушение конъюгации билирубина с уридиндифосфоглюкуроновой кислотой в мембране ЭПР при снижении активности УДФ- глюкуронидазы, катализирующей этот процесс. Такое нарушение может быть приобретенным (повышен уровень эстрогенов, действие лекарственных средств, гипотиреоз) и наследственным. 3. Нарушение экскреции билирубина из гепатоцита в желчевыводящие пути при изменении проницаемости билиарной части цитоплазматической мембраны гепатоцита, цитолизе гепатоцитов, разрыве желчных канальцев, сгущении желчи и закупорке внутрипеченочных путей (внутрипеченочный холестаз). При повреждении печеночных клеток возникает сообщение между желчными путями, кровеносными и лимфатическими сосудами, через которое желчь поступает в кровь. Отек перипортального пространства также может способствовать обратному всасыванию желчи их желчных ходов в кровь → развивается холемический синдром. Подпеченочная (механическая, обструктивная) — развивается при возникновении препятствия току желчи по внепеченочным желчным протокам (внепеченочный холестаз). Причины: – обтурация печеночного и общего желчного протоков камнем, паразитами, опухолью – сдавление желчных протоков опухолью близлежащих органов, кистами – сужение желчных протоков послеоперационными рубцами, спайками – дискинезия желчного пузыря в результате нарушения иннервации. Механизмы: В начале развития механической желтухи печеночные клетки еще продолжают вырабатывать желчь, но отток ее по обычным путям нарушен, и она изливается в лимфатические щели, попадая оттуда в кровь. В крови повышается в основном количество связанного билирубина. Выделение уробилина с мочой отсутствует, выделение стеркобилина с калом понижено или незначительно. В крови содержатся все составные части желчи, в том числе и желчные кислоты, приводящие к развитию холемии. Кроме того, для данного вида желтухи характерна ахолия, причиной которой является стойкое нарушение выведения желчи по желчным капиллярам (что приводит к внутрипеченочному холестазу), протокам и из желчного пузыря. Холемия — синдром, характеризующийся появлением компонентов желчи в крови, главным образом, желчных кислот (гликохолевой, таурохолевой), прямого билирубина, холестерина: – ранняя иктеричность склер, кожи →повышение прямого билирубина – моча темного цвета из-за билирубинурии(прямой билирубин) – холалурия – гиперхолестеринемия – ксантомы и ксантелазмы – кожный зуд (желчные кислоты воздействуют на нервные окончания кожи) – снижение АД вследствие снижения адренореактивности сосудов и сердца, снижением базального тонуса ГМК сосудов, под влиянием желчных кислот, проникающих через гематоэнцефаличекий барьер. → повышается тонус бульбарных ядер блуждающего нерва, что потенцирует гипотензию и брадикардию – брадикардия вследствие прямого тормозного влияния желчных кислот на синоатриальный -узел – возбудимость, раздражительность, утомляемость (вследствие снижения активности тормозных нейронов коры головного мозга). – угнетение нервных центров головного и спинного мозга приводит к депрессии, нарушению суточного ритма сна и бодрствования Ахолия — синдром,для которого характерноотсутствие или значительное снижение поступления желчи в кишечнике и возникающее вследствие этого нарушение полостного пищеварения. – кал обесцвечен – стеаторея (жир в кале в результате нарушения эмульгирования и усвоения жира в кишечнике из-за дефицита желчи) – дисбактериоз и кишечная аутоинфекция и интоксикация вследствие выпадения бактерицидного действия желчи, что способствует активации процессов гниения и брожения в кишечнике и развитию метеоризма – нарушается перистальтика кишечника (запор чередуется с поносом) – нарушается белковый обмен – нарушается обмен жирорастворимых Vit (А, Д, Е, K) – нарушен синтез прокоагулянтов → геморрагический синдром 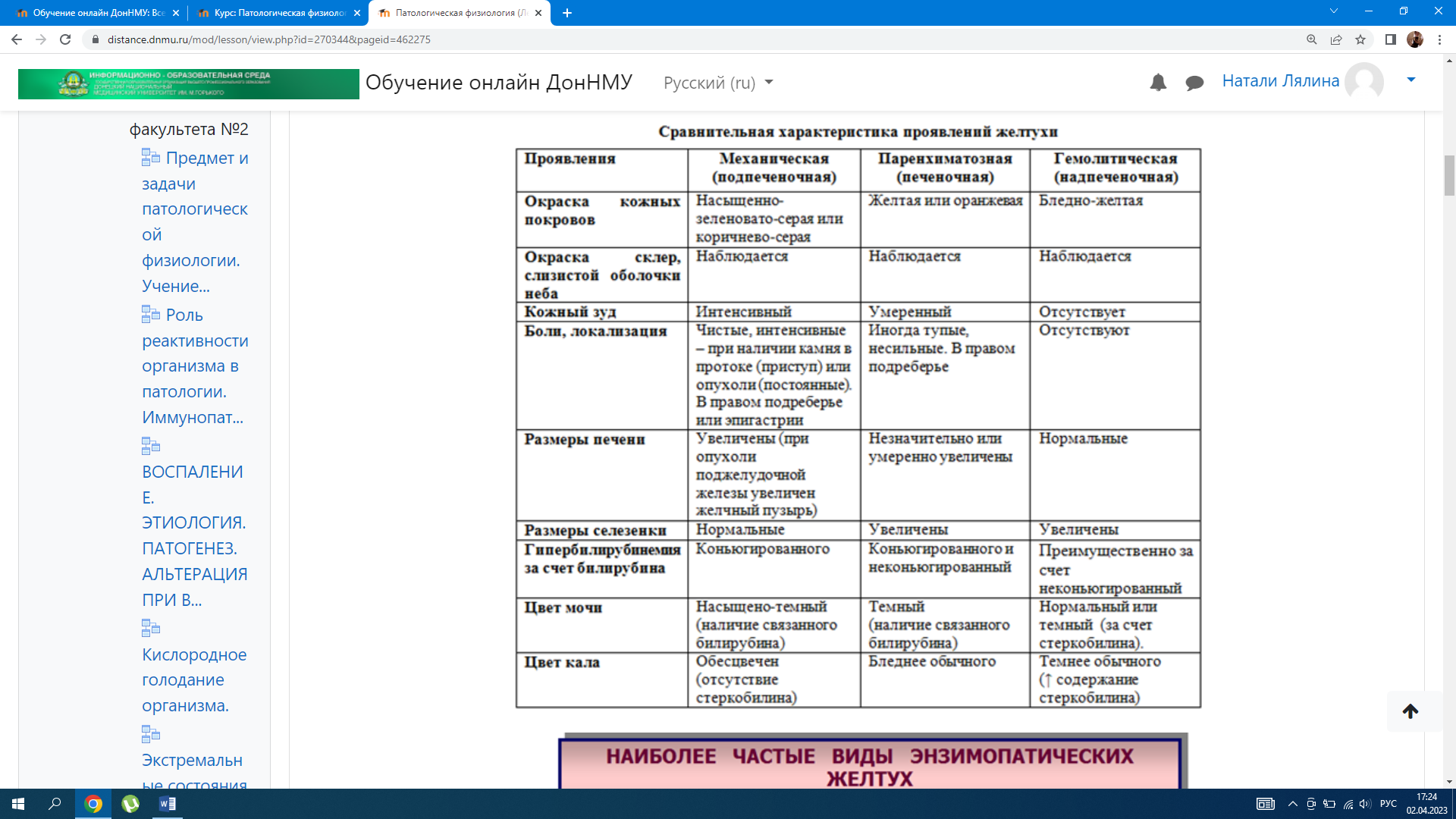 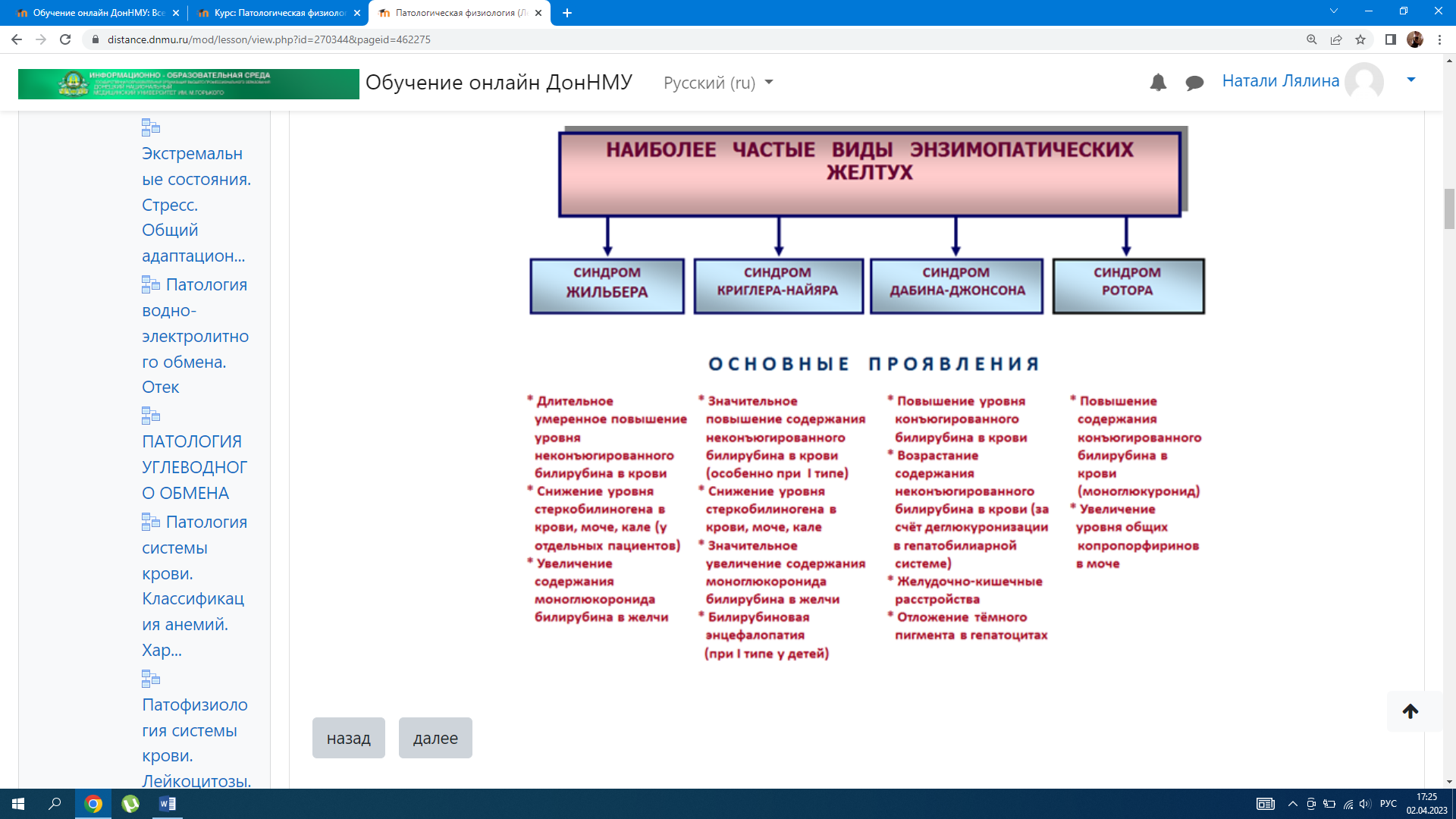 ЖЕЛЧЕКАМЕННАЯ БОЛЕЗНЬ (холелитиаз) — одно из наиболее распространенных заболеваний, занимающее третье место после сердечно-сосудистой патологии и сахарного диабета. 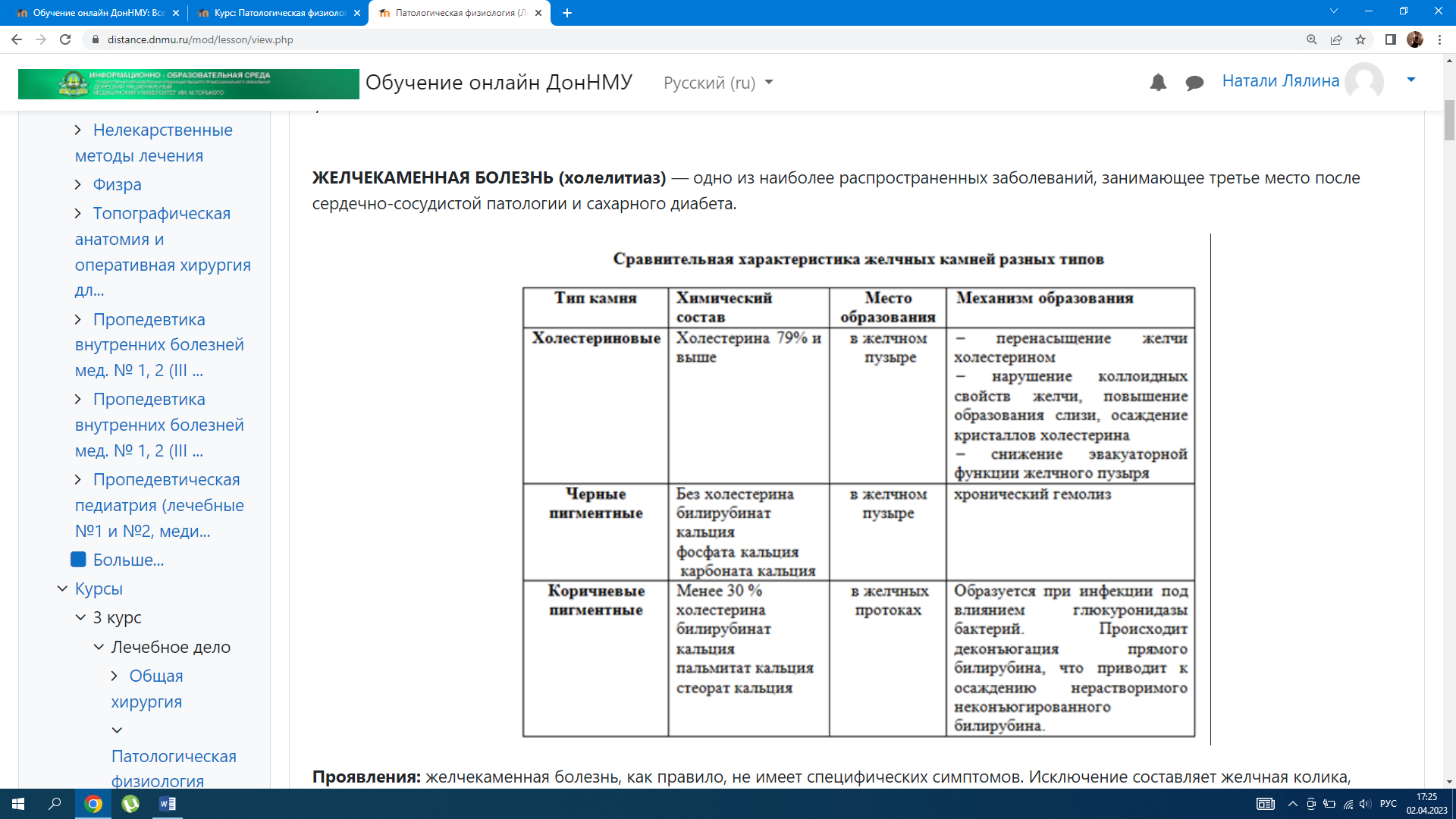 Проявления: желчекаменная болезнь, как правило, не имеет специфических симптомов. Исключение составляет желчная колика, приступы которой обычно связаны с погрешностью в диете и развиваются после обильного приема жареной, острой пищи. Причиной болезни является механическое раздражение стенки желчного пузыря и желчных протоков камнем, их перерастяжение. ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ — состояние, характеризующееся стойким снижением или полным выпадением одной, нескольких или всех функций печени, что приводит к нарушению жизнедеятельности организма в целом, может привести к → печеночной энцефалопатии → коме. Виды печеночной недостаточности 1. По масштабу повреждения: – парциальная – тотальная 2. По происхождению: – печеночно-клеточная (печеночная) — результат первичного повреждения гепатоцитов и недостаточности их функций – шунтовая (обходная) — в результате нарушения тока крови в печени и ее сбросом по портокавальным и каво-кавальным анастомозам в общий кровоток – холестатическая(экскреторная) — нарушение желчеобразовательной и желчевыделительной функции печени – смешанная 3. По скорости возникновения и развития: – молниеносная (в течение нескольких часов); – острая (в течение нескольких суток); – хроническая (в течение нескольких недель, месяцев или лет) 4. По обратимости повреждения гепатоцитов: – обратимая — при прекращении воздействия патогенного агента и устранении последствий этого воздействия; – необратимая (прогрессирующая) — в результате продолжающегося влияния причинного фактора и/или неустранимости патогенных изменений, вызванных им. Причины развития недостаточности печени 1. Печеночные — прямо повреждающие клетки печень: расстройства кровообращения, дистрофии, паразитарные поражения, гепатиты, циррозы, холестаз, опухоли, наследуемая патология печени. 2. Внепеченочные — вторично повреждающие печень: нарушения кровообращения, гипоксия, ХПН, эндокринопатии. Проявления истинной печеночно-клеточной недостаточности Синдром нарушенного питания— ухудшение аппетита, тошнота, боли в животе, неустойчивый стул, похудание, появление анемии. Синдром лихорадки(до 38 °С и даже до 40 °С) с ядерным сдвигом лейкоцитарной формулы влево. Этот синдром связан с некрозами гепатоцитов, поступлением токсических продуктов в кровь, бактериемией (возможно поступление микроорганизмов в кровь из кишечника); Синдром желтухи Синдром эндокринных расстройств.Отмечаются снижение либидо, атрофия яичек, бесплодие, гинекомастия, атрофия молочных желез, матки, нарушение менструального цикла. Возможно развитие сахарного диабета и вторичного альдостеронизма; Синдром нарушенной гемодинамики — накопление гистаминоподобных и других вазоактивных веществ, приводящее к вазодилатации (компенсаторное повышение сердечного выброса в сочетании с гипотензией). Снижение синтеза альбуминов и падение онкотического давления, а также развитие вторичного гиперальдостеронизма обусловливают отечно-асцитический синдром. Специфический печеночный запах (fetor hepaticis)связан с выделением метилмеркаптана. Это вещество образуется из метионина, который накапливается в связи с нарушением в печени процессов деметилирования и может содержаться в выдыхаемом воздухе.
«Печеночные знаки»— телеангиэктазии (сосудистые звездочки) и пальмарная эритема (симметричное покраснение ладоней, а иногда и подошв); Синдром геморрагического диатеза — снижение синтеза факторов свертывания крови и частые кровотечения обусловливают возможность развития ДВС-синдрома. Гепаторенальный синдром — почечная недостаточность Печеночная энцефалопатия (гепатоцеребральный синдром) — нервно-психическое расстройства с нарушением интеллекта, сознания, рефлекторной деятельности и функций жизненно важных органов. Печеночная кома— это терминальная стадия печеночной энцефалопатии, характеризующаяся утратой сознания, отсутствием рефлексов и нарушением основных функций органов. Патогенез печеночной энцефалопатии и комы 1. Гипогликемия в результе нарушения гликогенеза и гликогенолиза. 2. Ацидоз — метаболический, на финальных стадиях дополнительно развивается респираторный и выделительный ацидоз. 3. Дисбаланс ионов в клетках, интерстициальной жидкости и в крови (в крови нарастает [K+], в клетках — [Na+], [Ca 2+], [H+]). 4. Интоксикация организма. При печеночной недостаточности наблюдается повышение концентрации аммиака не только в крови, но и в мозговой жидкости. Поступление катионов аммония через гематоэнцефалический барьер в нейроны головного мозга вызывает их энергетическое голодание (аммиак соединяется с α-кетоглутаровой кислотой с образованием глутамина, вследствие этого наблюдается отток α-кетоглутарата из ЦТК, что приводит к снижению синтеза АТФ) и как следствие к нарушению функции клеток ЦНС. Кроме аммиака церебротоксическим действием обладают индол, скатол, жирные кислоты, производные пировиноградной и молочной кислот. Жирные кислоты взаимодействую с мембранами нервных клеток, тормозят передачу нервного возбуждения в ганглиях. 5. Нарушения гемоциркуляции как следствие сердечной недостаточности, нарушения тонуса артериол, развития феномена сладжа. 6. Полиорганная недостаточность. Ранее всего и наиболее выраженно нарушается функции сердца, дыхательного и кардиовазомоторного центров. Последнее приводит к смешанной гипоксии, прекращению сердечной деятельности, дыхания и смерти пациента. 7.Образование ложных нейротрансмиттеров (transmitto - передаю). октопамин, β-фенилэтиламин и др. приводит к вытеснению норадреналина и допамина и прерыванию передачи возбуждения в синапсах. 3. Усиленная ГАМКергическая передача — нарушается клиренс ГАМК в печени. ГАМК накапливается в ткани мозга, оказывая ингибирующий эффект на нейроны, нарушая их функцию, что приводит к развитию печеночной энцефалопатии. Нарушение функций печени при печеночной недостаточности Нарушение обезвреживающей и клиренсной функций печени — приводит к эндотоксемиикоторая проявляется лихорадкой, лейкоцитозом, гемолизом эритроцитов, почечной недостаточностью, что особенно выражено при печеночной коме. Нарушение обмена веществ: 1. Углеводного обмена — гипергликемия и снижение толерантности к глюкозе. Уровень инсулина в плазме или в норме, или повышен, что связано с устойчивостью к нему. Устойчивость к инсулину объясняется абсолютным снижением способности печени метаболизировать глюкозу после нагрузки вследствие уменьшения массы функционирующих гепатоцитов. У больных циррозом печени снижение реакции на инсулин, возможно, связано с рецепторными и пострецепторными аномалиями в гепатоцитах. При тяжелом остром гепатите, как правило, отмечается гипогликемия, а при циррозах печени это наступает в конечной стадии — при печеночной недостаточности, что объясняется снижением способности печени (из-за обширного поражения ее паренхимы) синтезировать гликоген и уменьшением выработки инсулиназы (фермента, разрушающего инсулин). Уменьшается роль углеводов как источника энергии и увеличивается роль жиров. Это сопровождается мобилизацией триацилглицеролов в качестве источника энергии. 2. Белкового и ферментного обменов: нарушаентся расщепления белков и синтез белков, дезаминирование, трансаминирование, декарбоксилирование аминокислот, образования мочевины, мочевой кислоты, аммиака, креатина, синтеза факторов свертывания и ингибиторов коагуляции и фибринолиза. Увеличение остаточного азота и аммиака в крови обнаруживается при нарушении синтеза мочевины (показатель тяжелой печеночной недостаточности). 3. Липидного обмена: – нарушением расщепления и всасывания жиров пищи в кишечнике – нарушением синтеза и окисления триацилглицеролов, фосфолипидов, липопротеинов, холестерина – увеличением образования кетоновых тел. Повреждение гепатоцитов вызывает снижение содержания холестерина, его эфиров и приводит к уменьшению продукции желчных кислот. При ряде заболеваний печени снижается и синтез липопротеинов, что ведет к накоплению триацилглицеридов с последующей инфильтрацией и жировой дистрофией печени. Причинами возникновения этого состояния, в частности, является недостаток в пище липотропных веществ (холина — составной части лецитина, метионина или участвующих в их синтезе витамина В12, фолиевой кислоты). 4. Обмена гормонов: нарушение синтеза и инактивации гормонов, транспортных белков, инактивации БАВ. Поражение печени и нарушение инактивации таких гормонов, как инсулин, тироксин, кортикостероиды, андрогены, эстрогены ведет к изменению их содержания в крови и развитию соответствующей эндокринной патологии. 4. Обмена витаминов: уменьшением всасывания жирорастворимых витаминов (ретинола, эргокальциферола, токоферола и др.) в результате нарушения желчевыделительной функции печени; нарушением синтеза витаминов и образования активных форм (ретинола из каротина, активных форм витамина В6 и др.); нарушением депонирования витаминов (цианокобаламина, фолиевой, никотиновой кислот и др.) и их экскреции. В результате нарушения обмена витаминов многие патологические процессы в печени могут сопровождаться гиповитаминозами. Нарушения состава и физико-химических свойств крови при печеночной недостаточности: снижение альбумина, снижение факторов свертывания, снижение холестерина, повышение билирубина, повышение активности аминотрансфераз, накопление фенола, аммиака. Печеночная кома — экстремальное состояние организма, возникающее как исход печеночной недостаточности и печеночной энцефалопатии, характеризующееся потерей сознания, отсутствием рефлексов и нарушением основных функций органов. Клинико-лабораторные методы исследования для диагностики недостаточности печени Для оценки функционального состояния печени, используют комплекс лабораторных исследования, известных как печеночные пробы. Они отражают: целостность гепатоцитов , синтетическую, экскреторную и обезвреживающую функцию. Индикаторы цитолитического синдрома (ЦС) — повреждение клеток печени в первую очередь цитоплазмы, но также и органоидов клетки с выраженным нарушением проницаемости мембран. ЦС относится к основным показателям активности патологического процесса в печени. Индикаторы ЦС представлены в основном рядом ферментов сыворотки крови: 1. Аспартатаминотрансфераза (AcAT). 2. Аланинаминотрансфераза (АлАТ). 3. Гаммаглутамилтранфераза (ГГТФ). 4. Глутаматдегидрогеназа (ГДГ). 5. Лактатдегидрогеназа (ЛДГ). Начало формы Начало формы Конец формы |
