Арены. Общая формула CnH2n6 при n 6
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
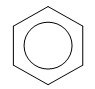
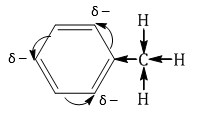
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Общая формула: CnH2n–6 при n ≥ 6. Строение, номенклатура и изомерия ароматических углеводородов Способы получения ароматических углеводородов Химические свойства ароматических углеводородов Строение аренов Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н. Структурная формула бензола:  Сокращенная структурная формула бензола:  Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации. 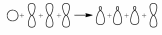 Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200: 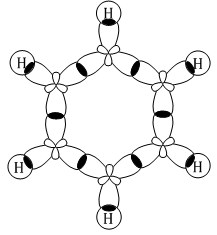
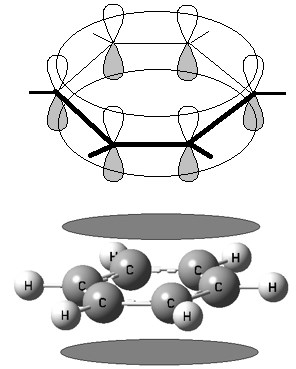 Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь). Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
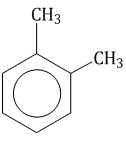
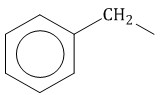
 Гомологический ряд аренов Простейший представитель гомологического ряда аренов — бензол: 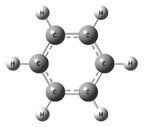 Ближайший гомолог бензола – толуол (метилбензол): 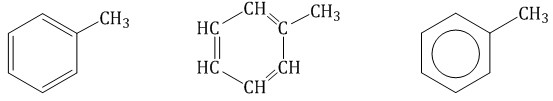 Еще один представитель гомологического ряда бензола – этилбензол: 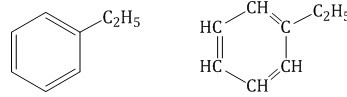 Изопропилбензол (кумол): 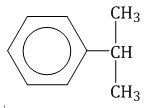 Номенклатура аренов Первый представитель гомологического ряда аренов — бензол:  Ближайший гомолог бензола – толуол (метилбензол): 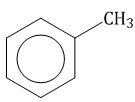 При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
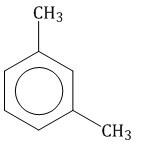
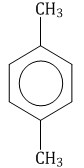
 Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок: орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения); мета— (м-) заместители расположены через один атом углерода (1,3-положения); пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов Структурная изомерия Для гомологов бензола характерна структурная изомерия . Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул. Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Химические свойства аренов Арены– непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов. Для ароматических углеводородов характерны реакции: присоединения, замещения, окисления (для гомологов бензола).
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей. 1. Реакции присоединения Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора. 1.1. Гидрирование Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.). При гидрировании бензола образуется циклогексан:  При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан: 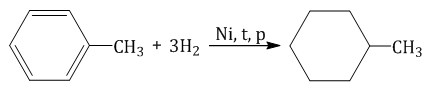 1.2. Хлорирование аренов Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения. При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).  Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено. Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
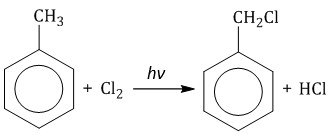
 2. Реакции замещения
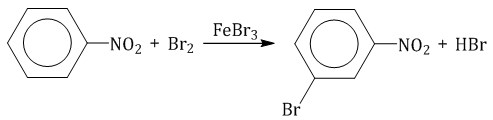
2.1. Галогенирование Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3). При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол: 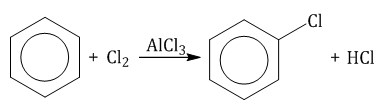 Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо. Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола: 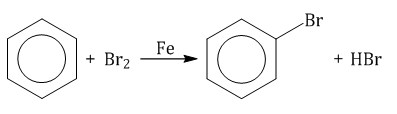
 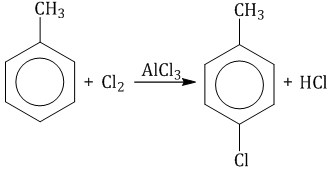 Мета-хлортолуол образуется в незначительном количестве. При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале. 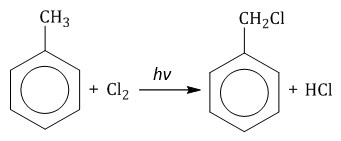
Например, при хлорировании этилбензола: 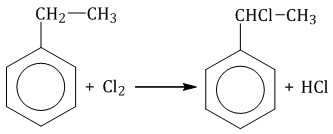 2.2. Нитрование Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь). При этом образуется нитробензол: 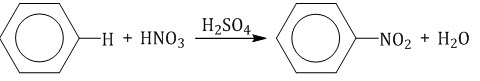
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты. В продуктах реакции мы указываем либо о-нитротолуол:  либо п-нитротолуол: 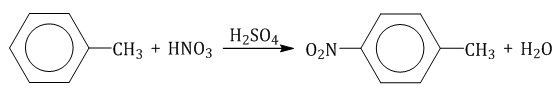 Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол): 2.3. Алкилирование ароматических углеводородов Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
 Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
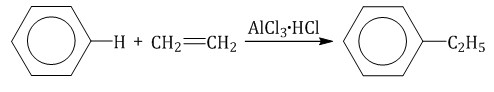
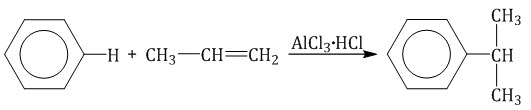 Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
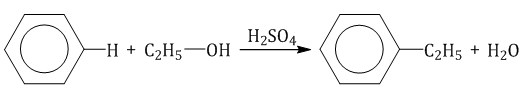 2.4. Сульфирование ароматических углеводородов Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты: 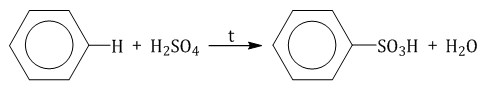 3. Окисление аренов Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят. 3.1. Полное окисление – горение При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты. 2C6H6 + 15O2 → 12CO2 + 6H2O + Q Уравнение сгорания аренов в общем виде: CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С. Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси. 3.2. Окисление гомологов бензола Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании. При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом. Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты: Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия: Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты: 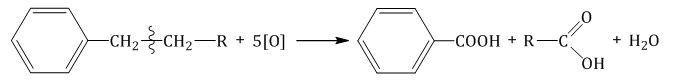 При окислении пропилбензола образуются бензойная и уксусная кислоты: 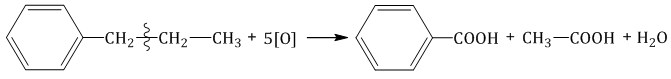 Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа: 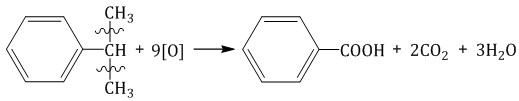 4. Ориентирующее действие заместителей в бензольном кольце Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Типы заместителей в бензольном кольце
 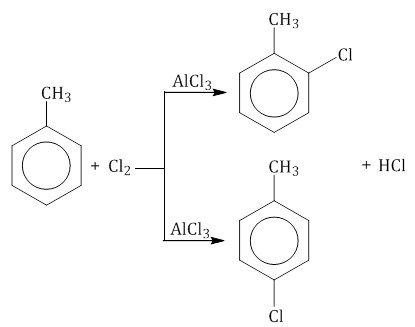 В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
 5. Особенности свойств стирола Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе. 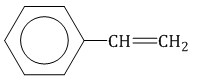 Общая формула гомологического ряда стирола: CnH2n-8.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
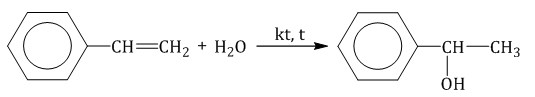
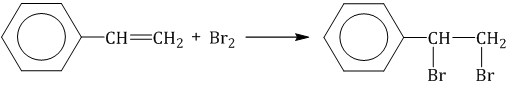 При полимеризации стирола образуется полистирол: 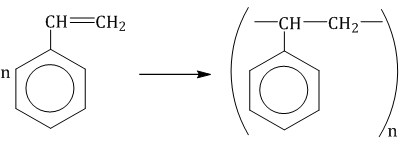 Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол: При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ: 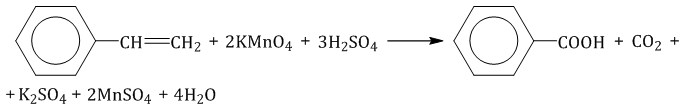 При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат: Получение аренов 1. Реакция Вюрца-Фиттига Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол: 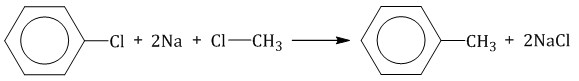 2. Дегидроциклизация алканов Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды. Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол: 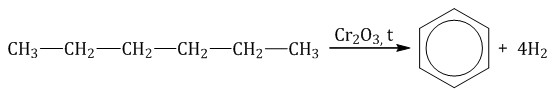 Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол: 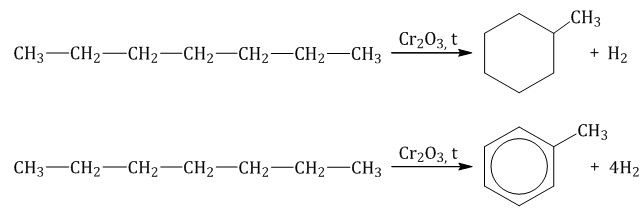 3. Дегидрирование циклоалканов При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
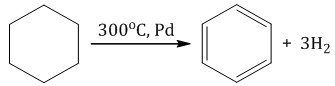
 4. Декарбоксилирование солей бензойной кислоты Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия: 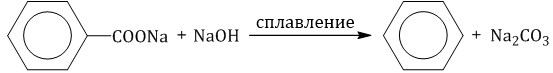 5. Алкилирование бензола и его гомологов Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
 Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
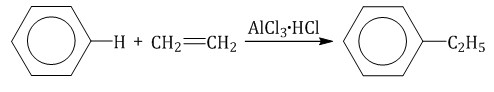
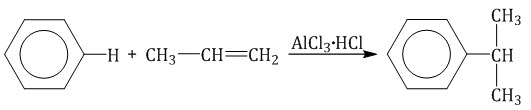 Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
 6. Тримеризация ацетилена При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.  При тримеризации пропина образуется 1,3,5-триметилбензол. 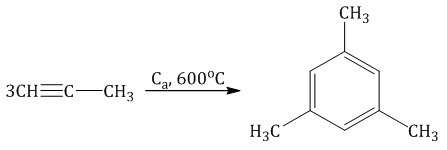 7. Получение стирола Стирол можно получить дегидрированием этилбензола: 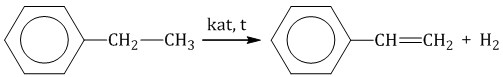 Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан): 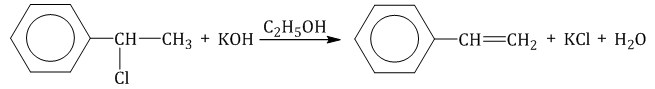 |