неметаллы. НЕМЕТАЛЛЫ. Общая характеристика, физические и химические свойства неметаллов
 Скачать 0.85 Mb. Скачать 0.85 Mb.
|
|
ТЕХНОЛОГИЧЕСКАЯ КАРТА Тема: Общая характеристика, физические и химические свойства неметаллов. Условные обозначения: ПСХЭ – периодическая система химических элементов Д.И.Менделеева ē – электрон неМе – неметалл Э.О. – электроотрицательность А. – аллотропия Х.р. – химическая реакция 1. Положение неметаллов в ПСХЭ.
 Ответьте на вопросы: 1) укажите число неметаллических элементов; 2) укажите номера групп, где расположены неметаллические элементы; 3) в каких подгруппах размещены неметаллические элементы; 4) назовите диагональные неметаллические элементы; 5) в какой части таблицы размещены неметаллические элементы. Выводы: 1) известно _______ неметаллических элементов; 2) неметаллические элементы размещены в _________________ группах; 3) неметаллические элементы размещены в _________________ подгруппах; 4) диагональные неметаллические элементы ___________________________; 5) неметаллические элементы размещены в __________________ углу таблицы над диагональю ________ . 2. Строение атомов неметаллов.
Ответьте на вопросы: КАК ИЗМЕНЯЕТСЯ В ПЕРИОДАХ СЛЕВА НАПРАВО 1) число валентных электронов неметаллических элементов ; 2) валентность неметаллических элементов; 3) высшая степень окисления неметаллических элементов; 4) низшая степень окисления неметаллических элементов; 5) приведите примеры исключений по пунктам (2), (3) и (4). Выводы: В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) число валентных электронов неметаллических элементов изменяется от значения _______ до значения _______; 2) высшая валентность неметаллических элементов изменяется от значения _______ до значения ______; 3) высшая степень окисления неметаллических элементов изменяется от значения _________ до значения ______________; 4) низшая степень окисления элемента определяется с помощью приема __________________________________________________________________, и изменяется от значения _________ до значения ______________; способность атомов неметаллических элементов присоединять электроны ___________________________________________; 5) некоторые исключения: __________, валентность _____ , степень окисления ___________ __________, валентность _______, степень окисления ___________, __________, валентность ______, степени окисления ___________ . 3. Закономерности изменения свойств КАК ИЗМЕНЯЕТСЯ В ПЕРИОДАХ СЛЕВА НАПРАВО 1) радиус атомов элементов; 2) значение электроотрицательности элементов; 3)окислительная способность (способность присоединять электроны) неметаллических элементов; 4)активность неметаллических элементов; 5) в каком направлении в главных подгруппах Ra уменьшается,значение ЭО увеличивается, активность неметаллических элементов усиливается Выводы: В ПЕРИОДАХ СЛЕВА НАПРАВО: 1) радиус атома (Ra) ________________________________________________ 2)значение электроотрицательности (ЭО) ______________________________ 3) окислительная способность (способность присоединять электроны) 4) активность неметаллических элементов ____________________________ 5) В ГЛАВНЫХ ПОДГРУППАХ: Ra уменьшается, значение ЭО увеличивается, активность неметаллических элементов усиливается в направлении ________________________________ . 4.Кристаллическое строение неметаллов - простых веществ. Аллотропия.
Физические свойства неметаллов.
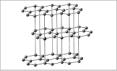
Спектр (разнообразный) цветов неметаллов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.  Причины А: Причины А: Образование молекул с разным Образование различных числом атомов (кислород, озон) кристаллических форм (алмаз, графит)       О С О СОЗОН КИСЛОРОД АЛМАЗ ГРАФИТ КАРБИН ФУЛЛЕРЕН Аллотропные модификации кислорода: 1) общее в составе молекул _________________________________________ 2) общее в свойствах_______________________________________________ 1) различие в составе молекул _______________________________________ 2) различие в свойствах____________________________________________ Вывод: Наличие у кислорода аллотропных видоизменений (кислорода и озона) обусловлено __________________________________________________________ Аллотропные модификации углерода: Составьте таблицу «Состав и свойства алмаза и графита:
Вывод: Наличие у углерода аллотропных видоизменений (алмаза и графита) обусловлено ______________________________________________________ 5. Химические свойства неметаллов.
В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов:  Si, B, H, P, C, S, I, N, Cl, O, F Si, B, H, P, C, S, I, N, Cl, O, FУВЕЛИЧИВАЮТСЯ 6. Виды соединений неметаллов.  6. 1. Водородные соединения неметаллов.
* -все газы, кроме воды. кислоты основание амфотерное соединение
Летучие водородные соединения неметаллов:
В периоде (ПСХЭ) с увеличением порядкового номера элемента – неметалла усиливается кислотный характер водородного соединения. SiH4 → PH3 → H2S → HCl 6.2. Высшие оксиды неметаллов.
6.3. Высшие гидроксиды (кислоты).
ТЕСТ 1) Вставьте слова, пропущенные в тексте. Атомы ……… в отличие от атомов……. легко принимают наружные электроны, являются ……. 2) Вставьте слова, пропущенные в тексте. Неметаллические свойства элементов с увеличением порядкового номера в периодах ….. В группах неметаллические свойства элементов ……… 3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?  4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?  5) Водород занимает в периодической таблице два места: в I А группе и в VII А группе. Запишите молекулярные формулы водородных соединений Na, K, Cl, F. 6) Какую высшую степень окисления имеют следующие элементы? Азот +6 Хлор +5 Сера +4 Кремний +7 7) Определите, окислителем или восстановителем является сера в следующих реакциях: H2+S = H2S S — 2SO2 + O2 = 2SO3 S— 8) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно….. а) 4 б) 5 в) 6 г)7 9) Наиболее электроотрицательными являются атомы….. • серы • фосфора • кремния • хлора 10) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям: • 2, 1 • 2, 8, 2 • 2, 8, 7 http://ufo-new.ru/uploads/posts/2010-12/1292567103_1236967057.jpg http://proletarka.ucoz.ru/tekhnologicheskaja_karta_uchenika.doc http://krgorka.narod.ru/uroki/chimi1.doc http://www.mmu7.ru/files/uploads/nemetalli.doc | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



 HCl + H2O [ H3O ]+ +Cl-
HCl + H2O [ H3O ]+ +Cl-