Металлы. Металлы группы А и В. Обзор металлов агрупп. Общий обзор элементов бгрупп
 Скачать 50.11 Kb. Скачать 50.11 Kb.
|
|
Тема урока: Обзор металлов А-групп. Общий обзор элементов Б-групп. Цель урока: углубить знания о химических свойствах металлов, развивать умения составлять уравнения химических реакций. 1.Классификация металлов Металлы I главной подгруппы называются щелочными –образуют щелочи, II группы – щелочноземельными, из III группы изучаем свойства одного из широко применяемых в технике металлов – алюминия. Атомы щелочных металлов содержат на внешнем энергетическом уровне только 1 электрон, который они легко отдают при химических взаимодействиях, поэтому являются сильными восстановителями. Строение атома лития и натрия: 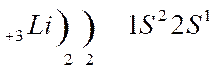 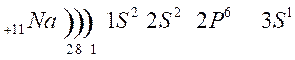 Следующие за щелочными металлами элементы составляют главную подгруппу II группы, также являются типичными металлами, обладающими сильной восстановительной способностью. Са, Sr, Ba, Ra – щелочноземельные металлы. 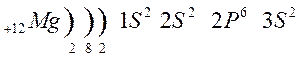 К металлам относятся и элементы главной подгруппы III группы, исключая бор. 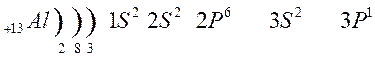 Из элементов главных подгрупп следующих групп к металлам относят: в IV группе – германий, олово, свинец; в V группе – сурьма и висмут; в VI группе – полоний. Элементы побочных подгрупп – все металлы. 2.Химические свойства металлов Зная строение металлов, можно предвидеть их общие химические свойства. В атомах металлов на внешней электронной оболочке находятся электроны, которые легко отрываются от атомов. Наиболее общим химическим свойством металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы, т.е. металлы в реакциях являются сильными восстановителями. I. Взаимодействие с простыми веществами: кислородом, галогенами, серой, азотом, водородом. 1. Реакции с кислородом. 4 Nа + O2 → 2 Nа2O; (побочный продукт) 2. Взаимодействие с галогенами. 2К + Cl2 →2 КCl; 3. Взаимодействие с серой. 2K + S → K2S; Са + S → СаS; 4. Взаимодействие с азотом. 6К + N2 → 2K3N; 5. Взаимодействие с водородом (щелочные металлы). 2К + Н2 → 2КН Обратите внимание, что в этих реакциях атомы металлов отдают электроны, т.е. являются восстановителями, а неметаллы принимают электроны, т.е. являются окислителями. Вывод: Металлы реагируют с галогенами, кислородом, серой, азотом, водородом, образуя соединения ……иды. В реакциях с неметаллами металлы являются восстановителями. II Взаимодействие со сложными веществами. 1. Взаимодействие металлов с водой. Металлы вступают в реакцию с водой при обычной температуре. При взаимодействии воды с активными металлами при обычной температуре образуется гидроксид и выделяется водород. 2Na + H2O → 2NaOH + H2 ↑. Ca + 2H2O → Ca(OH)2 + H2 ↑. Натрий более активный металл, чем кальций. Он легко отдает свои валентные электроны, является самым сильным восстановителем. При взаимодействии воды с менее активными металлами образуются оксиды металлов и выделяется водород. Это металлы, стоящие в ряду напряжений после алюминия. Zn + H2O → ZnO + H2 ↑; Ответить на вопросы: Все ли металлы взаимодействуют с водой и почему? Медь, ртуть, серебро, платина, золото с водой не реагируют! Au + H2O → реакция не идет Запомните! Металлы, стоящие в электрохимическом ряду напряжений до алюминия (включительно) образуют с водой гидроксиды, от алюминия до свинца – оксиды. Остальные с водой не реагируют. 2. Взаимодействие металлов с растворами кислот. Мg + 2HCl → Мg Cl2 + H2 ↑; Запомните! Металлы, стоящие в электрохимическом ряду напряжений до водорода могут вытеснять водород из растворов кислот. Металлы стоящие в электрохимическом ряду напряжений после водорода не могут вытеснять водород из растворов кислот. Cu + H2SO4 → не реагирует. Вывод: 1. Правило соблюдается, если в реакции металла с кислотой образуется растворимая соль; 2. Концентрированная серная кислота и азотная кислота любой концентрации реагируют с металлами по особому, при этом водород не образуется; 3. На щелочные металлы правило не распространяется, т.к. они легко взаимодействуют с водой. 4. Из уравнений реакций видно, что в них окислителями являются ионы водорода и ионы неметаллов, а атомы металлов – восстановители. 3. Взаимодействие металлов с растворами солей. Fe + CuSO4 → Cu + FeSO4 Запомните! В электрохимическом ряду напряжений металл, стоящий левее, может вытеснять из растворов солей металл, стоящий правее. Исключение: металлы до магния не могут вытеснять другие металлы из растворов солей, так как в первую очередь реагируют с водой, образуя щелочи. 3.Свойства алюминия 1. Взаимодействие с кислородом. 4Al + 3O2 → 2Al2O3; (при нагревании) 2. Взаимодействие с галогенами. 2Al + 3Br2 → 2AlBr3; (при нагревании) 3. Взаимодействие с серой. 2 Al + 3S = Al 2S3 (при нагревании) 4. Взаимодействие с азотом 2 Al + N2 = 2Al N (при нагревании) С водородом непосредственно не реагирует. Поскольку алюминий проявляет амфотерные свойства, то он реагирует и с кислотами и с щелочами, образуя соли. Является активным металлом, поэтому также реагирует и с водой. В быту алюминий не проявляет свойства активного металла, так как поверхность алюминия покрыта оксидной пленкой. Общий обзор элементов Б-групп Переходные элементы располагаются в побочных подгруппах Периодической системы Д.И. Менделеева. Их подразделяют на d-элементы и f-элементы. f-элементы – это лантаноиды и актиноиды. При образовании соединений атомы металлов могут использовать не только валентные s- и p-электроны, но и d-электроны. Поэтому для d-элементов гораздо более характерна переменная валентность, чем для элементов главных подгрупп. Благодаря этому свойству переходные металлы часто образуют комплексные соединения. Переходные элементы – это металлы. Поэтому в своих соединениях они проявляют положительные степени окисления. Очень сильно видно различие в свойствах у элементов IV–VIII подгрупп периодической системы. Элементы побочных подгрупп – это металлы, а главных подгрупп – неметаллы. Однако, когда элементы главных и побочных подгрупп находятся в высших степенях окисления, их соединения проявляют заметное сходство. Например, оксид CrO3 близок по свойствам SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭO4. Точно также – оксиды марганца и хлора. Соответствующие им высшие оксиды – Mn2O7 и Cl2O7. Им соответствуют кислоты состава HЭО4. Подобная близость свойств объясняется тем, что часто элементы главных и побочных подгрупп в высших степенях окисления приобретают сходное электронное строение. Что касается химических свойств d-элементов, то обращает на себя внимание тот факт, что в пределах одной декады переходных элементов число стабильных степеней окисления сначала увеличивается, а потом уменьшается. 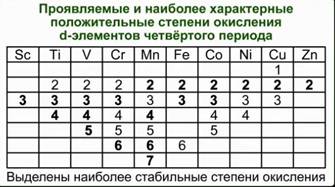 Значение переходных металлов для организма и жизнедеятельности Без переходных металлов наш организм существовать не может. Железо – это действующее начало гемоглобина. Цинк участвует в выработке инсулина. Кобальт – центр витамина В-12. Медь, марганец и молибден, а также некоторые другие металлы входят в состав ферментов. Многие переходные металлы и их соединения используются в качестве катализаторов. Например, реакция гидрирования алкенов на платиновом или палладиевом катализаторе. Полимеризация этилена проводится с помощью титансодержащих катализаторов. Задание 1. Совершить превращение: Ba → BaO → Ba(OH)2 → BaCO3 → Ba(NO3)2 2. На западе Франции, в Бретани, улитки стали обгрызать краску с наружных стен домов, заползая на высоту до четырех метров. Попытайтесь объяснить этот факт и предложить варианты решения проблемы? 3. Художники-реставраторы отмечают, что картины, написанные масляными красками, очень быстро тускнеют. Особенно белая краска со временем приобретает серый оттенок, что, естественно, влияет на качество картины. Что же происходит с белыми красками на воздухе и как это можно предотвратить? |
