4. Молекулярная физика и термодинамика
1. Газ считается идеальным, если можно пренебречь
А. взаимодействием молекул
Б. скоростью молекул
В. массой молекул
Г. размером молекул
Д. столкновениями молекул
1. А, Б 2. А, В 3. А, Г 4. Б, Д 5. В, Г
2. Давление газа можно определить по формулам
А. 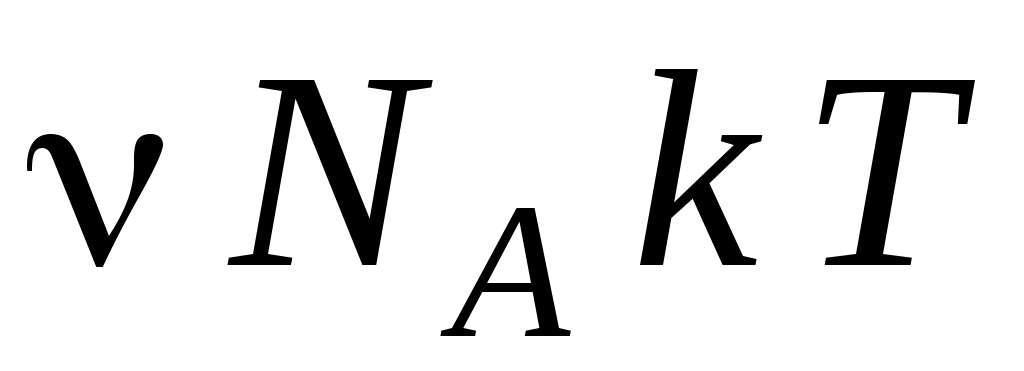 Б. Б. 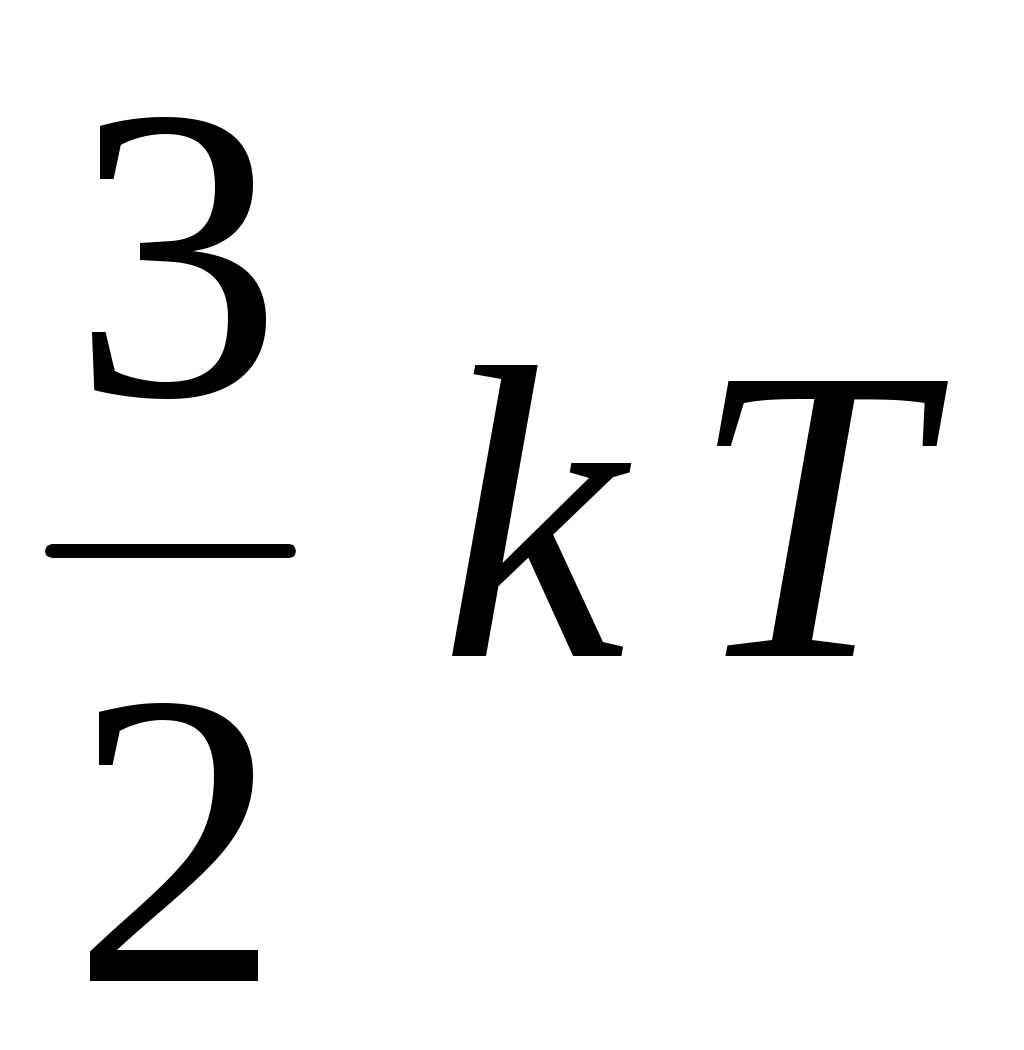 В. В. 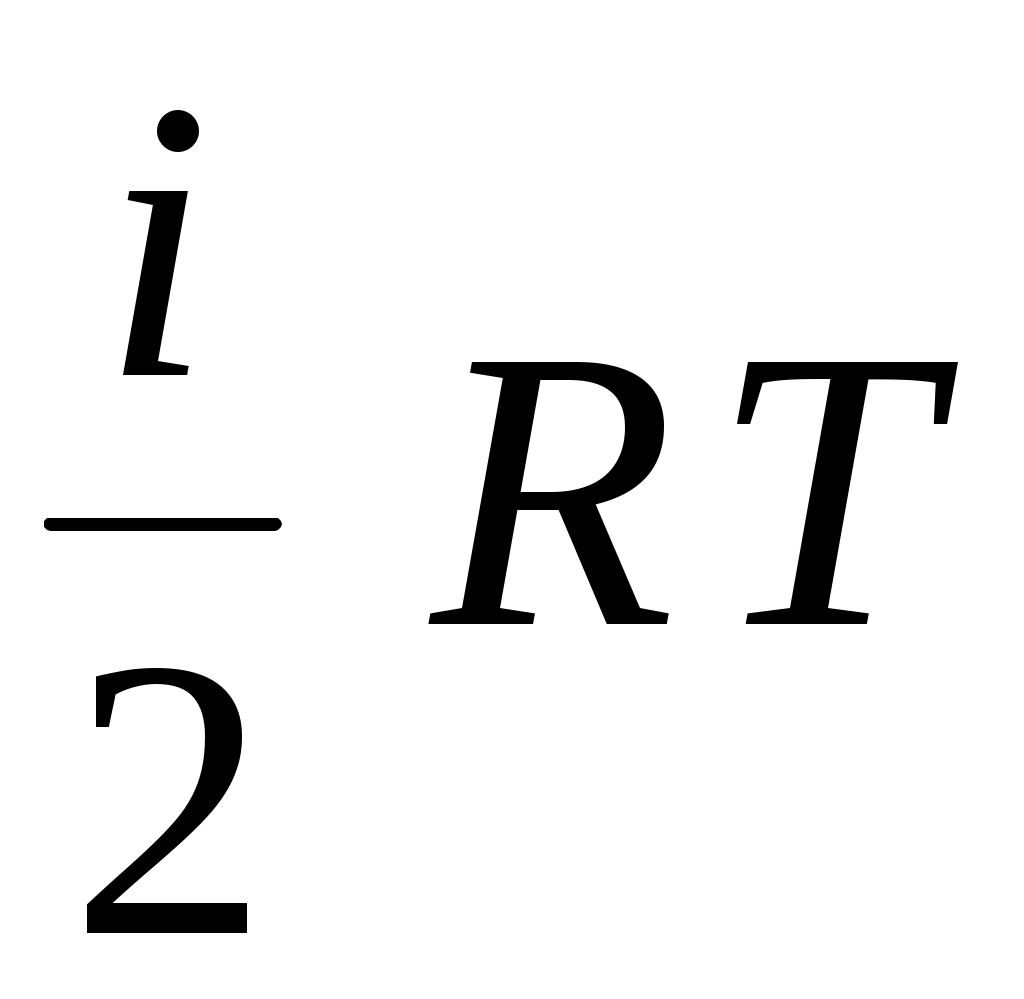 Г. Г. 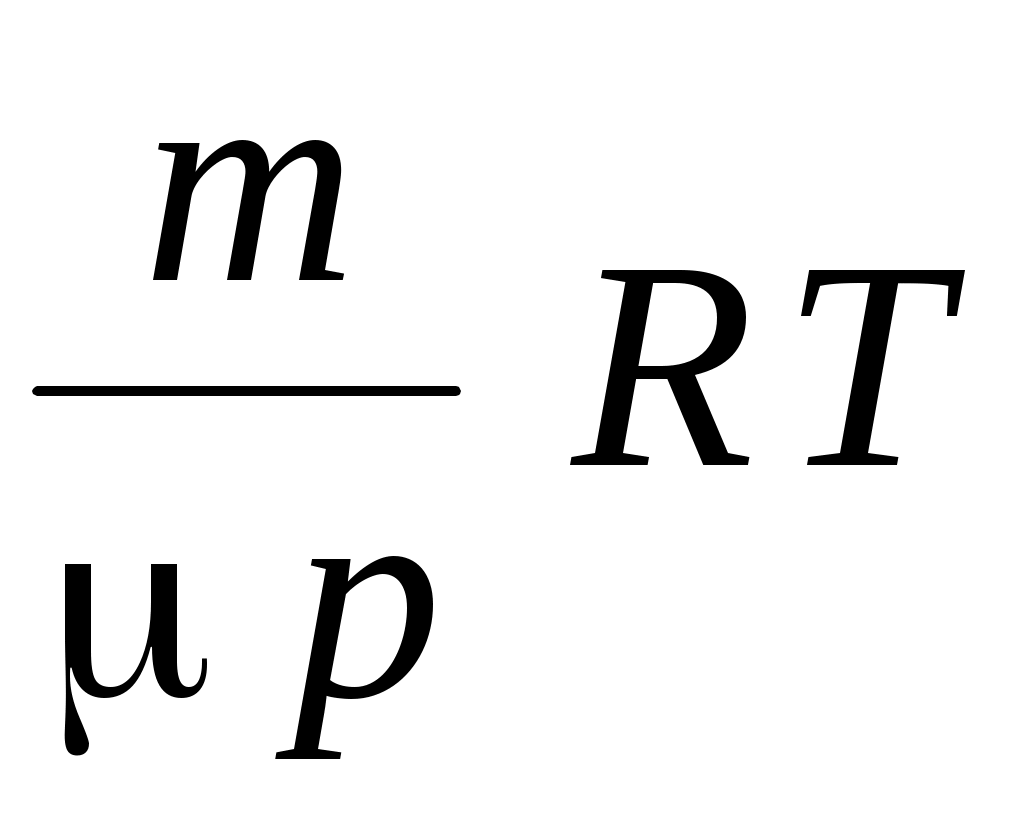 Д. Д. 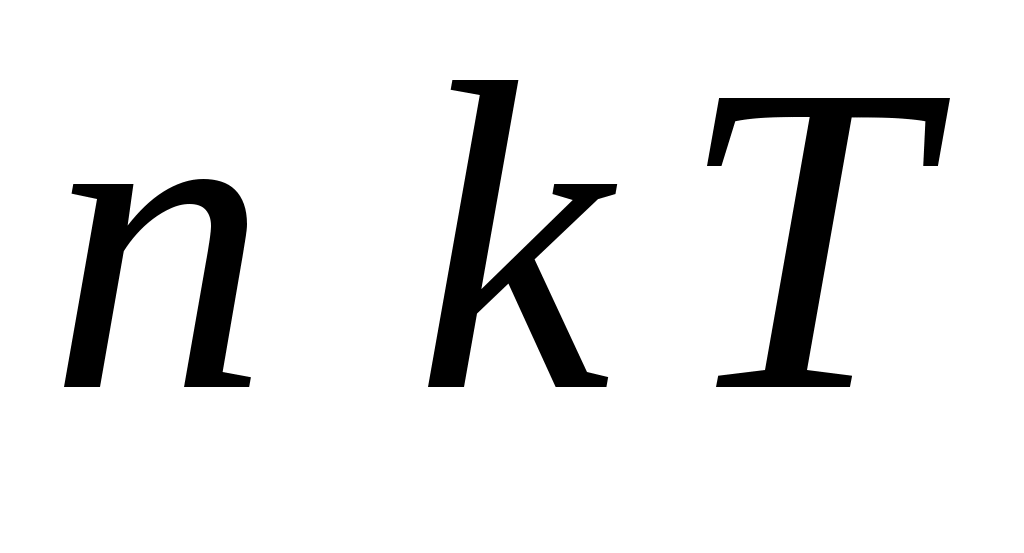
1. А, Г 2. Б, В 3. А 4. Г 5. Д
3. Давление идеального газа зависит от
силы притяжения молекул
кинетической энергии молекул
потенциальной энергии молекул
размеров молекул
формы сосуда
4. Из приведенных выражений давление идеального газа можно вычислить по формуле
1. 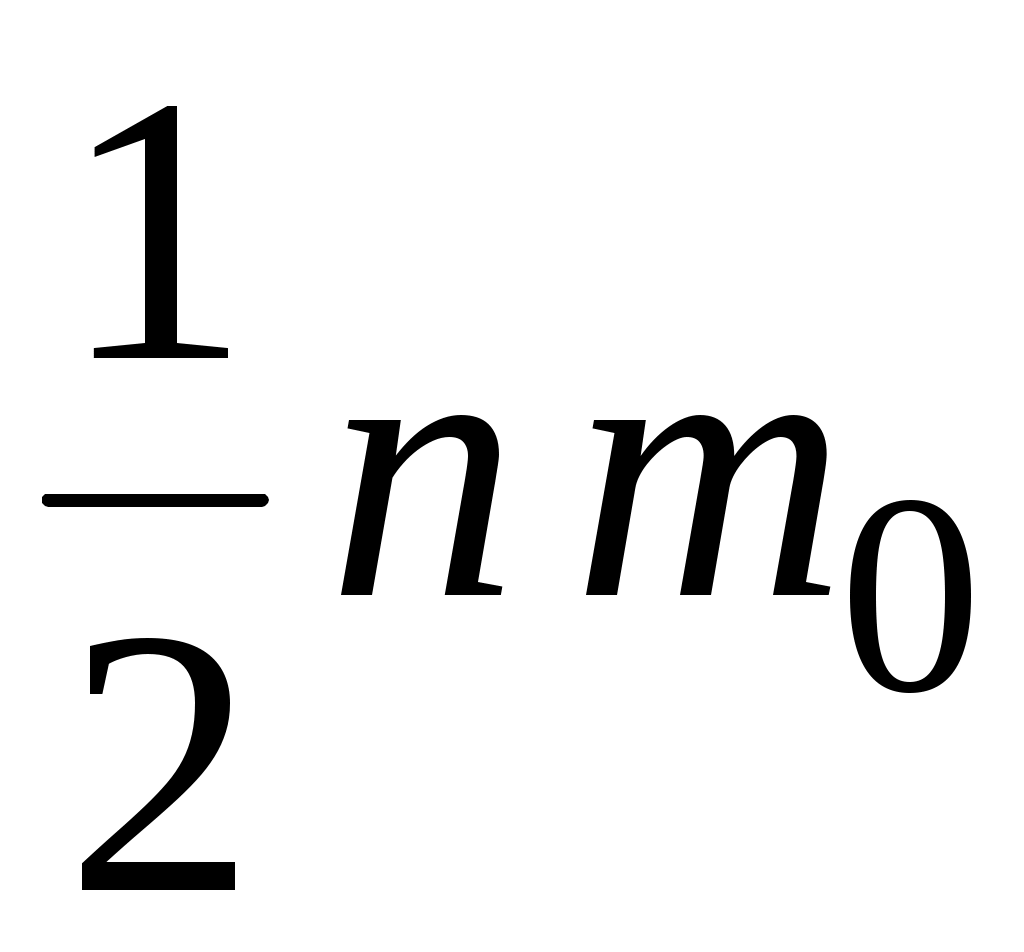 <υ> 2. <υ> 2. 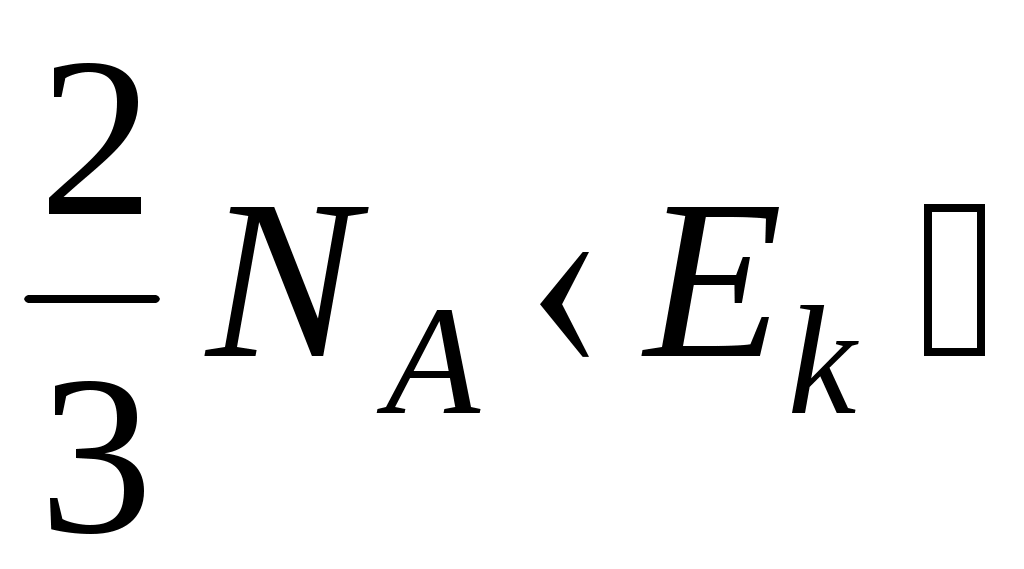 3. 3. 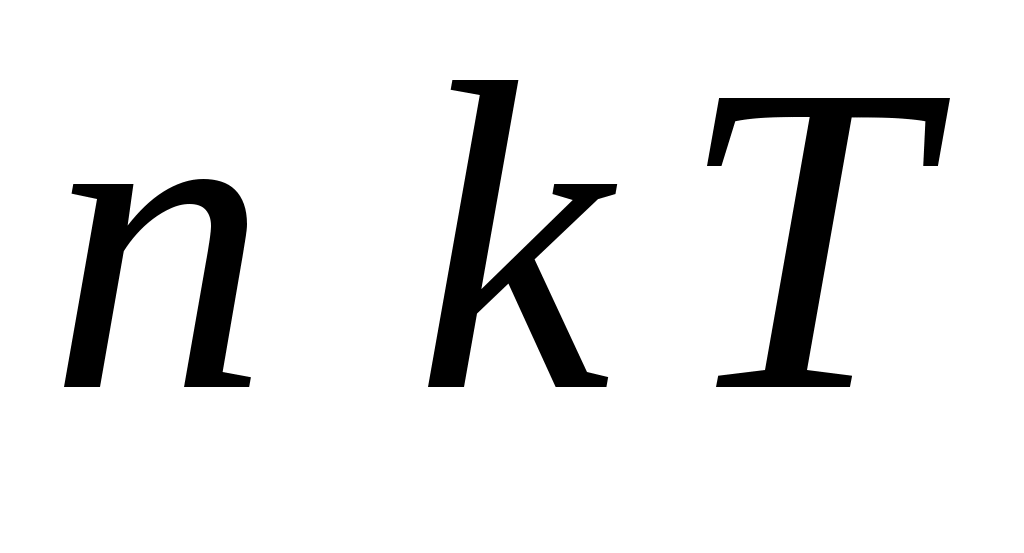 4. 4. 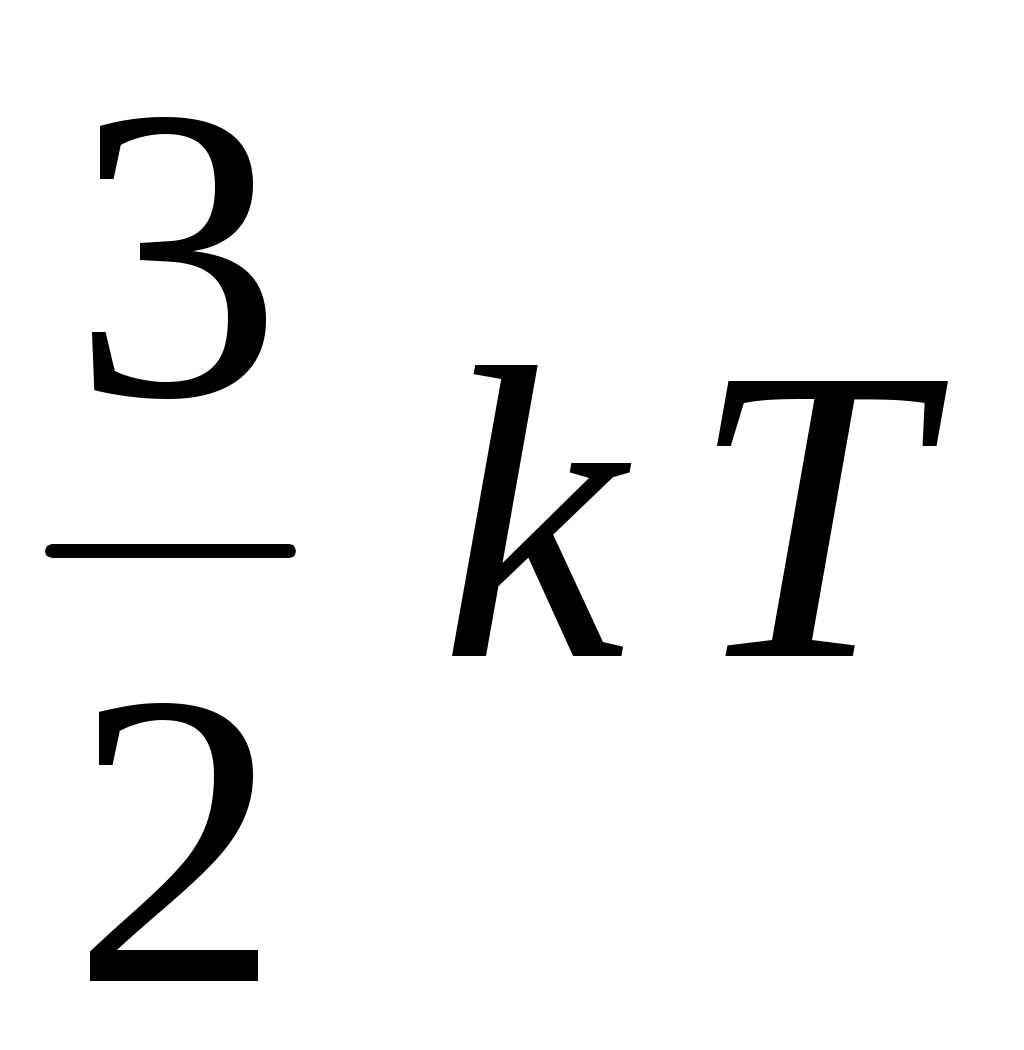 5. 5. 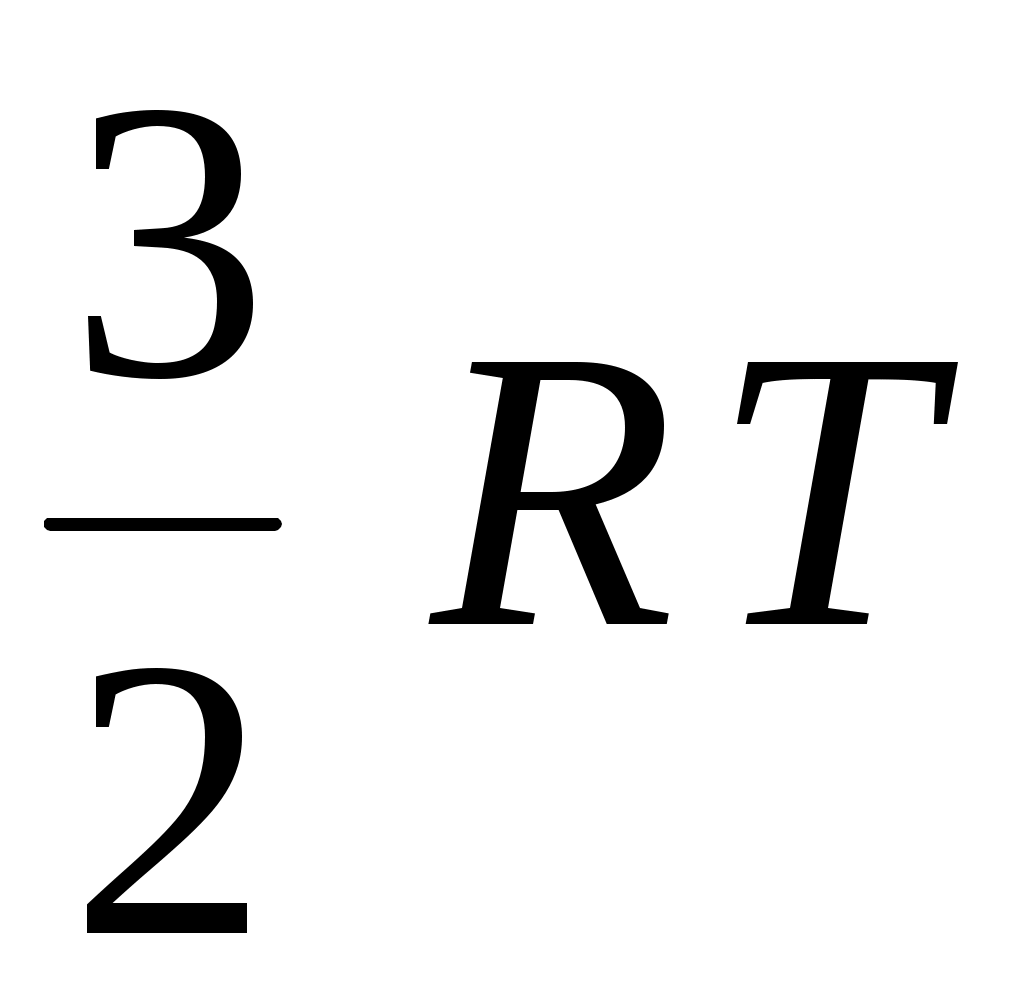
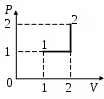
5. Состояние идеального газа изменилось в соответствии с графиком на  диаграмме. В состоянии 1 температура газа Т0. В состоянии 2 температура газа равна диаграмме. В состоянии 1 температура газа Т0. В состоянии 2 температура газа равна
1. 2 Т0 2. 3 Т0 3. 4 Т0
4. 5 Т0 5. 6 Т0
6. Уравнение состояния идеального газа имеет вид
1. 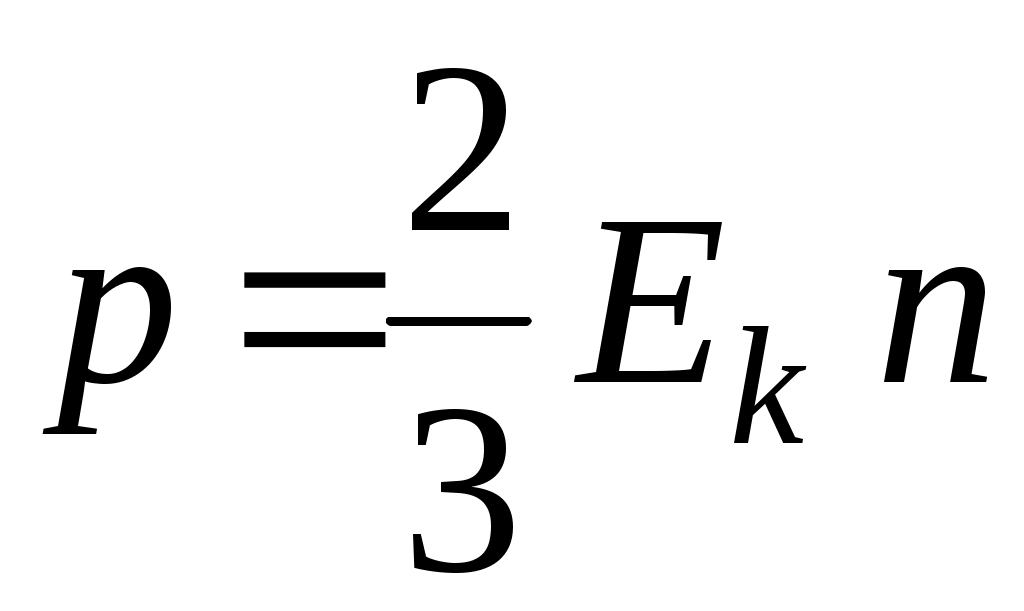 2. 2. 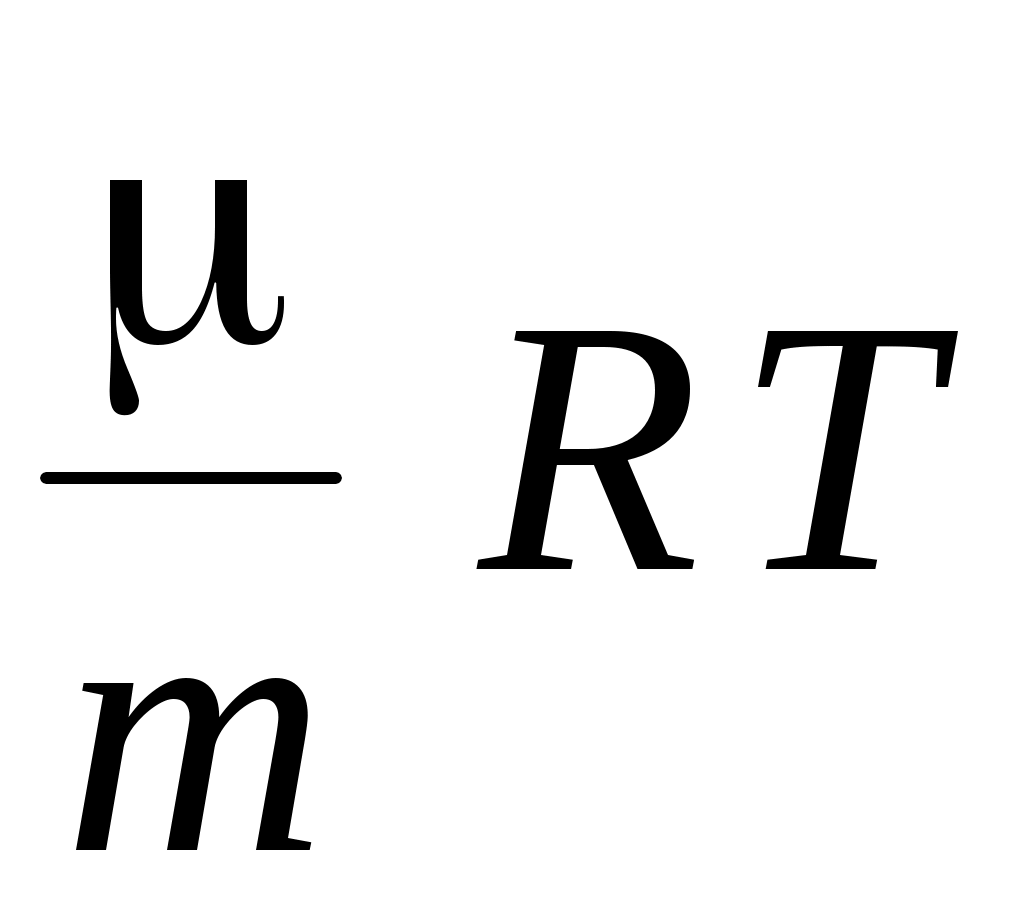 3. 3. 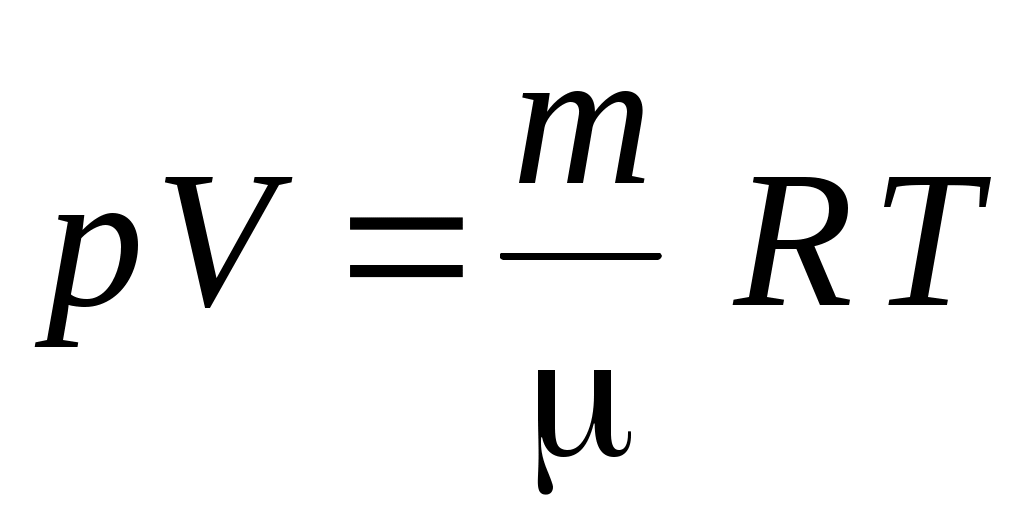 4. 4. 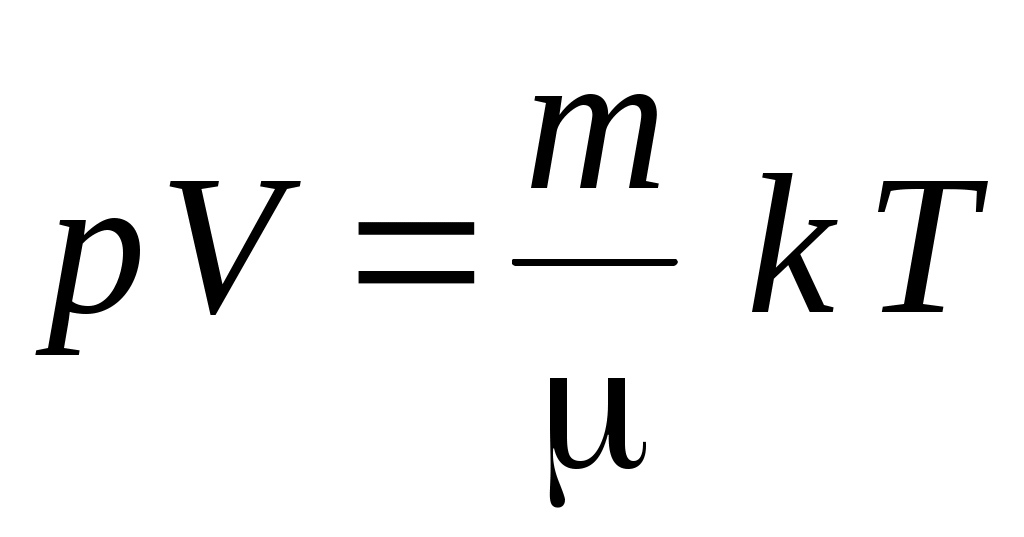 5. 5. 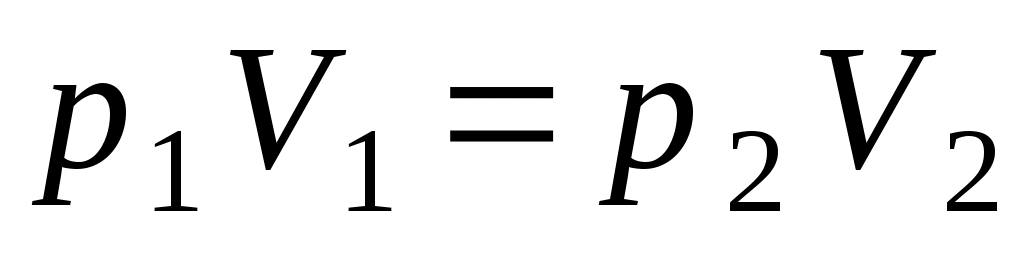
7. Из сосуда выпустили половину газа. Чтобы давление оставшегося газа увеличилось в 3 раза, надо его абсолютную температуру
увеличить в 3 раза
уменьшить в 6 раз
увеличить в 9 раз
увеличить в 6 раз
уменьшить в 3 раза
8. В пяти одинаковых сосудах находятся: кислород, азот, неон, гелий, водород. Температура и масса газов одинаковы. Наименьшее давление будет в сосуде, где находится
1. кислород 2. азот 3. неон
4. гелий 5. водород
9. Имеются два сосуда объемами V и 2V. В первом сосуде находиться 1 моль идеального газа, во втором 6 молей. Давление в сосудах одинаковое. Между температурами существует соотношение
1. Т1 = Т2 2. Т1 = 5 Т2 3. Т1 = 3 Т2
4. Т1 = 1/3 Т2 5. Т1 = 12 Т2
10. Имеется два баллона одинакового объема. В одном находится 1 кг азота, в другом – 1 кг водорода. Температуры газов одинаковы. Давление азота 105 Па. Давление водорода равно (Па)
1. 105 2. 1,4·106 3. 2,8·106
4. 7·103 5. 3,6·103
11. При температуре 27°С и давлении 105 Па объем идеального газа 1 м3. Этот же газ будет при том же давлении занимать объем 2 м3 при температуре
1. 54°С 2. 300 К 3. 13,5°С
4. 150 К 5. 600 К
1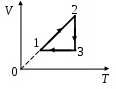 2. На 2. На  диаграмме представлен процесс, происходящий с идеальным газом. В координатах р, Т этот процесс имеет вид диаграмме представлен процесс, происходящий с идеальным газом. В координатах р, Т этот процесс имеет вид
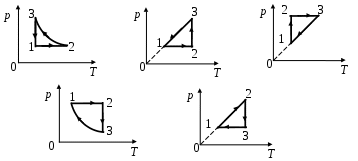
а б в
г д
1. а 2. б 3. в 4. г 5. д
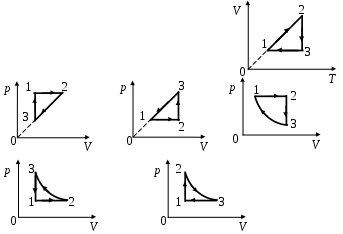
13. На  диаграмме представлен процесс, происходящий с идеальным газом. В координатах р, Vэтот процесс имеет вид диаграмме представлен процесс, происходящий с идеальным газом. В координатах р, Vэтот процесс имеет вид
а б в
г д
1. а 2. б 3. в 4. г 5. д
1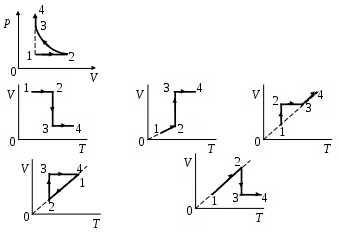 4. На 4. На  диаграмме изображен процесс, происходящий с идеальным газом. В координатах V, Т ему соответствует график диаграмме изображен процесс, происходящий с идеальным газом. В координатах V, Т ему соответствует график
а б в
г д
1. а 2. б 3. в 4. г 5. д
1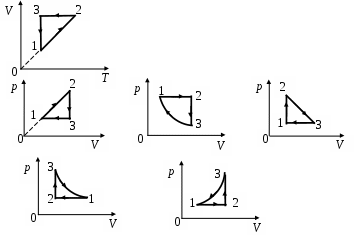 5.На диаграмме 5.На диаграмме 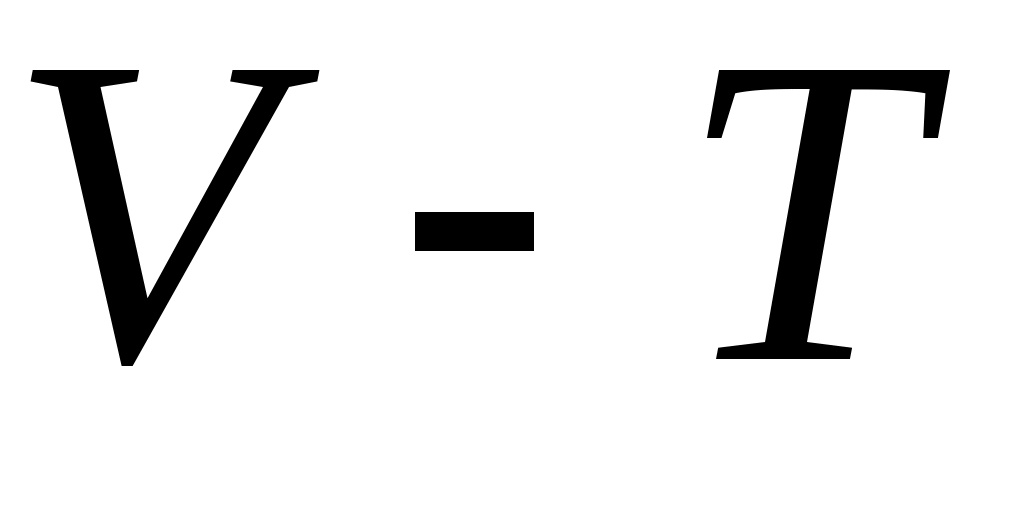 изображен процесс идеального газа. В координатах р, Vон имеет вид изображен процесс идеального газа. В координатах р, Vон имеет вид
а б в
г д
1. а 2. б 3. в 4. г 5. д
16. Давление газа равно 105 Па при температуре 27°С и объеме 1 м3. Газ займет объем 0,5 м3 при том же давлении, если температура газа
1. увеличится на 300 К
2. уменьшится на 300 К
3. увеличится на 150 К
4. уменьшится на 150 К
5. уменьшится на 13,5°С
17. В баллоне объемом 2 л находиться 0,2 моля кислорода. Плотность кислорода равна (кг/м3)
1. 5,4 2. 4,0 3. 3,2 4. 1,2 5. 0,0032
18. Среди приведенных формул к изотермическому процессу имеют отношение
А. 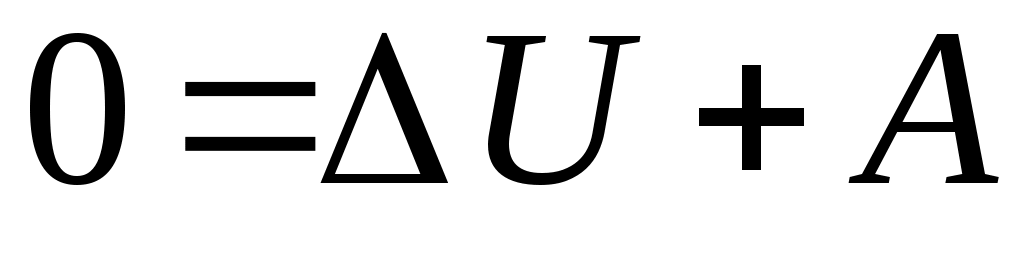 Б. Б. 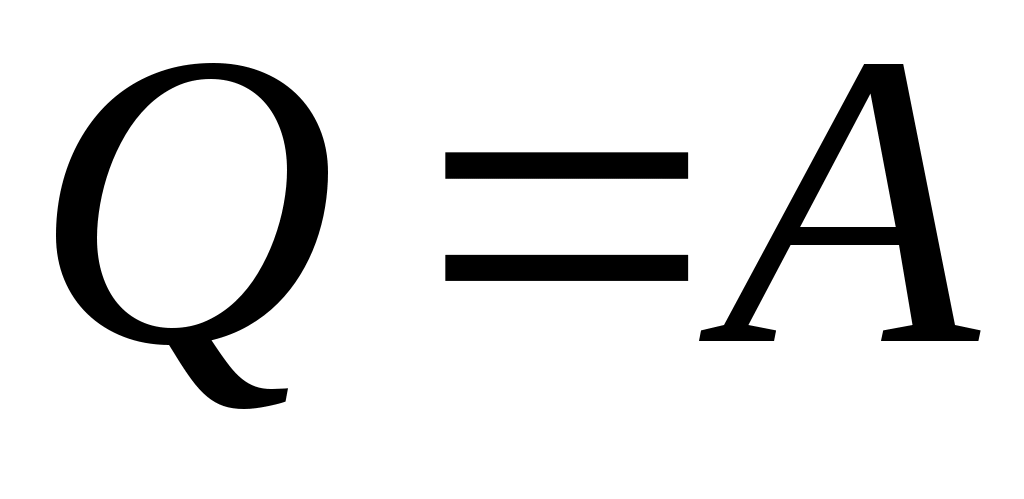 В. В. 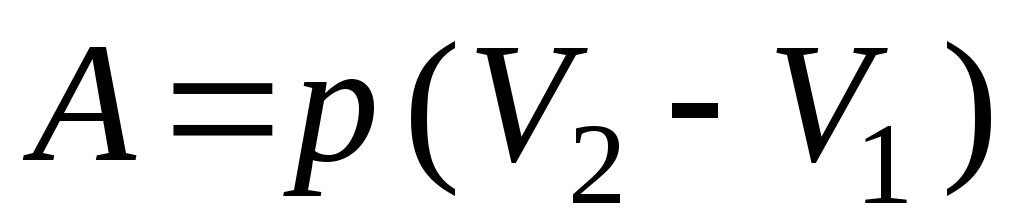
Г. 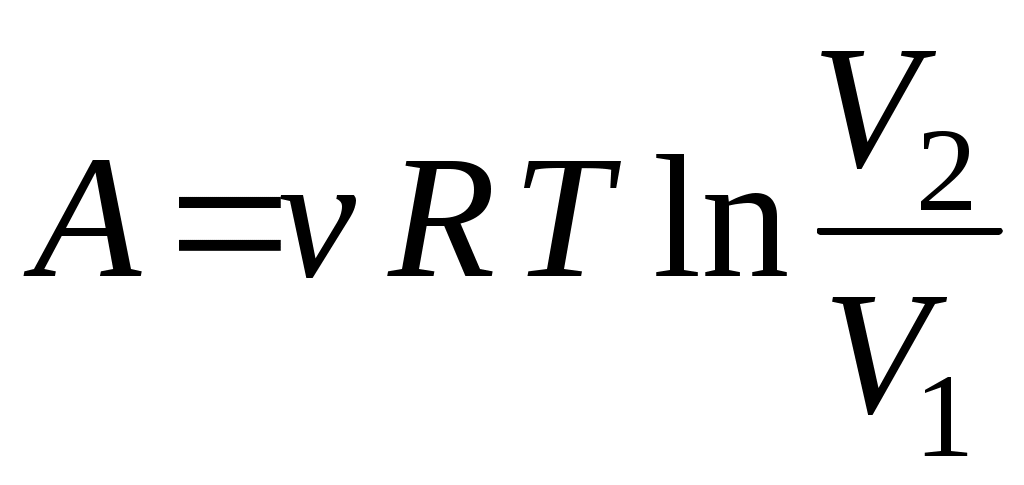 Д. Д. 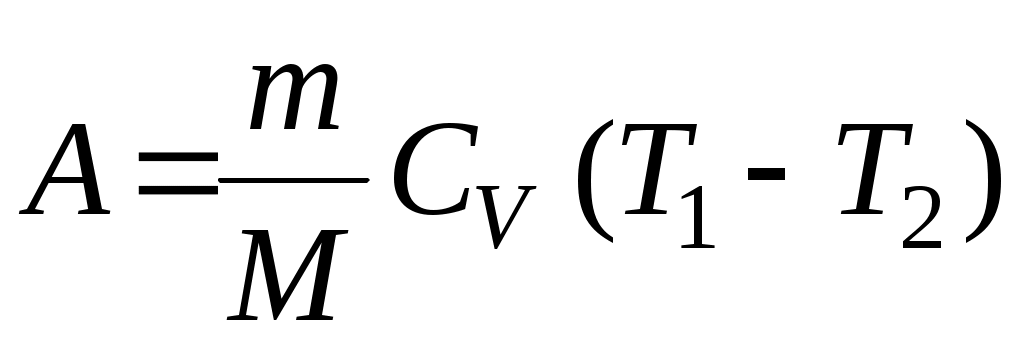 Е. Е. 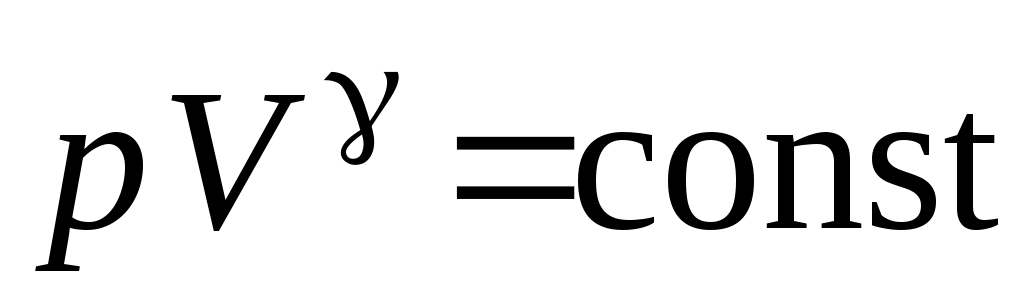
1. Б 2. А, В 3. В, Д 4. Д 5. Б, Г
19. Среди приведенных формул к адиабатическому процессу имеют отношение
А. 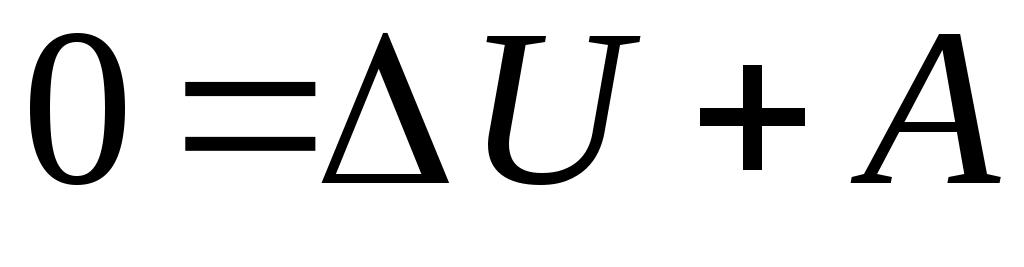 Б. Б. 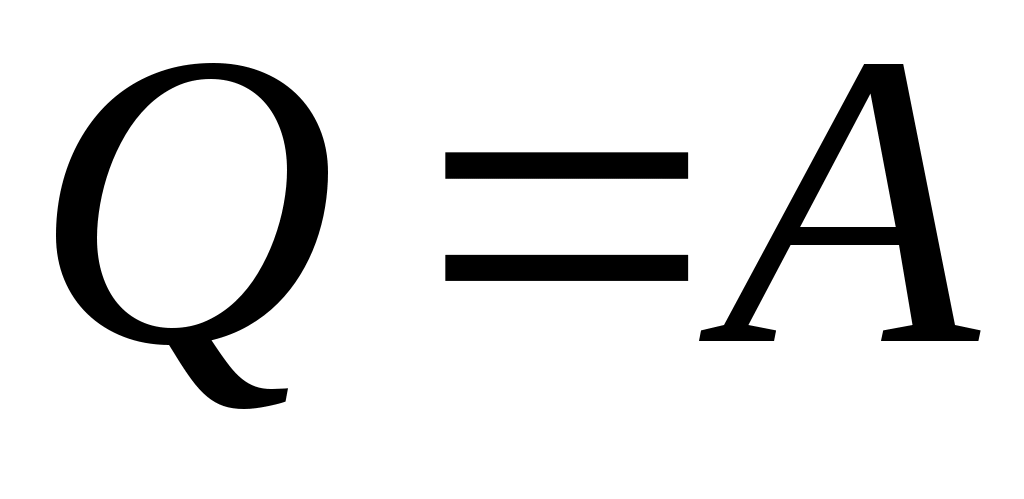 В. В. 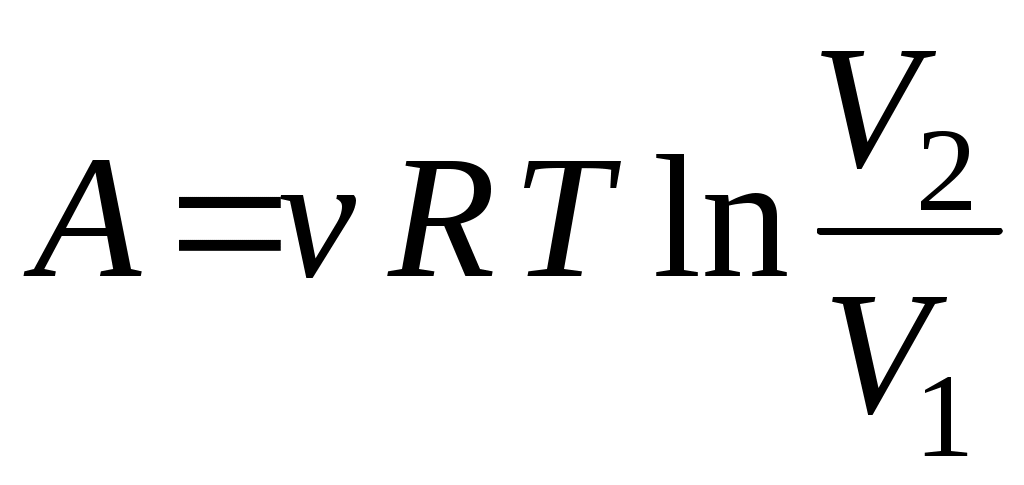
Г. 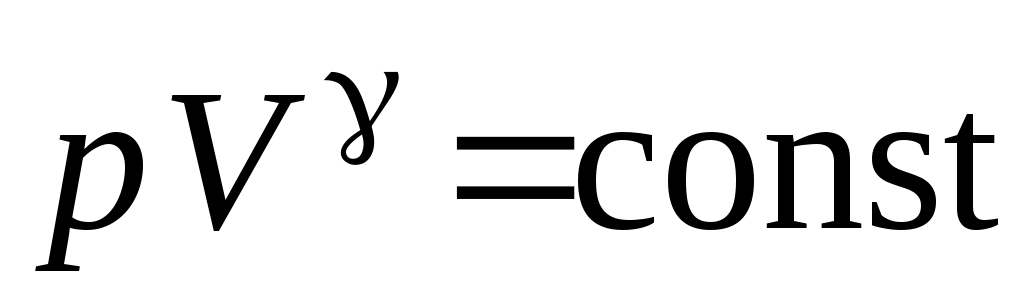 Д. Д. 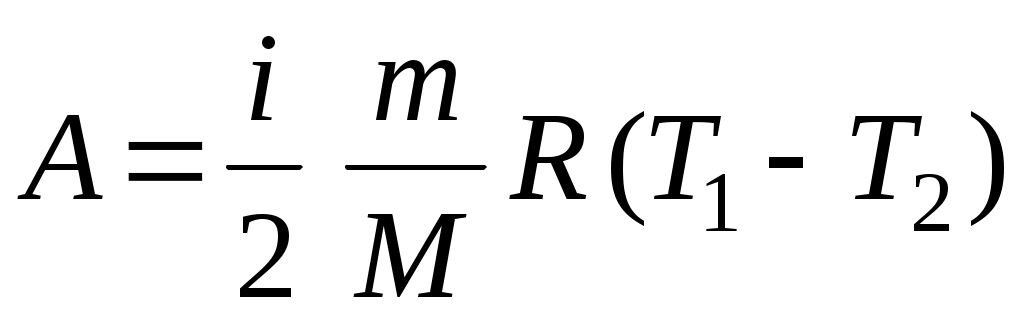 Е. Е. 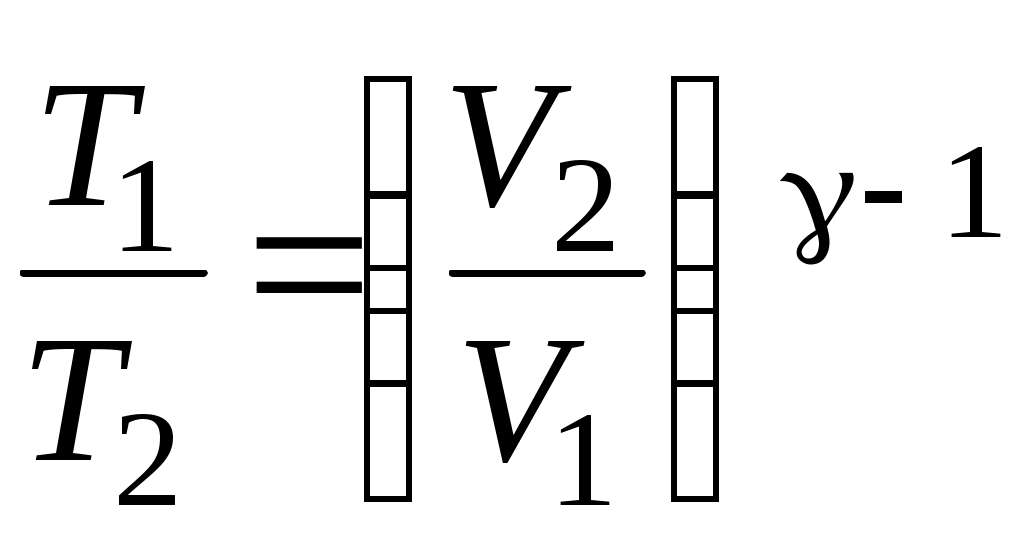
1. А 2. Б, В 3. Б, В, Г 4. А, Г, Д, Е 5. Е
20. Наиболее вероятная скорость молекул увеличилась в 3 раза. Температура идеального газа при этом увеличилась в
1. 3 раза 2. 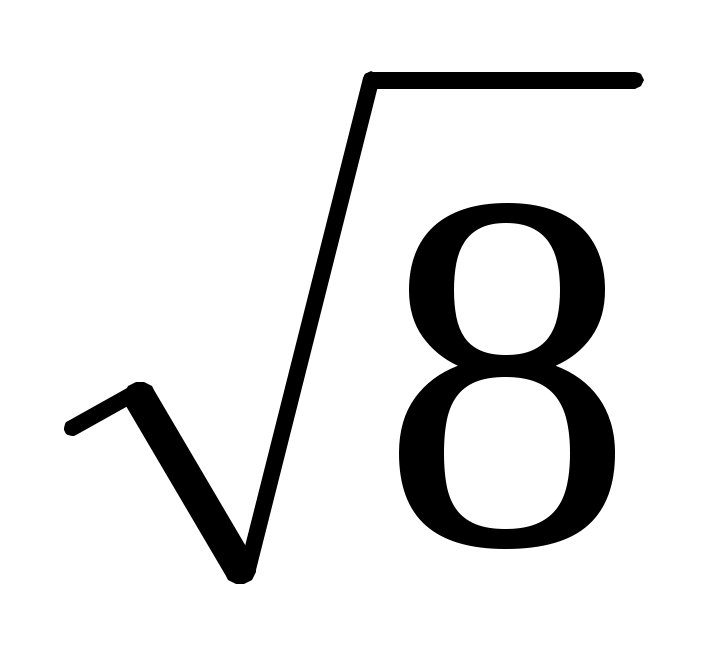 раза 3. 9 раз 4. 6 раз 5. не изменилась раза 3. 9 раз 4. 6 раз 5. не изменилась
21. Азот находится в равновесном состоянии при Т = 421 К. Наиболее вероятная скорость молекул (м/с)
1. 300 2. 400 3. 500 4. 600 5. 700
22. Внутренняя энергия одного моля идеального одноатомного газа определяется формулой
1. 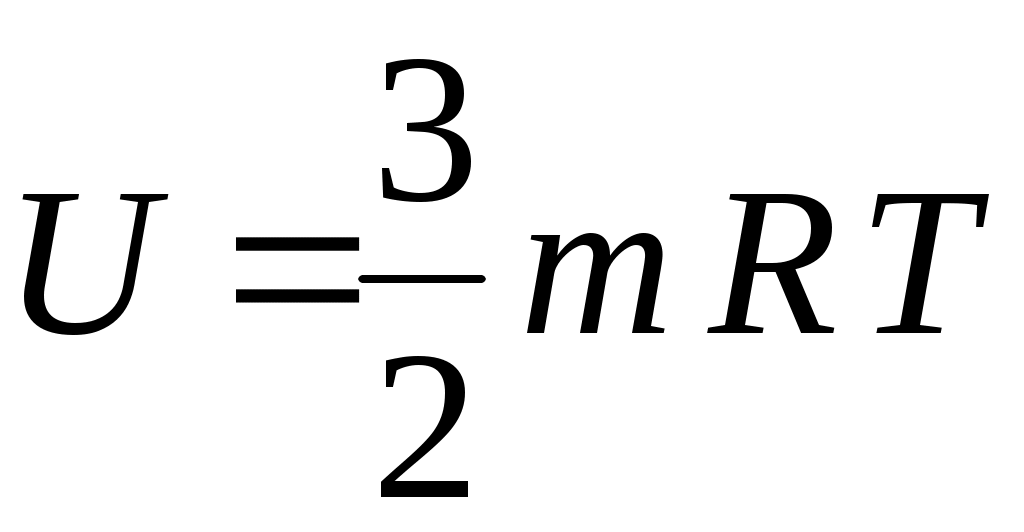 2. 2. 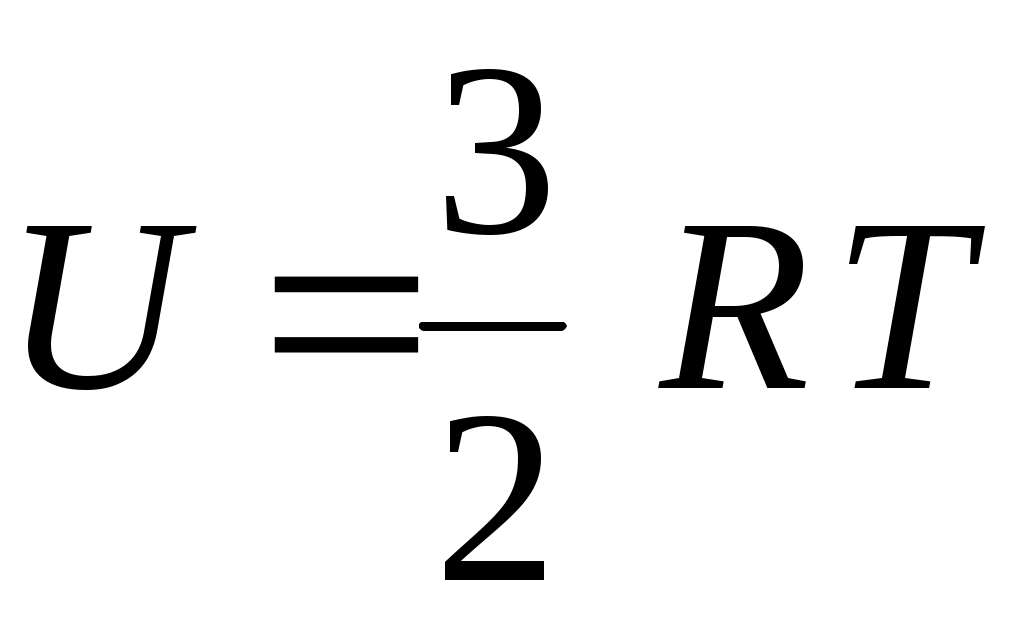 3. 3. 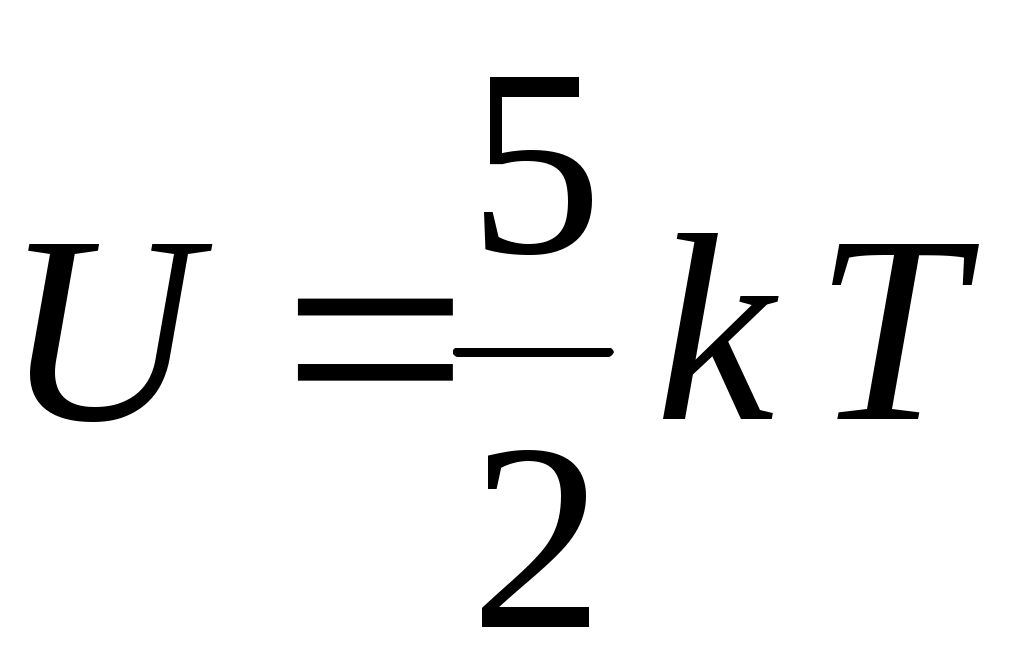
4. 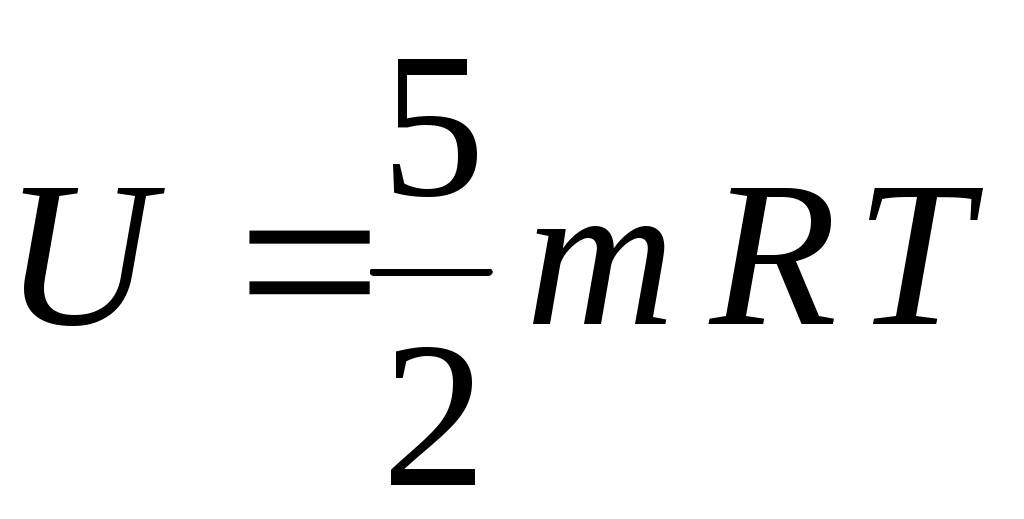 5. 5. 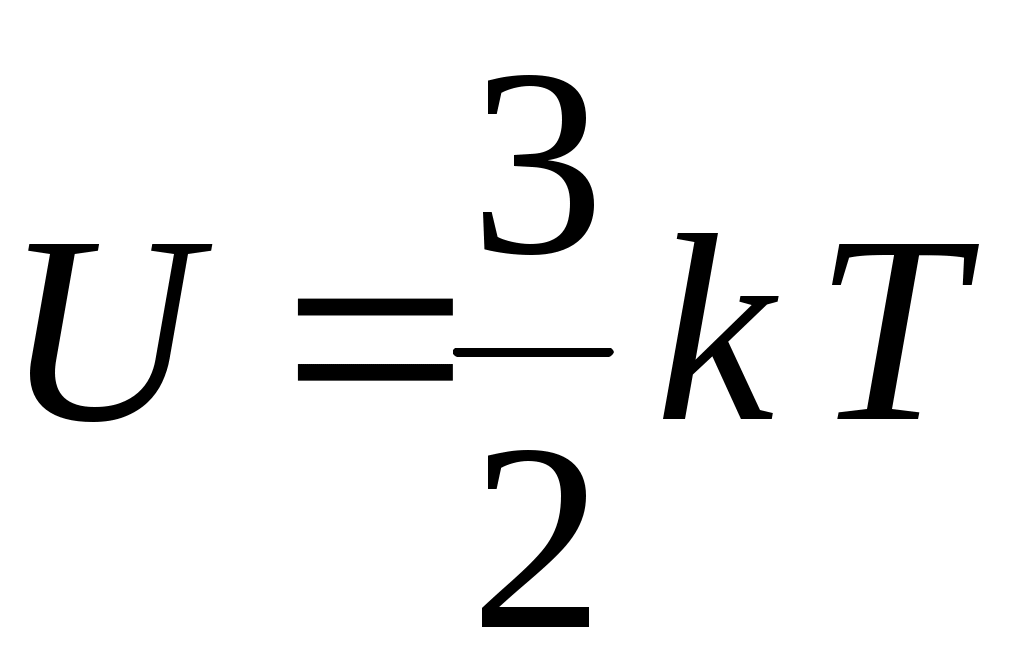
2 3. Максимальную внутреннюю энергию идеальный газ имеет в состоянии, соответствующем на 3. Максимальную внутреннюю энергию идеальный газ имеет в состоянии, соответствующем на 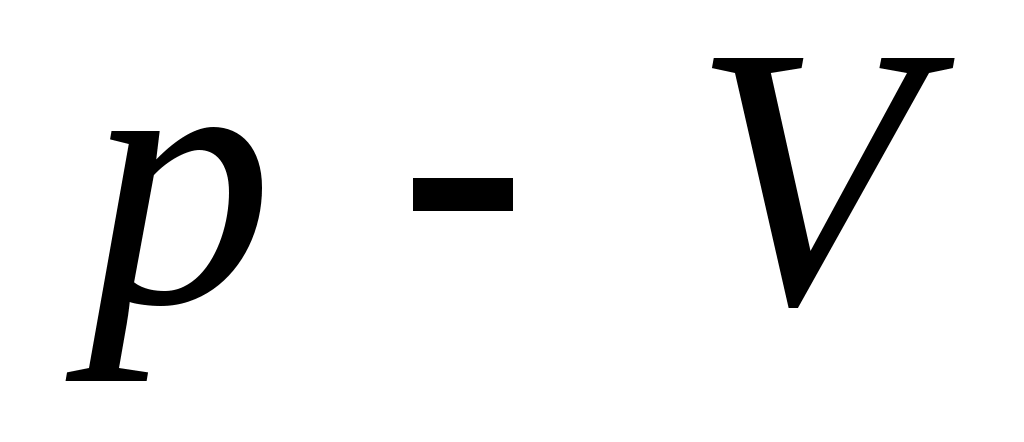 диаграмме в точке диаграмме в точке
1. 1 2. 2 3. 3 4. 4 5. 5
24. Идеальный газ не совершает работу в процессе
адиабатическом
изобарическом
изотермическом
изохорическом
совершает всегда
25. При изохорном процессе температура некоторой массы идеального газа изменяется на 100°С. При этом давление уменьшается с 4·105 до 3·105 Па. Температура газа в конце процесса равна (°С)
1. 132 2. 127 3. 122 4. 117 5. 112
26. Идеальный газ расширяясь, переходит из одного состояния в другое тремя способами
изобарически
изотермически
адиабатически
Совершаемые в этих процессах работы соотносятся между собой следующим образом
1. А1 < А2 < А3 2. А1 > А2 < А3 3. А1 > А2 > А3
4. А1 = А2 = А3 5. А1 < А2 > А3
27. Плотность воздуха (μ = 0,029 кг/моль) в камере сгорания дизельного двигателя при температуре 503°С и давлении 400 кПа (кг/м3) равна
1. 2 2. 1,5 3. 1,8 4. 2,1 5. данных недостаточно
28. В процессе изменения состояния газа его давление и объем были связаны соотношением 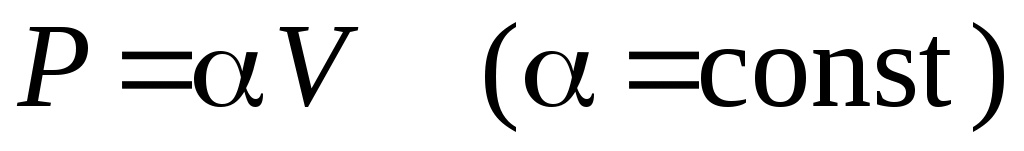 . При уменьшении объема газа над ним была совершена работа . При уменьшении объема газа над ним была совершена работа
1. 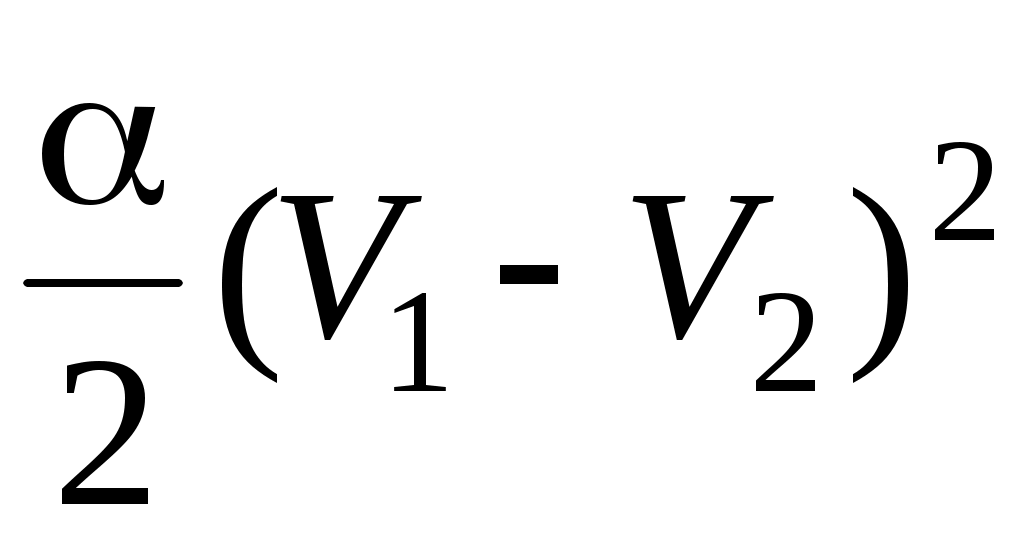 2. 2. 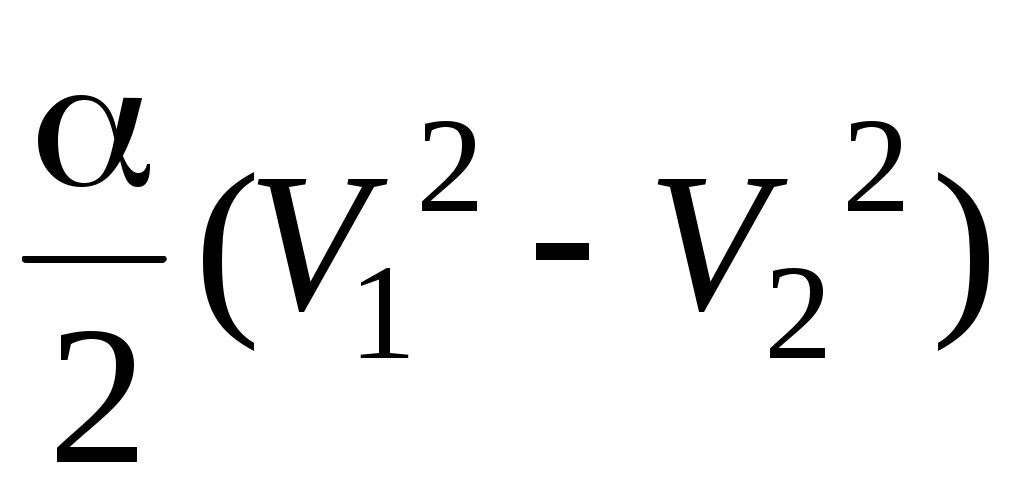 3. 3. 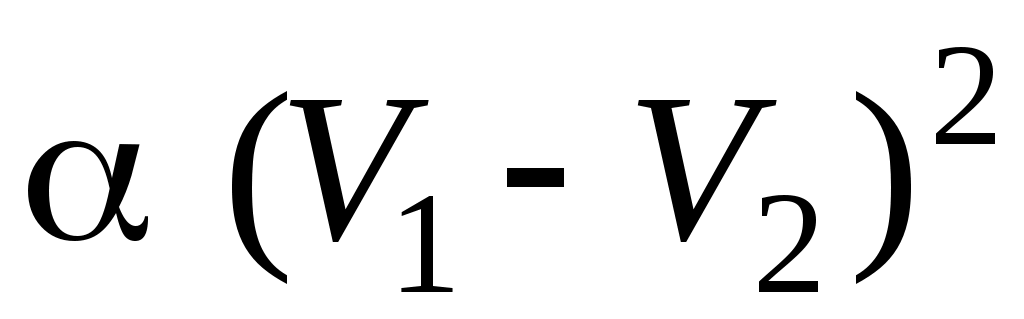
4. 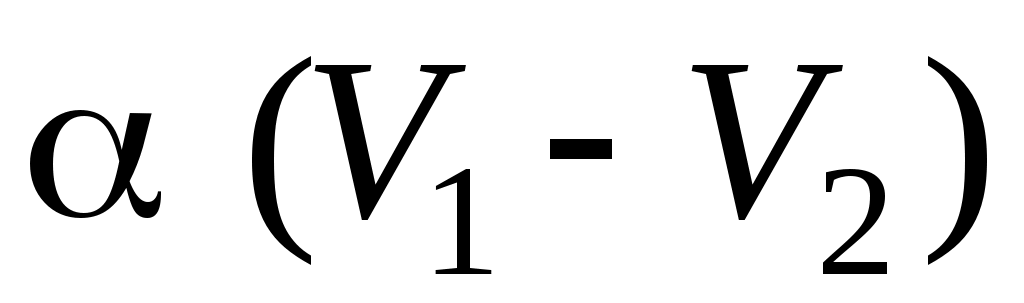 5. 5. 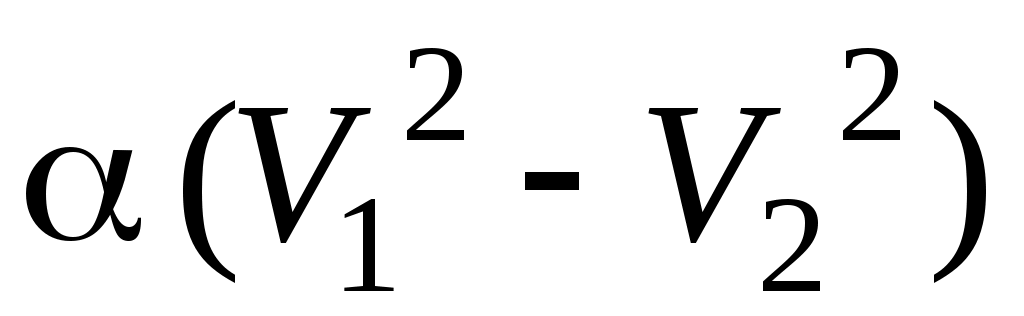
29. В изобарном процессе одноатомному идеальному газу передано 100 Дж теплоты. Газ совершил работу (Дж)
1. 20 2. 80 3. 40 4. 45 5. 68
3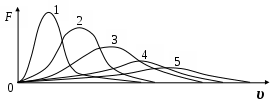 0. Из кривых зависимости функции распределения Максвелла от скорости, наименьшей температуре соответствует кривая 0. Из кривых зависимости функции распределения Максвелла от скорости, наименьшей температуре соответствует кривая
1. 1
2. 2
3. 3
4. 4
5. 5
31. Средняя квадратичная скорость молекул азота больше их средней арифметической скорости на 50 м/с при температуре (К)
1. 324 2. 368 3. 407 4. 454 5. 500
32. Средняя арифметическая скорость молекул азота и кислорода отличаются на 30 м/с при температуре воздуха (К)
1. 252 2. 288 3. 295 4. 300 5. 344
33. Распределение молекул в поле силы тяжести определяется соотношением (m – масса одной молекулы, n – концентрация молекул, μ – молярная масса, υ– скорость)
1. 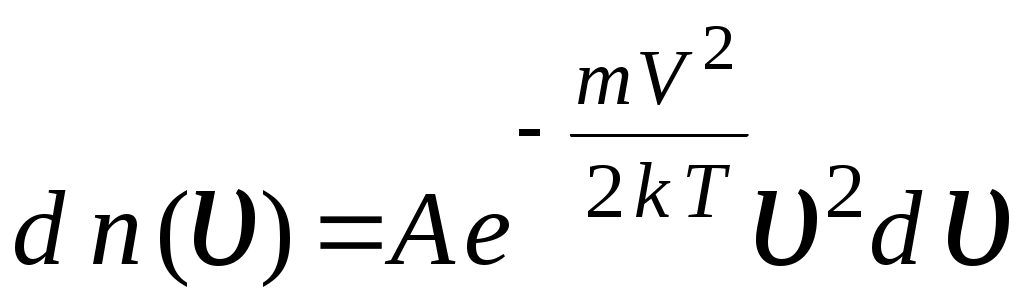 2. 2. 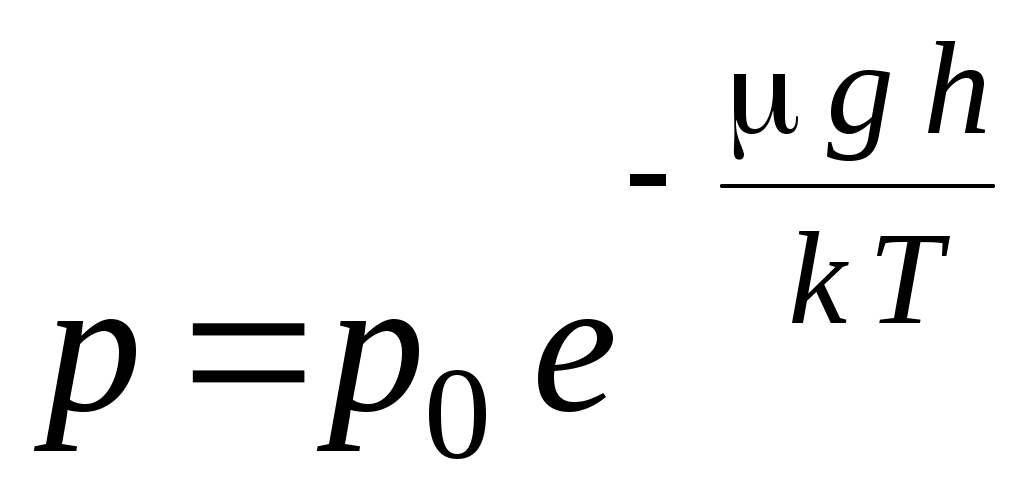 3. 3. 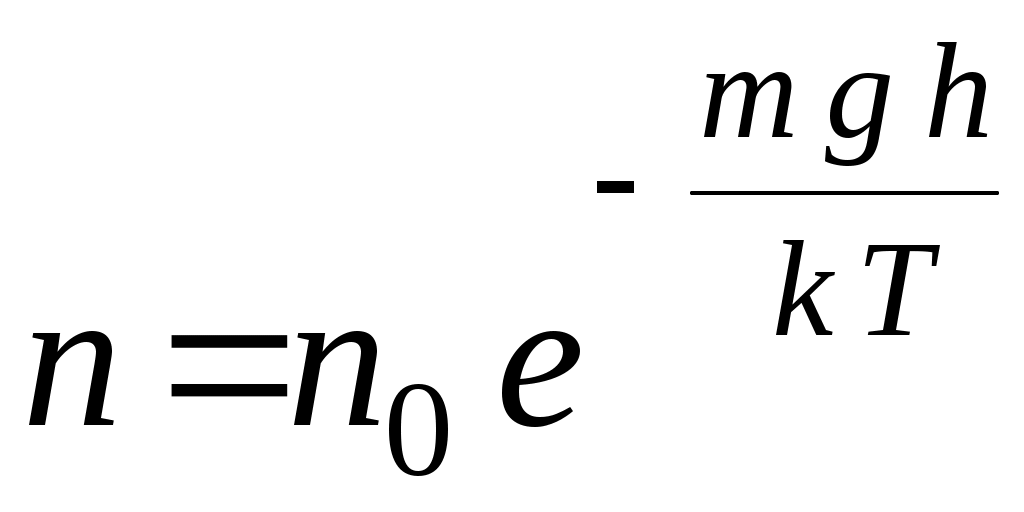
4. 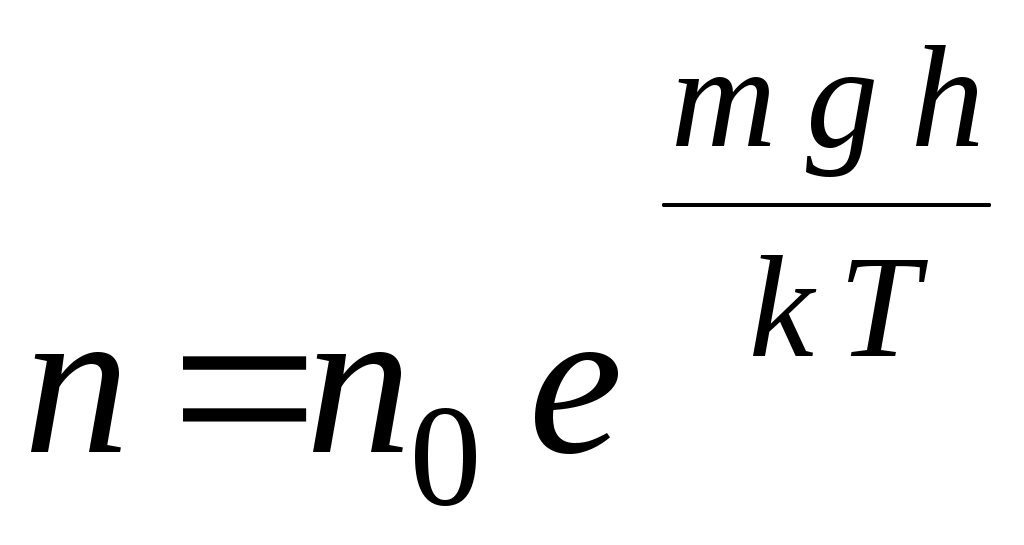 5. 5. 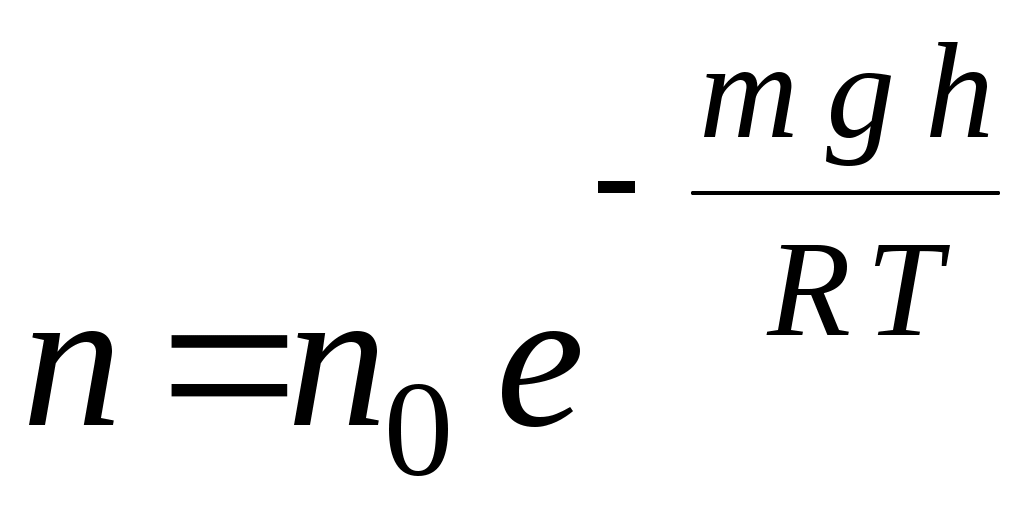
34. Если считать температуру воздуха везде одинаковой и равной 10°С, то давление воздуха составляет 60 % от давления на уровне моря на высоте
1.
1 км 2.
2 км 3.
3 км 4.
4 км 5.
5 км
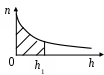
35. На рисунке дан график зависимости концентрации n молекул воздуха от высоты h над поверхностью Земли. Заштрихованная площадь определяет
число молекул в столбе высотой h1 с площадью основания 1 м2
число молекул в кубе с ребром h1
число молекул в 1 м3
концентрацию молекул на высоте h1
среднюю концентрацию молекул на высотах от 0 до h1
36. Полагая температуру воздуха и ускорение свободного падения не зависящей от высоты, определить, на какой высотеh над уровнем моря плотность воздуха меньше своего значения на уровне моря в е раз. Температуру взять равной 0°С.
1. 6 км 2. 7 км 3. 8 км 4. 9 км 5. 10 км
37. При протекании обратимого адиабатического процесса статистический вес состояния некоторой термодинамической системы
увеличивается
не изменяется
уменьшается
не может уменьшаться
не может увеличиваться
38. Некоторая термодинамическая система перешла из состояния 1 в состояние 2. Статистический вес второго состояния превосходит статистический вес первого состояния в 2 раза. Приращение энтропии системы равно (Дж/К)
1. 1,38 · 10-23 2. 0,96 · 10-23 3. 8,31 4. 5,96
5. невозможно определить
39. Идеальный газ совершает цикл Карно. 2/3 количества теплоты, полученного от нагревателя, газ отдает холодильнику. Температура нагревателя 147° С. Температура холодильника (°С)
1. 98 2. 85 3. 46 4. 28 5. 7
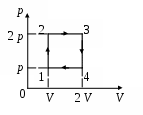
40. Один моль идеального одноатомного газа изменяет свое состояние по циклу изображенному на рисунке. В точке 1 температура газа Т0. Количество теплоты, полученное от нагревателя за цикл
1. R Т0 2. 2R Т0
3. 4,5R Т0 4. 5R Т0 5. 6,5R Т0
41. Совершая замкнутый процесс, газ получил от нагревателя количество теплоты 4 кДж. КПД цикла 10%. Работа газа за цикл равна (Дж)
1. 400 2. 4000 3. 1200 4. 200 5. 800
42. Идеальный тепловой двигатель мощностью 15 кВт отдает холодильнику 35 кДж теплоты каждую секунду. Отношение абсолютных температур холодильника и нагревателя равно
1. 0,2 2. 0,3 3. 0,5 4. 0,6 5. 0,7
43. В контакте с нагревателем при температуре Т1 энтропия рабочего тела машины, работающей по циклу Карно, изменилась от S1 до S2. При этом машина совершила работу
1. Т1S1 2. Т1S2 3. Т1(S1 + S2 ) 4. Т1(S2 – S1 ) 5. Т1(S1 – S2 )
44. В идеальной машине с температурами нагревателя и холодильника Т1 и Т2 энтропия рабочего тела меняется в пределах от S1 до S2. Работа машины за цикл равна
1. Т1S1 – Т2S2 2. Т1S1 + Т2S2 3. (Т1– Т2) (S1+S2)
4. (Т1– Т2) (S2 – S1) 5. (Т1– Т2) (S1 – S2)
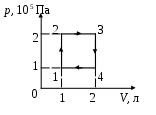
45. Тепловая машина, использующая идеальный двухатомный газ, работает по замкнутому циклу, изображенному на рисунке. КПД машины составляет (%)
1. 10,5 2. 12,3 3. 15,4 4. 18,4 5. 20,2
46. Идеальный газ расширился изобарически от объема V1 до объема V2. При этом его температура и энтропия изменились соответственно
1. от Т1 до Т1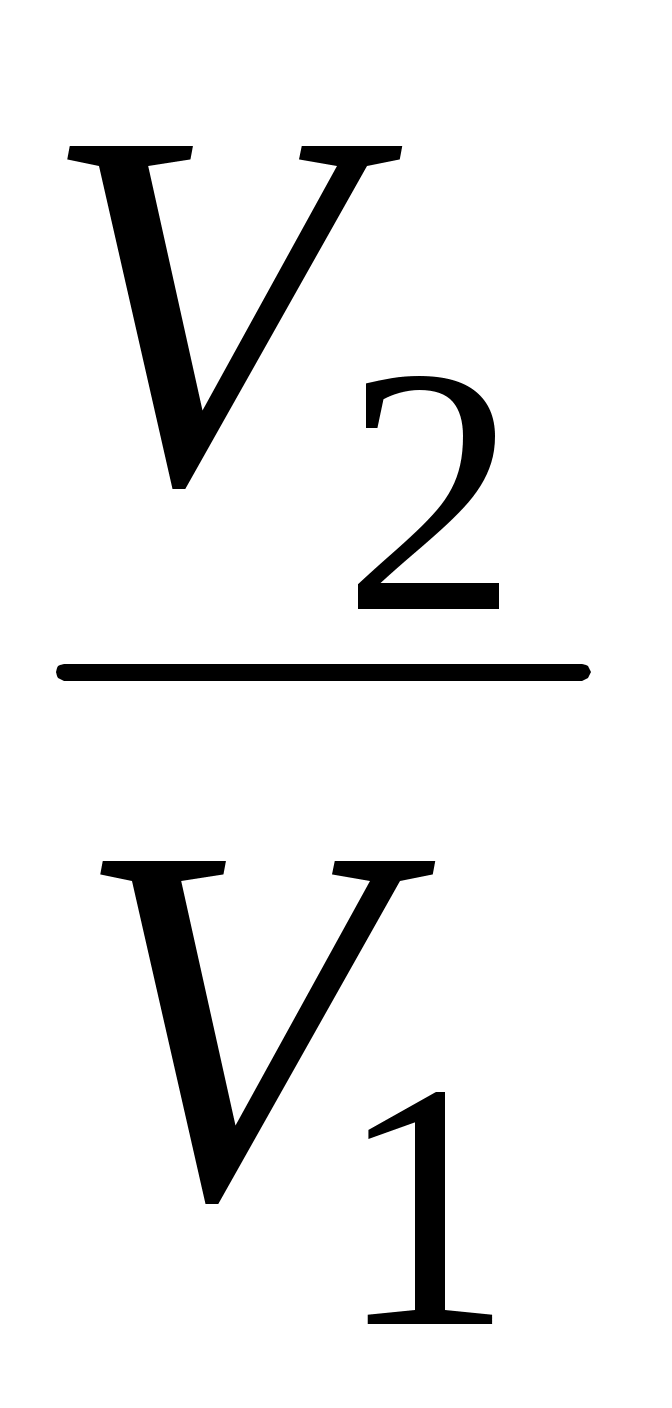 , , 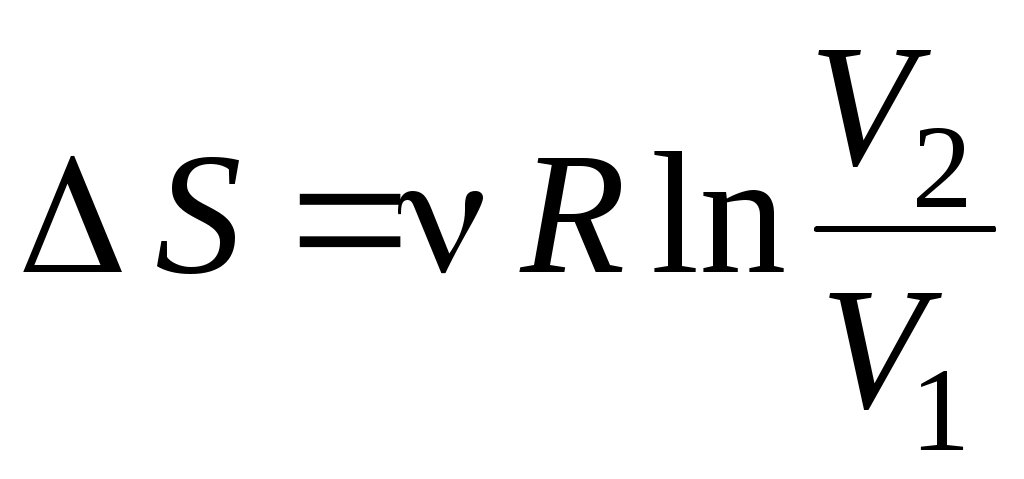 2. 2. 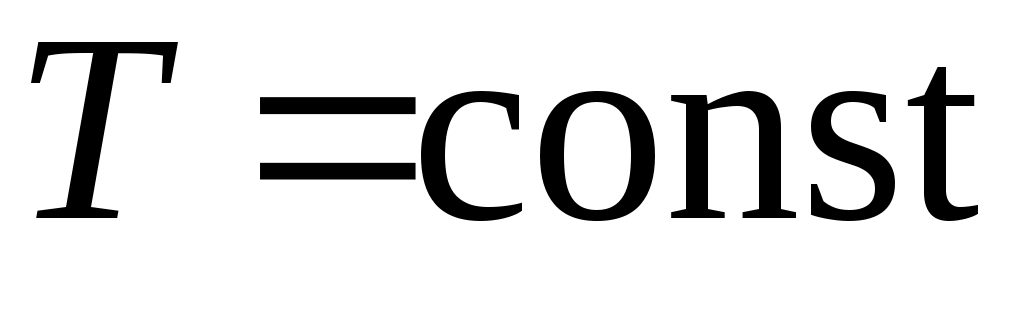 , , 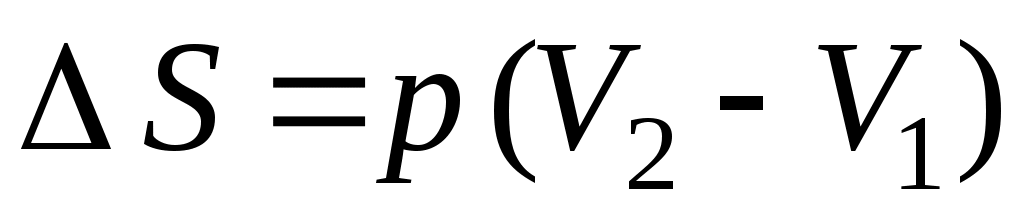
3. от Т1 до Т1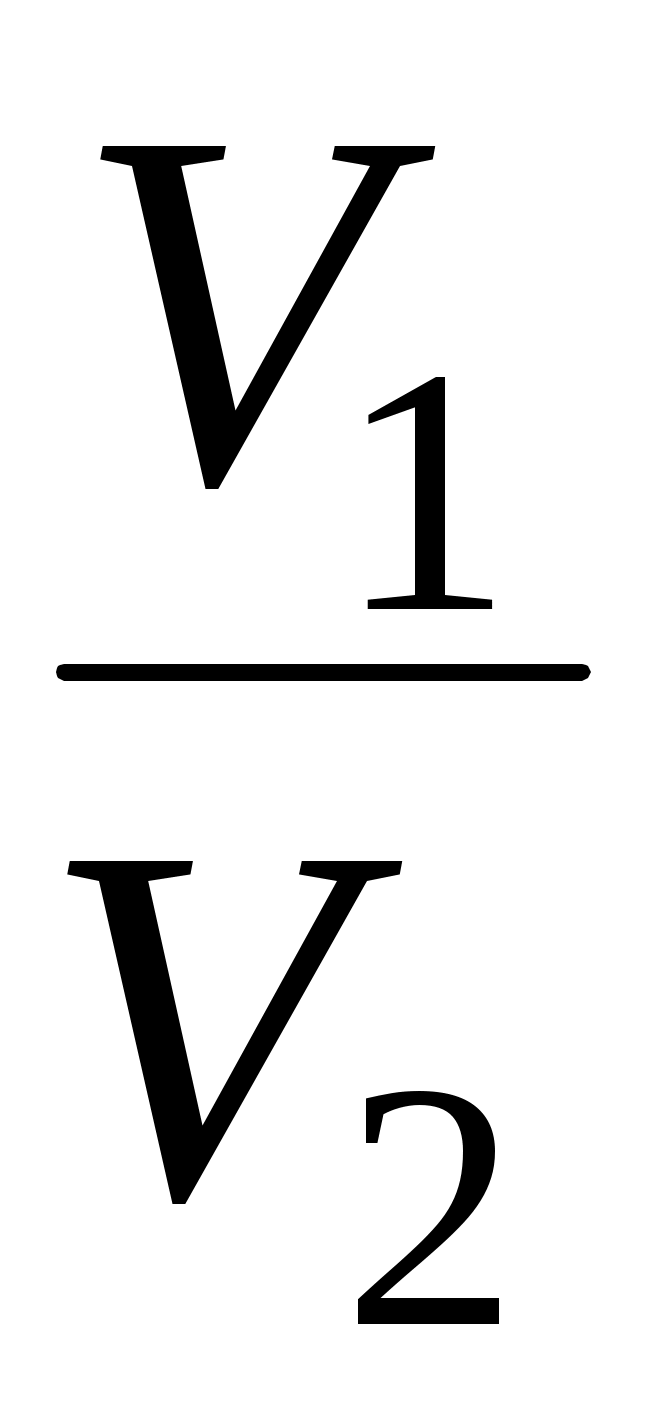 , , 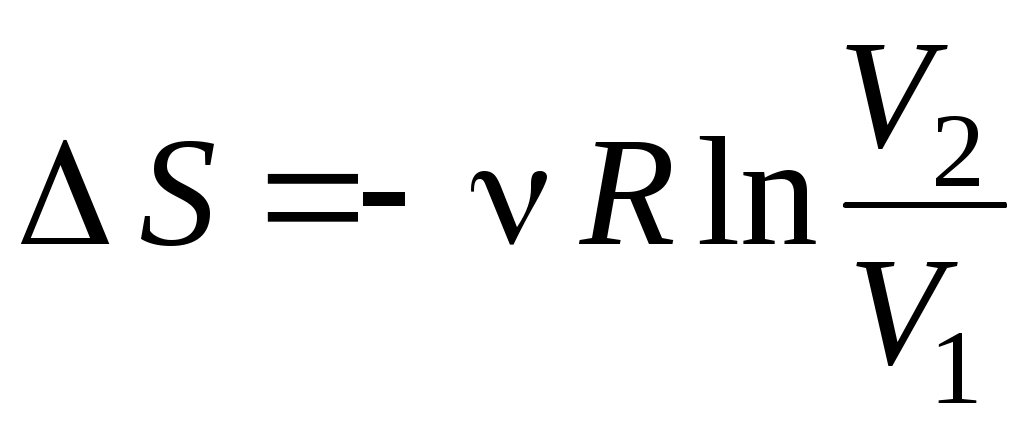 4. от Т1 до Т1 4. от Т1 до Т1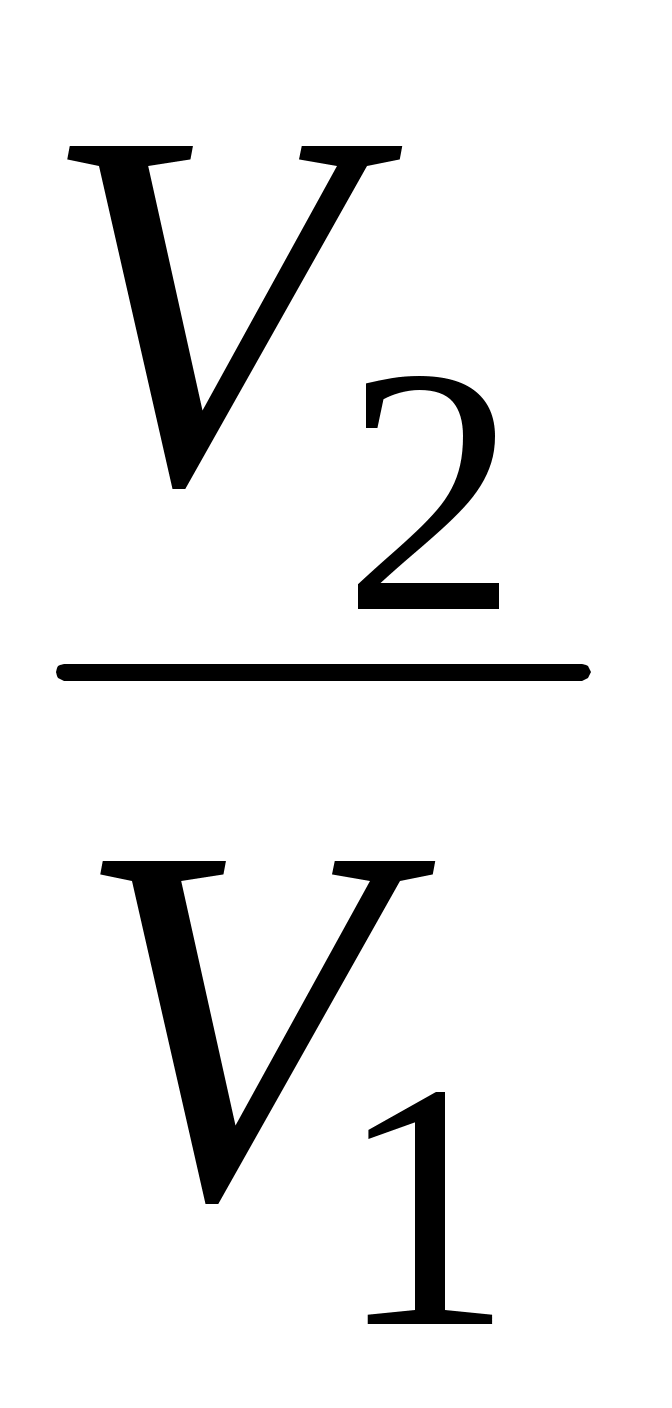 , , 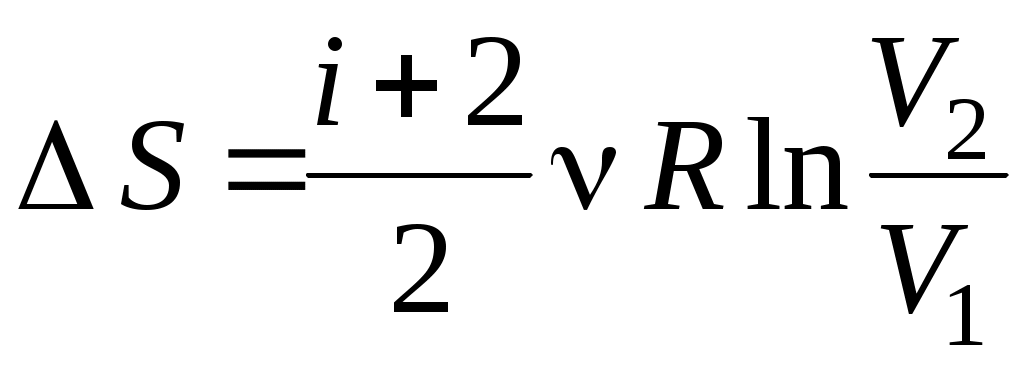
5. 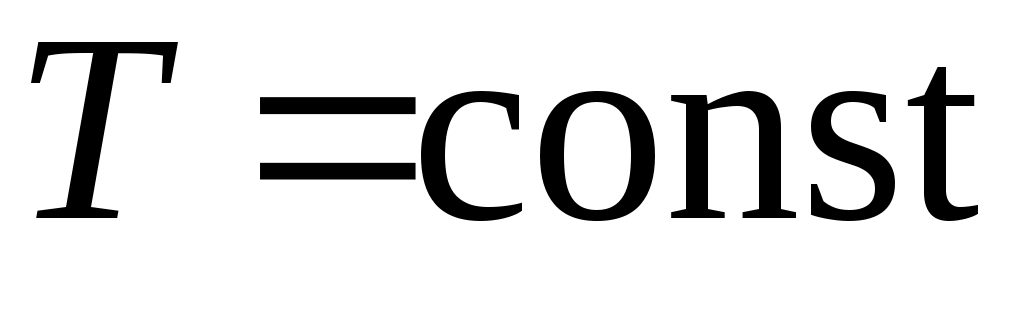 , , 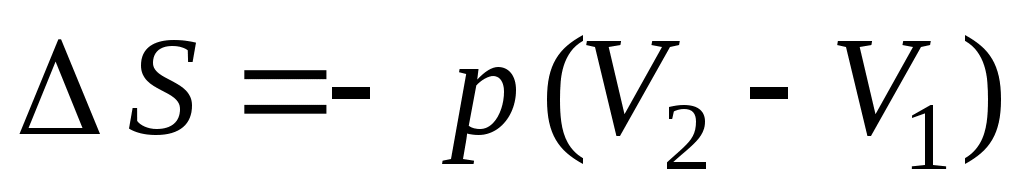
47. Идеальный газ расширился изотермически от объема V1 до объема V2. При этом его давление и энтропия изменились соответственно
1. от р1 до р1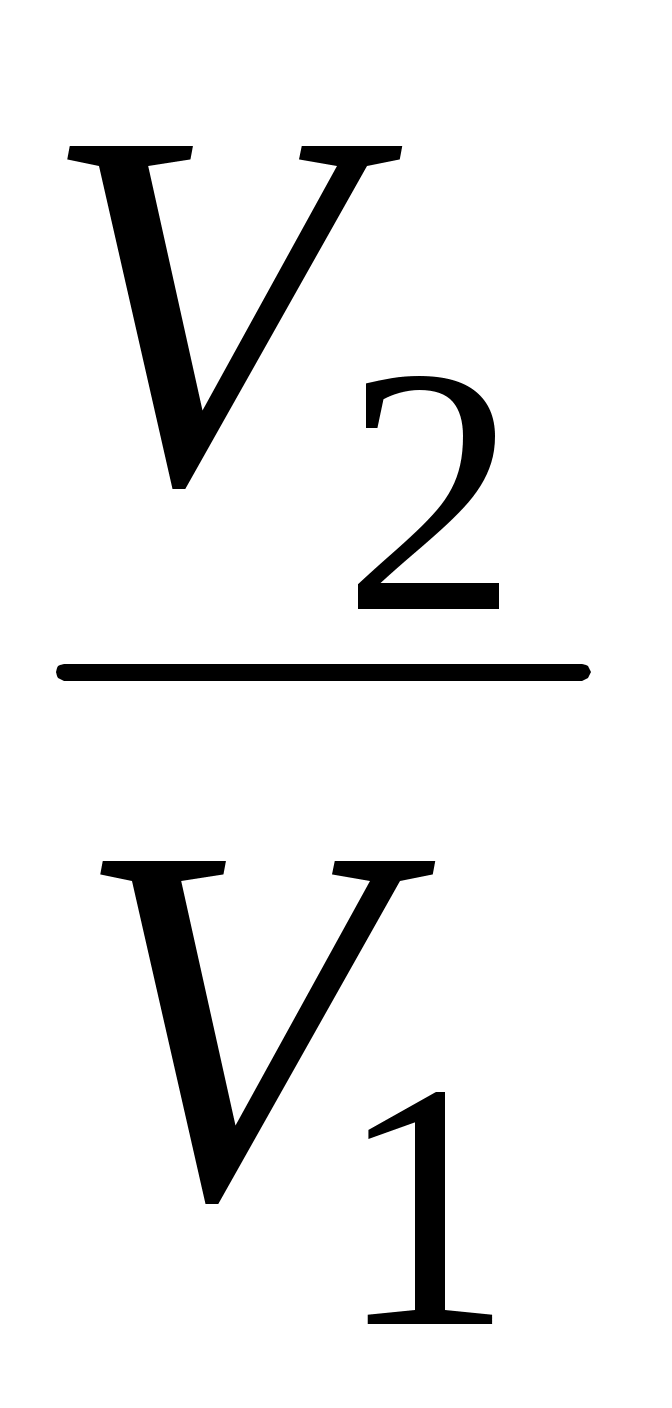 , , 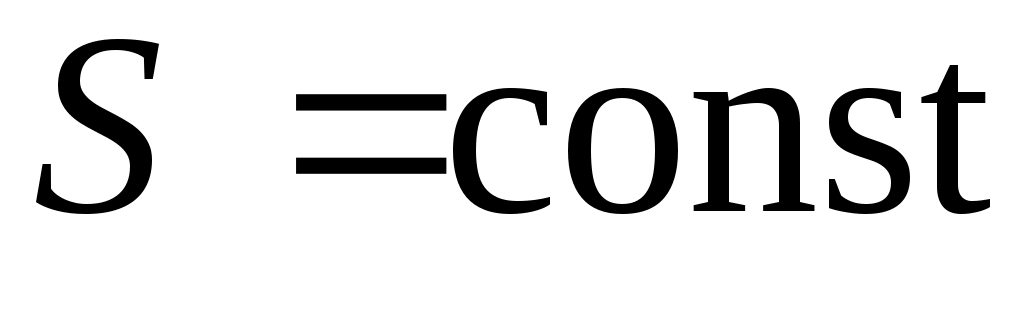 2. 2. 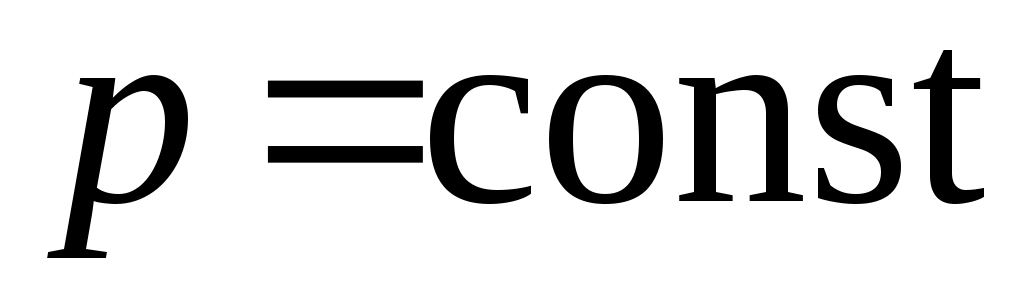 , , 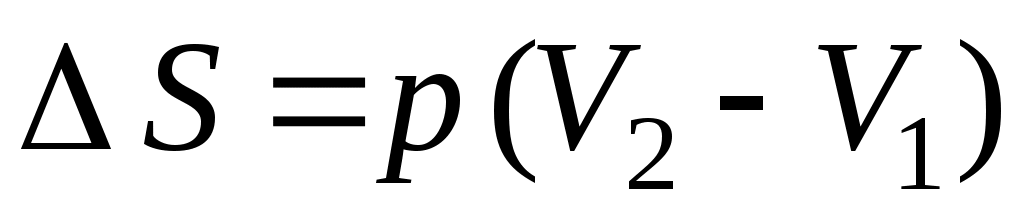
3. от р1 до р1 , , 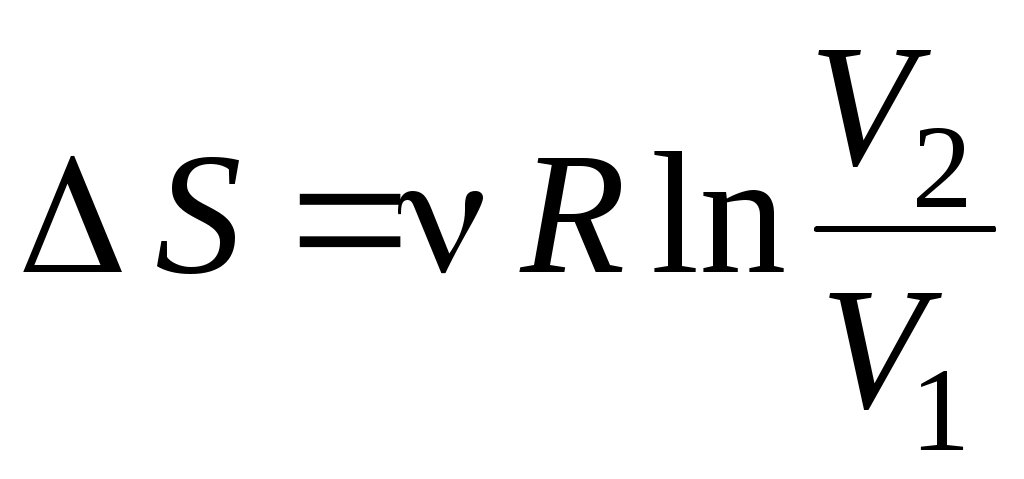 4. от р1 до р1 4. от р1 до р1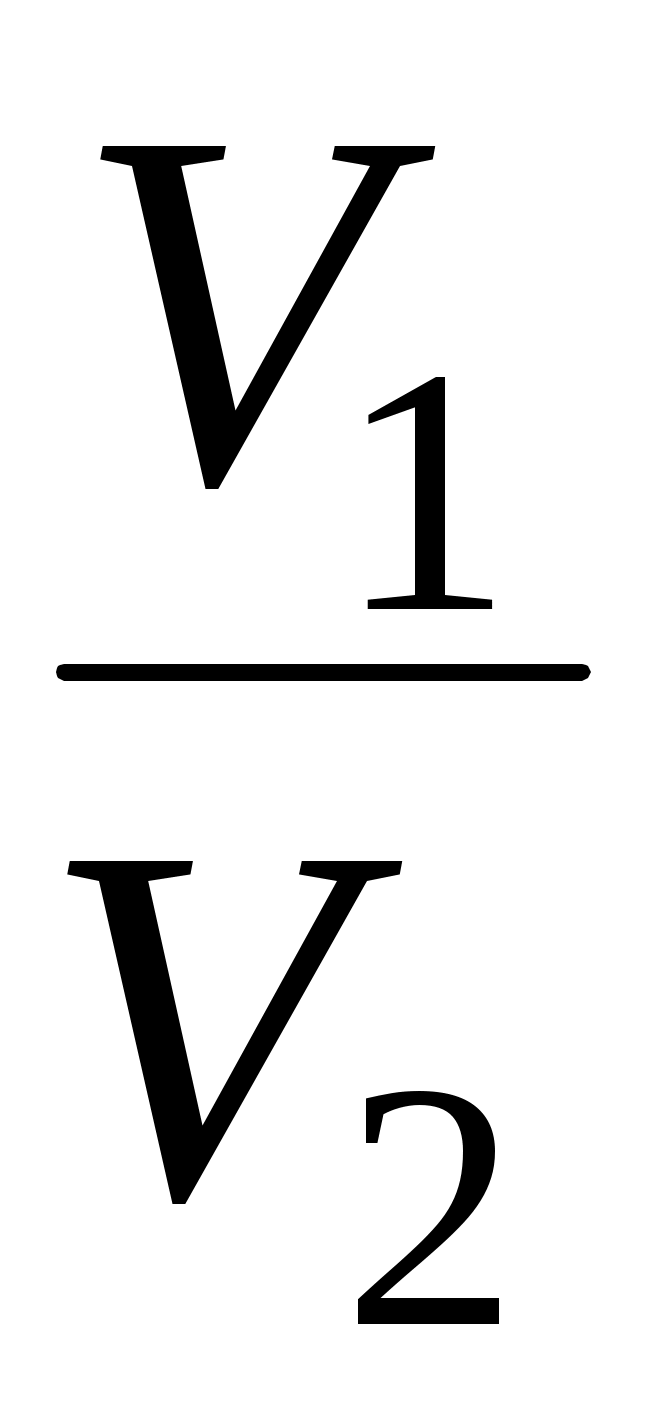 , , 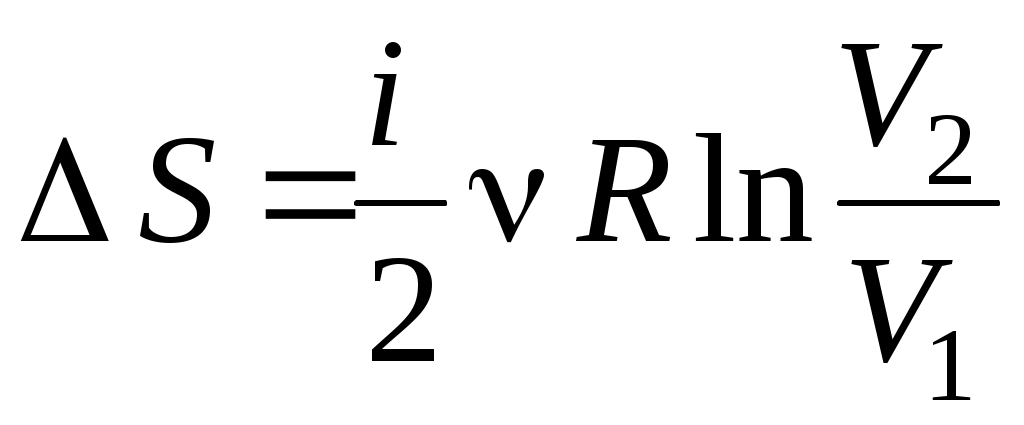
5. от р1 до р1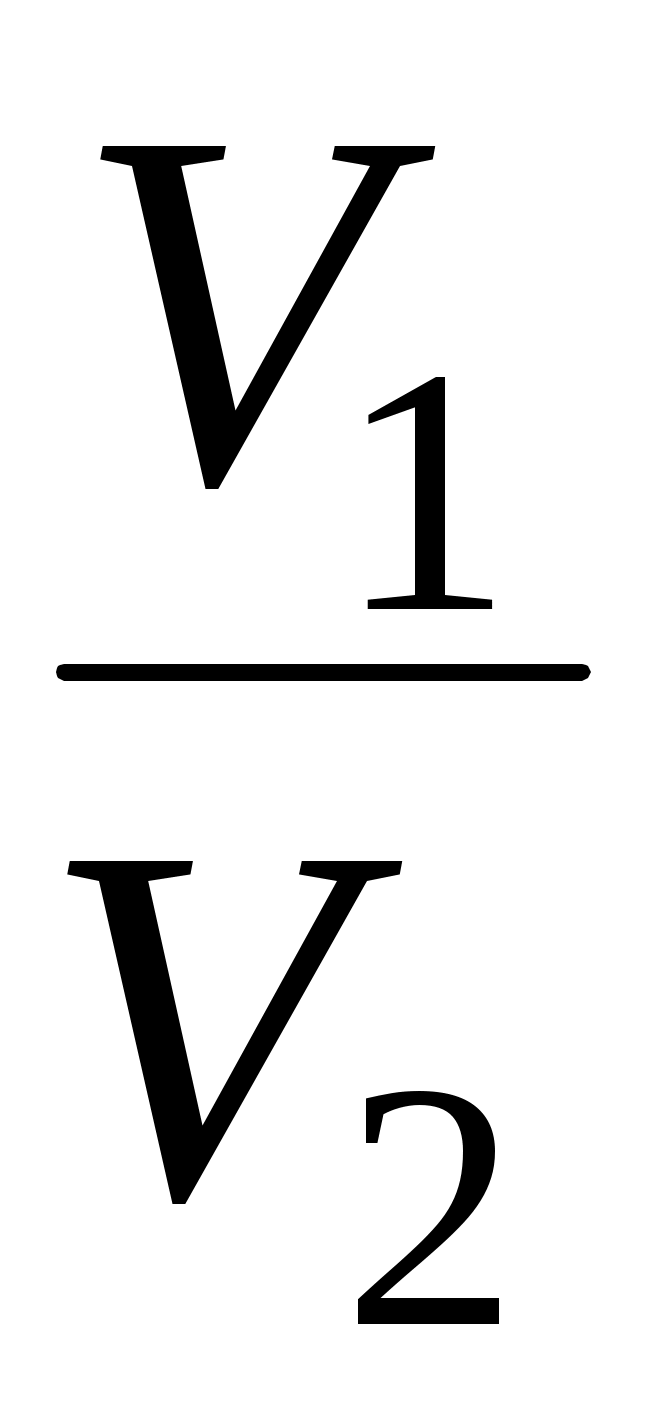 , , 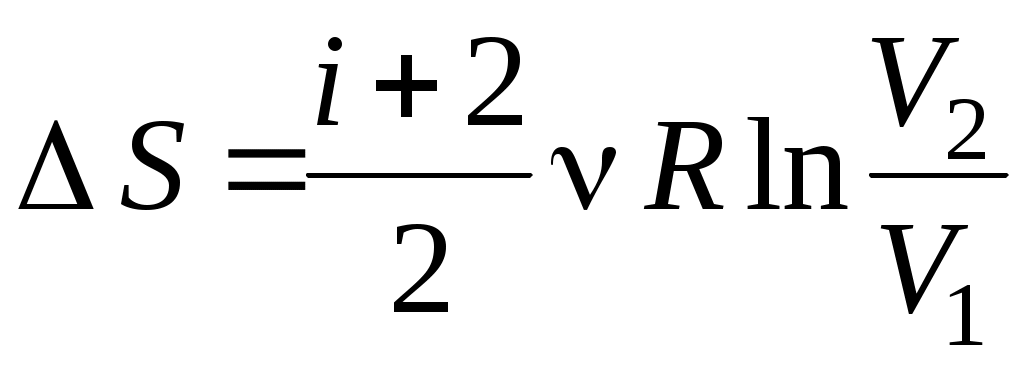
48. В результате изохорного нагревания водорода массой 1 г давление газа увеличилось в 2 раза. Изменение энтропии равно (Дж/К)
1. 14,4 2. 7,2 3. 3,6 4. 1,8 5. 2,2
49. При адиабатном расширении объем кислорода массой 2 кг увеличился в 5 раз. Изменение энтропии равно (Дж/К)
1. 4,25 2. 4,0 3. 2,5 4. 1,5 5. 0
50. Кислород массой 10 г изотермически расширяется, при этом его объем увеличивается в 4 раза. Изменение энтропии равно (Дж/К)
1. 3,6 2. 7,2 3. 10,8 4. 15,2 5. 20,4
|
 Скачать 0.85 Mb.
Скачать 0.85 Mb.

 2.
2. 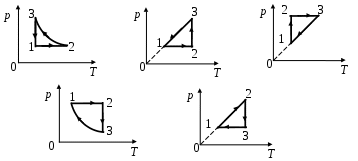
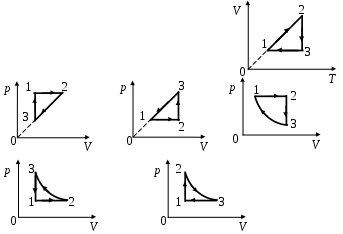
 4.
4.  5.
5. 3.
3.  0.
0. 

