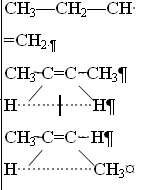
Дивинил кинетика. Охт наука о наиболее экономически и экологически рациональных способах переработки исходных сырьевых материалов в продукты потребления и средства производства
 Скачать 5.66 Mb. Скачать 5.66 Mb.
|
|
Размещено на http://www.allbest.ru/ Содержание дегидрирование бутан катализатор Введение Глава 1 Основные понятия и определения 1.1 Производство н-бутилена дегидрированием н-бутана на шариковом катализаторе 1.2 Основные параметры производства 1.3 Производство н-бутилена дегидрированием н-бутана на взвешенном катализаторе 1.4 Основные параметры производства 1.5 Производство дивинила дегидрированием из бутиленов 1.6 Основные параметры производства Глава 2 Практическая часть Выводы Список литературы Введение ОХТ – наука о наиболее экономически и экологически рациональных способах переработки исходных сырьевых материалов в продукты потребления и средства производства. Химическая технология изучает закономерности протекания химических, теплообменных процессов, способы их проведения, оборудование, в котором осуществляются химико-технологические процессы и как результат разрабатывает оптимальные пути их проведения. Химическая технология базируется на основах органической и неорганической химии, физической химии, термодинамики, процессов и аппаратов, высшей математики. Развитие химической промышленности определяется в значительной степени совершенствованием химической техники. Техника химических производств развивается в основном в тех же направлениях, что и в других отраслях промышленности. Главной целью технического прогресса являются: 1)улучшение качества продукции; 2)повышение производительности труда; 3)снижение себестоимости продукции. Основные взаимосвязанные направления развития химической техники: 1)увеличение масштабов производства, мощностей химико-технологических систем (ХТС) и отдельных аппаратов; 2)интенсификация работы аппаратов; 3)снижение энергозатрат и максимальное использование теплоты химических реакций; 4)уменьшение количества стадий производства и переход к циклическим (замкнутым) системам; 5)замена периодических процессов непрерывными; 6)механизация трудовых операций и автоматизация производства. Химическая технология классифицируется по различным принципам: 1) по сырью (например, технология переработки минерального, растительного или животного сырья; технология угля, нефти и т.п.); 2) по потребительскому, или товарному, признаку (например, технология удобрений, красителей, фармацевтических препаратов); 3) по группам периодической системы элементов (например, технология щелочных металлов, тяжёлых металлов и др.); 4) по типам химических реакций и процессов (технология хлорирования, сульфирования, электролиза и т.п.). Развитие химической технологии идёт по пути комплексного использования сырья и энергии в пределах данного производства или в кооперации с др. производствами, конструирования высокопроизводительной аппаратуры из химически стойких материалов, разработки непрерывных и замкнутых («безотходных») процессов, исключающих загрязнение воздушного и водного бассейнов вредными промышленными отходами, расширения диапазонов температур и давлений, использования каталитических реакций, применения процессов в псевдоожиженном слое, развития систем автоматизации, контрольно-измерительной техники и т.п. Основой моей курсовой работы является реакция дегидрирования н-бутана, в результате чего образуется н-бутилен— С4Н8, он находит применение в производстве растворителей, служит сырьём для получения высокооктанового моторного топлива, а также в производстве резин и каучуков. Мы поставили перед собой следующие цели в курсовой работе: -моделирование процесса дегидрирование бутана -выбор наиболее выгодного температурного режима -обеспечение максимальной производительности бутилена Глава 1. Основные понятия Н-бутилен, н—С4Н8, находит применение, как сырье для получения метилэтилкстона, являющегося ценным растворителем; служит исходным веществом в производстве СК через дивинил, используется для получения высокооктанового моторного топлива. Сырьем для производства н-бутилена является н-бутан, выделенный из крекинг-газа, полученный при прямой перегонке нефти или при стабилизации газового бензина. Производство н-бутилена из бутана осуществляется методом каталитического высокотемпературного дегидрирования. При этом получаются все три изомера н-бутилена, свойства которых приведены в таблице.[1] Таблица 1- Физические параметры
Основная реакция дегидрирования н-бутана: н—С4Н10 → Н2+С4Н8, осложняется побочными реакциями термического крекинга: н-С4Н10 → С3Н6+СН4 ; н-С4Н10 → С2Н4+ С2Н6. Реакциями дальнейшего дегидрирования до дивинила: н—С4Н8 → С4Н6+Н2 Протекают также реакции полимеризации, реакции изомеризации, одновременно идут реакции распада углеводородов с образованием углерода, отлагающегося в виде кокса на катализаторе. Суммарное уравнение распада бутана: н—С4Н10→ 5Н2+4С Для подавления побочных реакций и увеличения выхода бутена—1, лучше-других изомеров дегидрирующегося в дивинил, процесс ведут с алю-мо-хромовым катализатором при температуре 550—600°С, при атмосферном давлении. Дегидрирование н-бутана возможно на неподвижном катализаторе, помещенном в трубчатый контактный аппарат или в шахтную печь. Катализатор предварительно прогревается до 590—600°С, затем через него пропускается бутановая фракция. Вследствие эндотермичности реакции дегидрирования температура в контактном аппарате понижается до 555—560°С, и он переключается на регенерацию. Через насадку пропускается горячий воздух, происходит выгорание отложившихся сажи и смолистых веществ, температура в аппарате поднимается до первоначальной и цикл возобновляется. Дегидрирование н-бутана на движущемся зерненом (шариковом) катализаторе позволяет получать бутилен с более высоким выходом, чем на неподвижном катализаторе, за счет уменьшения времени пребывания газов в зоне реакции и более равномерного обогрева. Процесс протекает по непрерывной схеме. Установка состоит из реактора, регенератора и топки. Катализатор опускается из регенератора в реактор под действием силы тяжести и транспортируется после отработки обратно в регенератор горячим сжатым воздухом. Сложность конструктивного оформления аппаратов обусловливается необходимостью герметизации при движении твердого материала (шариков), высокой температуре и значительном истирании, движущимся катализатором. Расход катализатора 15—16 кг—на 1 тонну готового продукта. Работа установки со взвешенным катализатором заключается в следующем. При определенном сопротивлении и весе мелких частиц катализатора, насыпанного на решетку, создается необходимая скорость газового потока н-бутана, при которой подъемная сила уравновешивает вес и сопротивление слоя катализатора, благодаря чему частицы катализатора переходят во взвешенное состояпие и находятся в турбулентном движении. При подборе соответствующих критериев взвешенный слой будет находиться в достаточной динамической устойчивости. Теплообмен в такой системе будет осуществляться наиболее полно, местные перегревы почти исключаются. Выход н-бутилепа составляет 39%, против 34% в установке с шариковым катализатором. Регенерация катализатора производится в отдельном аппарате, что позволяет вести процесс дегидрировапия непрерывно и не иметь больших теплопотерь, связанных с периодичностью работы. Катализатором процесса дегидрирования являются зерна окиси алюминия с окисью хрома, диаметром 1,0—1,5мм. Указанный катализатор в отсутствии влаги—довольно устойчив в работе. 1.1 Производства н-бутилена дегидрированием н-бутана на шариковом катализаторе По описываемой схеме получение бутилена и осуществляется на шариковом катализаторе. Транспортировка катализатора в системе производится скиповым подъемником. Подъемник прост по конструкции, работа его может быть полностью автоматизирована. Истирание катализатора при применении скипового подъемника значительно меньше, чем в ковшовых ценных элеваторах или ноздухоподъомниках и составляет 3,5-4 кг на 1 т целевого продукта. Жидкая бутановая фракции из емкости 9 насосом подается в мерник 1, из которого сливается в буфер 10, затем в испаритель 11. Пары бутиленовой фракции проходят через буфер 10 в осушитель 12, заполненный прокаленным хлористым кальцием, для освобождения от следов влаги, являющейся ядом для катализатора. Осушенная бутиленовая фракция подогревается в теплообменнике 13 и поступает в реактор 7, где встречается с движущимися вниз шариками катализатора. В реакторе протекают реакции дегидрирования н-бутана по схеме: н – С4Н10 → С4Н8 + Н2 Продукты реакции охлаждаются до температуры 400°С впрыскиванием воды, для предотвращения протекания побочных реакций, охлаждаются в теплообменнике 13, подогревая бутановую фракцию, идущую в реактор. Затем отдают свое тепло в котлах-утилизаторах (на схеме не показано) и направляются на разделение. Отработанный, зауглероженный катализатор через газовый затвор 6 и регулятор осыпания 8 поступает в бункер 14. Из последнего катализатор периодически загружается в скип подъемника 15, транспортируется наверх и высыпается в бункер 3. Регенерация катализатора производится в регенераторе 5. Необходимая температура 650—680°С достигается подачей дымовых газов из топки 4, где сжигается топливный газ. Воздух, необходимый для сжигания углеродистых отложений на катализаторе, подается также через топку и примешивается к продуктам сгорания топливного газа. Нагретый и регенерированный катализатор непрерывно опускается в реактор 7 по переточной трубе с газовым затвором 6. Дымовые газы из регенератора 5 поступают в циклон 2, где улавливаются частицы унесенного газами катализатора, и поступают под котел-утилизатор для использования тепла (на схеме не показано). 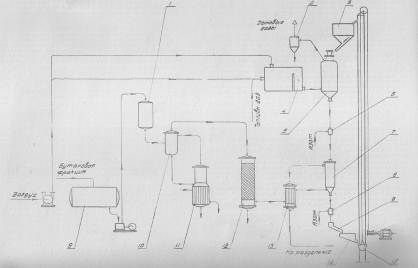 Схема № 1. Технологическая схема производства н-бутилена дегидрированием н-бутана на шариковом катализаторе: 1-мерник для бутана; 2-циклон; 3,14-бункеры; 4-топка; 5-регенератор, 6-газовые затворы, 7-реактор, 8-регулятор ссыпания катализатора, 9-емкость, 10-буфер, 11-испаритель, 12-осушитель, 13-теплообменник, 15-скип подъемник. Направленность газовых потоков обеспечивается сопротивлением катализатора в переточных трубах и соблюдением определенных перепадов давлений в некоторых точках по высоте установки. В верхнем газовом затворе 6 давление поддерживается подачей азота на 20 мм вод. ст. выше, чем давление в верхней части реактора 7, в нижнем газовом затворе давление выше на 20 мм вод. ст., чем в нижней части реактора, Благодаря этому исключается проскок контактного газа в регенератор и бутана в нижний бункер 8. 1.2 Основные параметры производства На полупромышленной установке установлен оптимальный режим дегидрирования н-бутана с подвижным шариковым катализатором К-5. Объемная скорость н-бутана 170—180 км3на 1 м2катализатора в час. Катализатор К-5 шарики диаметром 5—7 мм Скорость циркуляции катализатора 8,5 кг на 1 кг подаваемого бутана Температура катализатора на входе в реактор 610—620°С Температура контактного газа на выходе из реактора 590—600°С Реакционная масса содержит: бутиленов 74—75% дивинила около 8% Выход бутиленов и дивинила на пропущенную фракцию С4 38—39% Выход бутиленов и дивинила на разложенную фракцию С4 80—85% На 1 тцелевого продукта катализатора расходуется 20 кг 1.3 Производство н-бутилена дегидрированием н-бутана на взвешенном катализаторе По описываемой схеме получение бутилена протекает следующим образом: бутановая фракция осушается хлористым кальцием в осушителе 12, испаряется в испарителе 1, перегревается в печи 13, после чего поступает в реактор 19. В него же из регенератора 7 спускается регенерированный катализатор. В слое взвешенного катализатора и протекает реакция дегидрирования бутана: н—С4Н10 → С4Н8+Н2. Образовавшиеся реакционные газы отделяются в верхней части реактора от катализатора, отдают часть своего тепла в котлах-утилизаторах 20, охлаждаясь до 300°С, и поступают в скруббер 10 для дальнейшего охлаждения и очистки от пыли. Для уменьшения потерь газа орошение скруббера производится водой, циркулирующей через холодильник 21. Свежая вода вводится только при частичном сбросе оборотной воды для извлечения из нее катализатора. При последующем охлаждении в холодильнике 11 из реакционных газов выделяется часть унесенной ими из скруббера влаги, после чего они направляются на разделение. Отработанный катализатор спускается в нижнюю часть реактора, продувается азотом для удаления углеводородных газов и попадает в транспортную линию, по которой сильной струей воздуха, поступающего из топки 9, нагнетается под давлением 1,8 атм.в нижнюю часть регенератора 7, в зону регенерации. Регенерированный катализатор непрерывно спускается в реактор 19. Дымовые газы, содержащие продукты горения кокса, отложившегося на катализаторе, из верхней части регенератора 7 направляются в котел-утилизатор 6, служащий для получения пара, проходят увлажнитель 4, электрофильтр 3 дли улавливания частиц катализатора, и сбрасываются в атмосферу. Пар, получающийся в котлах-утилизаторах 20 и 6, проходит паросборники 8 и 5 и перегревается до 200°С в пароперегревателе 2. Катализатор в производство подается в автобункере 15. Сжатым воздухом нагнетается в питательный бункер 14, из которого периодически поступает в реактор 19. 1.4 Основные параметры производства Сырье—бутановая фракция с содержанием н- С4Н10 92% (объемя.) Температура в испарителе 1 60°С Температура в пароперегревателе 13 550°С Температура в реакционной зоне реактора 19 590—600°С Температура в регенераторе 7 650°С Давление в системе реактор-генератор 1—1,8 атм Температура дымовых газов после котлов-утилизаторов 300°С Средний состав реакционного газа, выходящего из контактного аппарата: водород 32, бутилен 26, бутан 34, метан 3, дивинил 2, углекислый газ 2, др. углеводороды 1% объемных. Расход катализатора на 1 г дегидрируемой фракции 5 кг Конверсия н-бутана 39—42% 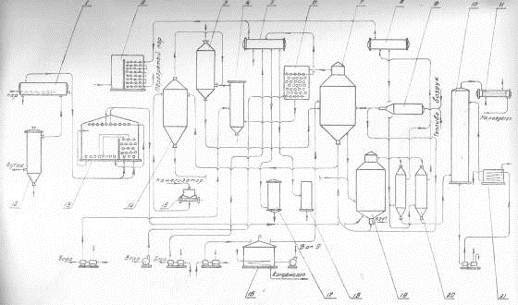 Схема № 2. Технологическая схема производства н-бутилена дегидрированием н-бутана на взвешенном катализаторе. 1—испаритель, 2—пароперегреватель, 3—электрофильтр, 4 —увлажнитель, 5,8—сборники пара, 6—котел-утилизатор, 7— регенератор, 9—топка под давлением, 10-скруббер, 11—холодильник контактного газа, 12—осушитель бутана, 13—трубчатая печь, 14—загрузочный бункер, 15—автобункер, 16—топливный мерник, 17—сепаратор паровой продувки, 18—барботер, 19—реактор, 20—котел-утилизатор, 21—холодильник циркулирующей воды. 1.5 Производство дивинила дегидрированием из бутиленов бутилен бутан дегидрирование Производство дивинила из бутиленов протекает в три стадии: 1) дегидрирование бутиленов; 2) первичное разделение продуктов дегидрирования бутиленов; 3) разделение фракции углеводородов С4, полученной на предыдущей стадии, с выделением технического дивинила. Дегидрирование бутиленов проводят обычно на катализаторе, состоящем из окиси магния, окисей железа, меди и кальция. При работе железо-магниевый катализатор долгое время сохраняет высокую активность и избирательность в присутствии водяного пара. Катализаторы же, состоящие в основном из окиси хрома, хотя и обладают высокой степенью активности, но очень быстро дезактивируются при наличии водяных паров в бутиленах. Это не дает возможности применять в процессе дегидрирования водяной пар, необходимый в качестве разбавителя, понижающего парциальное давление бутиленов, что способствует увеличению выхода днвппила. Бутилены, полученные дегидрированием н-бутана (схемы №№ 1, 2), из емкости 16 подаются насосом в печь для перегрева 17 и направляются затем в один из контактных аппаратов 1—2, работающих периодически, так как в результате побочных реакций на катализаторе отлагаются смолистые вещества и сажа, вследствие чего активность его падает. Поэтому периодически один из контактных аппаратов находится на регенерации. В контактных аппаратах во время контактирования протекает реакция образования дивинила: н-С4Н8 → С4Н6+Н2 Побочные реакции приводят к образованию легких углеводородов, а также к образованию смолистых веществ и сажи, вследствие дальнейшего уплотнения углеводородов. 3С4Н8 → СН4+С3Н6+С8Н14 Регенерация катализатора в контактных аппаратах производится паром, регенерациопные газы выпускаются из системы (коммуникация, необходимая для регенерации, на схеме не показана).[2] Реакционные газы из контактных аппаратов поступают в скруббер для охлаждения 3, орошаемый водой. Часть воды, вытекающей из этого скруббера, подается в контактные аппараты. Остальное количество воды, после охлаждения в холодильнике 10, возвращается на орошение скруббера 3. Реакционные газы, выходящие из скруббера 3, через промежуточную емкость 19 подаются компрессором в скруббер 4, предварительно охлаждаясь в холодильнике 13. В скруббере 4, орошаемом поглотительным маслом, извлекается из реакционных газов фракция C4. Непоглощенные легкие углеводороды и водород отводятся из системы и используются как топливный газ. Поглотительное масло с содержащейся в нем фракцией С4 через подогреватель 11 подается насосом в стабилизатор 5, служащий для отделения из поглотительного масла некоторого количества поглощенных им легких углеводородов. Легкие углеводороды проходят через дефлегматор 6, отделяются от части увлеченпого поглотительного масла в фазоразделителе и выводятся из системы. Обогрев стабилизатора производится с помощью кипятильника 14. Поглотительное масло из стабилизатора 5 переходит в отгонную колонну 8, обогреваемую острым паром. Поглотительное масло, из которого отогнались углероды Сі, по выходе из отгонпой колонны охлаждается в холодильнике 15 и собирается в сборнике 20, откуда центробежным насосом подается на орошение скруббера 4. Углеводороды фракции С4 выходят сверху из отгонпой колонны 8, проходят через дефлегматор 9, охлаждаются в холодильнике 12 и собираются в сборнике 21, из которого откачиваются на установку для выделения дивинила. 1.6 Основные параметры производства Отношение бутиленов к водяному пару, подаваемых в контактные аппараты 1:7-1:14 по объему Температура в контактных аппаратах 650-700°С Катализатор состоит из окиси магния 72,4% окиси железа 18,4% окиси меди 4,6% окиси калия 4,6%. Цикл работы контактного аппарата (В цикл входит контактирование — 1 час и регенерация — 1 час) Давлепие в скруббере 4 35 атм Давление в отгонной колонне 8 10 атм Объемная скорость в контактном аппарате 800 час-1 Давление в системе контактирования около 1 атм Выход дивинила от исходного бутилена около 30% 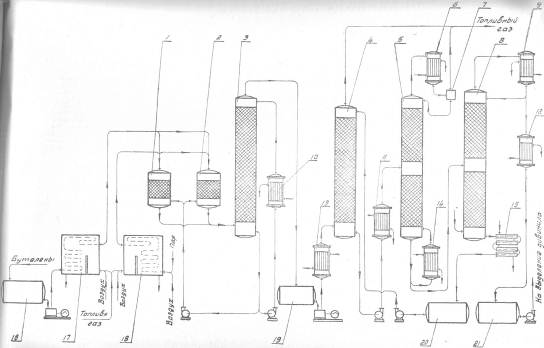 Схема № 3. Технологическая схема производства дивинила из бутиленов. 1,2 - контактные аппараты, 3—скруббер-охладитель, 4, 5—стабилизаторы, 6, 9—дефлегматоры, 7—фазоразделитель, 8—отгонная колонна, 10, 12, 13—холодильники, 11-подогреватель, 14 -кипятильник, 15—холодильник, 16, 19—емкости, 17—печь д/перегрева бутиленов, 18—печь для перегрева водяного пара, 20, 21 —сборники. Глава 2. Практическая часть Математическая модель – это система уравнений, которая устанавливает взаимосвязь между входными и выходными параметрами реактора. Математическая модель реактора должна содержать минимальное количество уравнений при сохранении качественных и количественных характеристик реактора. Математическую модель реактора рассматривают по четырём уровням: Уравнение материального баланса. Уравнение теплового баланса. Кинетическое уравнение (или уравнения, если в реакторе протекает несколько реакций). Уравнение, описывающее гидродинамическую обстановку в реакторе. Для упрощения математической модели вводят допущения, которые существенно упрощают математический аппарат, при этом не изменяют сущность рассматриваемого объекта. Применительно к химическому реактору, наибольшую сложность представляют уравнения, описывающие гидродинамическую обстановку в реакторе. Поэтому были созданы модели идеализированных реакторов, в которых характер движения реагентов ограничивается двумя режимами: полного смешения и идеального вытеснения. Модель идеального вытеснения предполагает, что реактор представляет собой вытянутый канал, то есть один из геометрических размеров которого (длина или высота) много больше другого геометрического размера (диаметра): L>>D или H>>D. Модель идеального вытеснения предполагает «поршневой» режим движения реагентов. То есть поток реагентов можно разбить на N слоёв бесконечно малой длины, каждый из которых продвигается в направлении от входа в реактор к выходу, выталкивая впереди идущий слой. Таким образом, в модели идеального вытеснения запрещено перемешивание в направлении оси потока, но разрешено радиальное перемешивание. В отличие от модели полного смешения, в реакторе идеального вытеснения (РИВ) изменение всех параметров происходит плавно по длине реактора. По модели РИВ могут рассматриваться только проточные реактора. Дегидрирование бутана проводят в адиабатическом реакторе полного смешения. Кинетическое уравнение: U=k+*(PC4H10/PC4H8)*(1-P C4H8*PH2/( PC4H10*Kp)) (м3С4H10/м3*с) Зависимость константы скорости прямой реакции от температуры: Lg(K+)=9,6-9050/T Зависимость константы равновесия от температуры: lgKp=-6700/T +7.574 Определить наилучший температурный режим реактора полного смешения и производительность по бутену, если исходный состав (мольные доли): бутан 0,1-0,3 , бутен 0,01, водород 0,02, остальное – азот, расход смеси 10000-20000 м3/ч, температура смеси на входе в реактор 800-1200 К, давление 0,5 -2 Мпа. С4H10 →C4H8 + H2  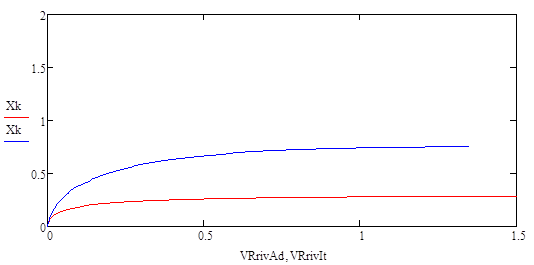 Так как адиабатический коэффициент нашей задачи имеет отрицательный знак то температура в адиабатическом реакторе будет ниже, а значит константа реакции будет меньше при адиабатическом ,чем при изотермическом режиме реактора. Следовательно при одинаковом объёме реактора степень превращения при изотермическом режиме будет выше. Таким образом, выгоднее будет использовать изотермический режим. Построим график для производительности:  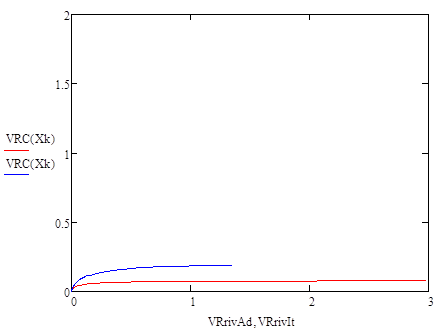 На данной графической зависимости видно, что производительность изотермического реактора выше, чем адиабатического реактора. Это обусловлено тем, что степень превращения в изотермическом выше, чем в адиабатическом реакторе. Следовательно, максимальная производительность н-бутилена обеспечивается при использовании изотермического температурного режима. [3] Рассмотрим изменения производительности в температурном интервале 800-1200: Приведем и рассмотрим три графических зависимости для производительности, меняя температуру реактора на входе. T= 800 K  T= 1000 K 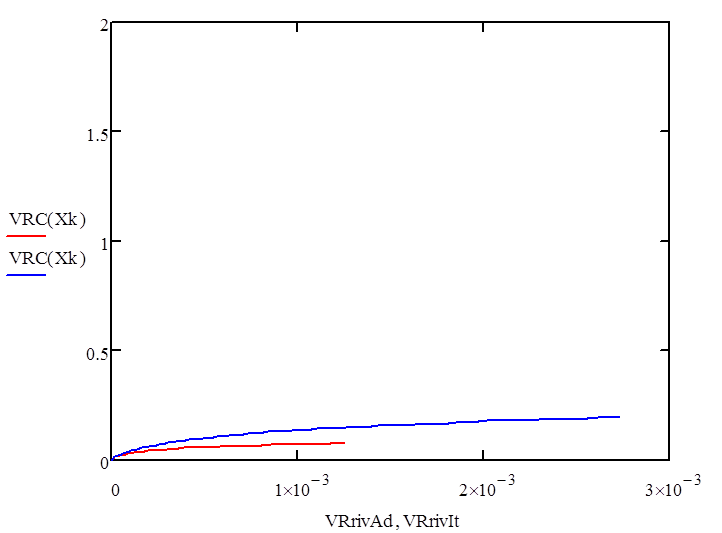 T=1200 K 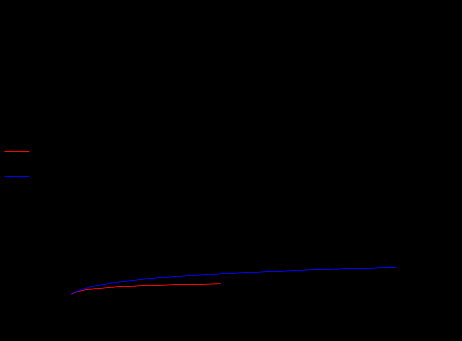 Как мы видим, увеличение исходной температуры приводит к незначительному увеличению производительности, точнее её максимального порога, но на достижение одинаковой производительности требуется гораздо меньший объем реактора. Теперь рассмотрим как влияет на производительность увеличение давления в реакторе. Приведем соответствующие графические зависимости. P = 0,5 атм  Р= 1 атм 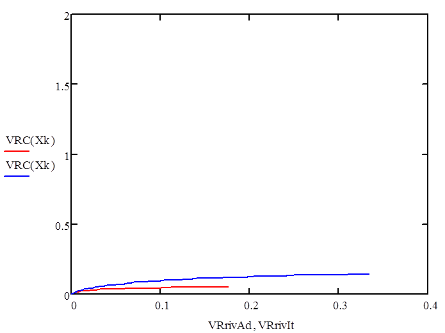 P= 2 атм 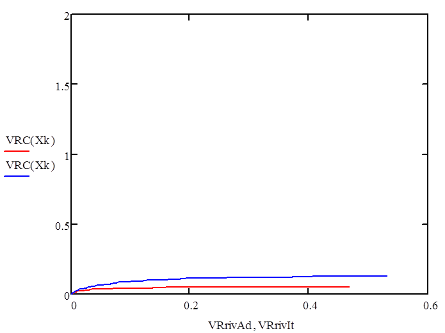 Мы видим что наиболее оптимальные значения давления - ниже атмосферного. Именно при этих давлениях для достижения заданного значения производительности потребуется наименьший по объему реактор. Рассмотри влияние на производительность увеличение объемного расхода реагентов: VNS = 10000  VNS=15000 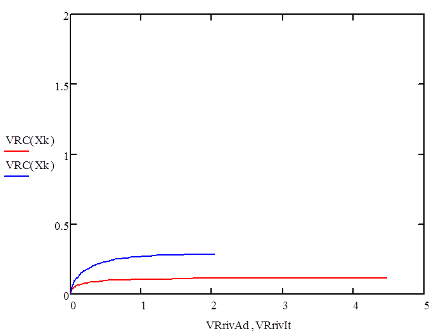 VNS = 20000  Мы видим, что увеличение объемного расхода приводит к увеличению максимального значения производительности, и мы видим что при одном и том же объеме реактора значение производительности с увеличением расхода реагентов увеличивается. Рассмотрим, как будет влиять на производительность изменение начальной концентрации н-бутана. ZNA = 0,1  ZNA = 0,2 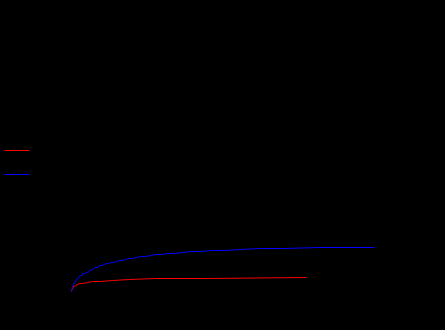 ZNA = 0,3 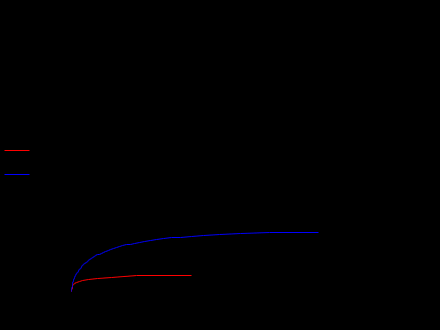 Мы видим что увеличение начальной концентрации н-бутана приведет к увеличению как максимального значения производительности, так и приведет к уменьшению объема реактора необходимого для достижения одинакового значения производительности. Вывод Таким образом, мы рассмотрели и смоделировали процесс дегидрирования н-бутана до н-бутилена. В первой части нашей работы мы описали общие сведения о процессе, способы реализации процесса, реализуемые в промышленности, справочные данные по используемым нами веществам. Во второй части мы создали и описали модель дегидрирования н-бутана, с помощью ЭВМ. На основе результатов моделирования мы смогли делать выводы, что максимальная производительность процесса будет достигаться в изотермическом режиме, при пониженном давлении, кроме производительность процесса увеличивает повышение объемного расхода реагентов, повышение начальной концентрации, и увеличение входной температуры. Литература 1. Технологические схемы процессов переработки нефти в США, Гостоптехиздат, 1956 2. Бушин А.И., Солдатов Б.Я., Тюряев И.А., Троникая Т.М., Турина П.С., Химическая промышленность, № 7, 18, 1958. 3. Основы технологии нефтехимического синтеза под редакцией А.И. Динцеса и Л.А. Потоловского. Гостоптехиздат, 1960. 4.Смирнов Н.И., Синтетические каучуки, ГХИ, 1954. 5.Литвин О.Б., Основы технологии синтеза каучуков, ГХИ, 1959. |