Окислительно- восстановительные_реакции. Реферат_Окислительно-восстановительные_реакции. Окислительновосстановительные реакции
 Скачать 43.04 Kb. Скачать 43.04 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ ФГБОУ ВО «АНГАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ХИМИИ Реферат по дисциплине «Химия» На тему «Окислительно-восстановительные реакции»
СОДЕРЖАНИЕВведение 3 1.Окислительно-восстановительные реакции: понятие и типы 5 1.1.Общие понятия и сведения 5 1.2.Классификация окислительно-восстановительных реакций 7 1.3.Важнейшие окислители и восстановители 8 2.Общие закономерности протекания окислительно-восстановительных реакций 11 Заключение 14 ВведениеОкислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления. Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность. К типичным окислителям относят: простые вещества-неметаллы с наиболее сильными окислительными свойствами; сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления; соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления. Типичные восстановители – это, как правило: простые вещества-металлы; сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной степенью окисления; некоторые соединения, содержащие катионы с минимальной положительной степенью окисления, которые, отдавая электроны, могут повышать свою степень окисления; соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления. Целью данной работы является рассмотрение понятия окислительно-восстановительных реакций. Задачи работы: ознакомиться с понятием окислительно-восстановительных реакций; рассмотреть классификацию окислительно-восстановительных реакций; изучить закономерности протекания окислительно-восстановительных реакций. Окислительно-восстановительные реакции: понятие и типыСтепень окисления – это условный заряд атома в молекуле, вычисленный в предположении, что все связи в молекуле ионные. Степень окисления вычисляется по следующим правилам [3 - 5]: 1. Степень окисления любого элемента в простом веществе равна нулю [3]. 2. Степени окисления некоторых элементов в сложных веществах имеют постоянные значения [3]: степени окисления металлов первой группы главной подгруппы (щелочных металлов) в сложных веществах всегда +1; степени окисления металлов второй группы главной подгруппы (щелочноземельных металлов) в сложных веществах всегда +2; степень окисления алюминия в сложных веществах всегда +3. 3. Кислород почти во всех сложных веществах проявляет степень окисления –2. Исключениями являются фторид кислорода 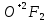 и пероксиды [4]. и пероксиды [4].4. Водород во всех сложных веществах, кроме соединений водорода с металлами (гидридов металлов), проявляет степень окисления +1 [5]. 5. Сумма степеней окисления всех элементов в молекуле равна 0. Общие понятия и сведенияВсе реакции можно разделить на два больших класса: 1. Реакции, протекающие без изменения степеней окисления атомов, входящих в состав реагирующих веществ. Например [2]: 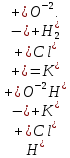 2. Реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Например [2]: 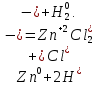 В этой реакции атомы магния и водорода меняют степени окисления. Окислительно-восстановительные реакции - это реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются [1]. Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются. В каждой окислительно-восстановительной реакции происходят два противоположных, но взаимосвязанных процесса [1]: 1. Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Например [1]: 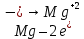 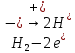 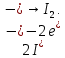 При окислении степень окисления повышается. Атом, молекула или ион, отдающие электроны, называется восстановителем. 2. Восстановление - это процесс присоединения электронов атомом, молекулой или ионом. Например [4]: 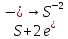 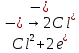 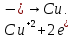 При восстановлении степень окисления понижается. Атом, молекула или ион, присоединяющие электроны, называется окислителем. В любой окислительно-восстановительной реакции процессы окисления и восстановления могут протекать только одновременно. Окислитель при этом восстанавливается, а восстановитель окисляется. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. Классификация окислительно-восстановительных реакций Различают три типа окислительно-восстановительных реакций: 1. Межмолекулярные – это реакции, в которых окислитель и восстановитель находятся в разных веществах. Например [5]: 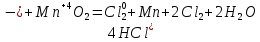 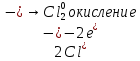 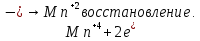 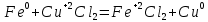 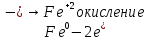 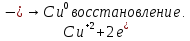 2. Внутримолекулярные – это реакции, в которых окислитель и восстановитель находятся в одном веществе. В этом случае атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Например [2]: 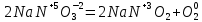 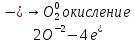 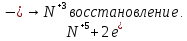 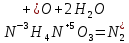 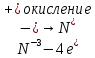 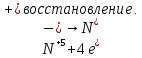 3. Реакции диспропорционирования (самоокисления и самовосстановления) – это реакции, в которых функции окислителя 8 и восстановителя выполняют атомы одного и того же элемента в промежуточной степени окисления. Одновременно увеличивается и уменьшается степень окисления атомов одного и того же элемента. При этом образуются соединения, одно из которых содержит атомы в более высокой, а другое в более низкой степени окисления. Например [3]: 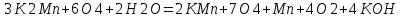 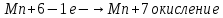 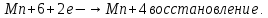 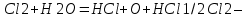 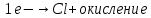 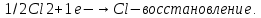 Важнейшие окислители и восстановители Окислители и восстановители могут быть как простыми, так и сложными веществами. Рассмотрим, как меняются окислительно-восстановительные свойства простых веществ в зависимости от их места в Периодической таблице: 1. В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные растут и становятся максимальными у элементов VII группы. Например, в III периоде самый активный восстановитель – натрий, самый активный окислитель – хлор [6]. 2. У элементов главных подгрупп с повышением порядкового номера элемента восстановительные свойства растут, окислительные – снижаются. Так, среди элементов VI группы самым сильным окислителем является кислород, а самым сильным восстановителем – полоний. 3. Металлы обладают только восстановительными свойствами. В химических реакциях они отдают электроны, т.е. окисляются. 4. Неметаллы, кроме фтора, могут как отдавать, так и принимать электроны, и, следовательно, проявлять и восстановительные, и окислительные свойства. Фтор обладает только окислительными свойствами [6]. Окислительно-восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента. Только окислительные свойства проявляют сложные вещества, в состав которых входят элементы в высшей, положительной степени окисления, например, 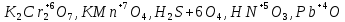 . Только восстановительные свойства проявляют сложные вещества, в состав которых входят элементы в низшей, отрицательной степени окисления, например, . Только восстановительные свойства проявляют сложные вещества, в состав которых входят элементы в низшей, отрицательной степени окисления, например, 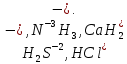 Сложные вещества, в состав которых входят элементы в промежуточных степенях окисления, могут проявлять как окислительные, так и восстановительные свойства. Сложные вещества, в состав которых входят элементы в промежуточных степенях окисления, могут проявлять как окислительные, так и восстановительные свойства.Например, рассмотрим ряд соединений хлора: 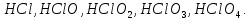 В HCl хлор находится в степени окисления –1. Это максимальная отрицательная степень окисления хлора, в которой он может только отдавать электроны и быть восстановителем. В В HCl хлор находится в степени окисления –1. Это максимальная отрицательная степень окисления хлора, в которой он может только отдавать электроны и быть восстановителем. В 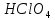 хлор находится в максимальной положительной степени окисления +7. Он может только принимать электроны и быть окислителем. В хлор находится в максимальной положительной степени окисления +7. Он может только принимать электроны и быть окислителем. В 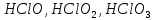 хлор находится в промежуточных степенях окисления +1, +3 и +5, соответственно. Он может и отдавать, и принимать электроны, т.е. быть и восстановителем, и окислителем в зависимости от условий протекания реакции. При этом окислительные свойства хлора растут с ростом его степени окисления, т.е. хлор находится в промежуточных степенях окисления +1, +3 и +5, соответственно. Он может и отдавать, и принимать электроны, т.е. быть и восстановителем, и окислителем в зависимости от условий протекания реакции. При этом окислительные свойства хлора растут с ростом его степени окисления, т.е. 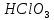 более сильный окислитель и более слабый восстановитель, чем более сильный окислитель и более слабый восстановитель, чем 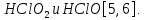 Общие закономерности протекания окислительно-восстановительных реакцийМетод электронного баланса подходит для уравнивания всех видов окислительно-восстановительных реакций Способ основан на двух положениях [7]: 1. Количество атомов в левой и правой части уравнения должны быть равны (закон сохранения массы). 2. Число отдаваемых электронов должно быть равно числу принимаемых электронов (закон сохранения заряда) Электронные уравнения должны быть сбалансированы по атомам (для этого используются коэффициенты) и зарядам (вычитаем или прибавляем необходимое число электронов, помня, что электрон имеет заряд равный -1). Правила составления электронного баланса [7]: 1. Правило: Если степень окисления изменяют два элемента, баланс составляется в той части уравнения, где больше веществ. Исключение: если степень окисления изменяют три элемента, то баланс составляется в левой части уравнения. 2. Правило: Если число веществ в правой и левой частях уравнения одинаково, то баланс составляем в той части, где есть простое вещество. 3. Правило: При одинаковом числе веществ и наличии простых веществ в обеих частях уравнения, баланс составляем в той части, где находится простое вещество молекулярного строения  При равном числе веществ и наличии простых веществ молекулярного строения в обеих частях уравнения, баланс предпочтительно составлять в той части уравнения, где находится более сильный окислитель. Поскольку в подавляющем большинстве таких случаев баланс получается в любой части уравнения, в обычных классах это положение можно в качестве правила не давать, а упоминать его только в специализированных классах. При равном числе веществ и наличии простых веществ молекулярного строения в обеих частях уравнения, баланс предпочтительно составлять в той части уравнения, где находится более сильный окислитель. Поскольку в подавляющем большинстве таких случаев баланс получается в любой части уравнения, в обычных классах это положение можно в качестве правила не давать, а упоминать его только в специализированных классах.4. Правило: Реакции диспропорционирования – ОВР, в которых степень окисления изменяет один элемент. В реакциях диспропорционирования, баланс составляется в той части уравнения, где этот элемент встречается в составе нескольких веществ. 5. Правило. Если степень окисления изменяют три элемента, баланс составляется слева. Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций. Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты [4, 7]: окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6); окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3) [4]; либо окислитель практически не подвержен изменениям среды. Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами. Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок [7]. Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5. При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко. В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило. Заключение В данной работе было рассмотрено понятие окислительно-восстановительных реакций, классификация окислительно-восстановительных реакций, а также изучены закономерности протекания окислительно-восстановительных реакций. В ходе проделанной работы можно сделать следующие выводы: Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования. 2. Окислительно-восстановительные свойства веществ определяются природой веществ, средой, в которой проводится реакция и рядом других факторов. Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. 3. Метод электронного баланса позволяет проводить подбор коэффициентов в уравнениях окислительно-восстановительных реакций. Часто окислительно-восстановительные реакции протекают в растворах. Реакции в растворах отличаются тем, что окислитель, восстановитель и продукты реакции могут быть диссоциированы на ионы. В этом случае для уравнивания реакции удобнее пользоваться методом электронно-ионного баланса. В этом методе окислительно-восстановительную реакция разделяют на две полуреакции, одна из которых соответствует процессу восстановления, а другая – процессу окисления. 4. Окислительно-восстановительные реакции играют огромную роль в природе и технике. С ними связаны дыхание и обмен веществ в живых организмах, фотосинтез в листьях растений, гниение и брожение, круговорот элементов в природе. Их можно наблюдать при сгорании топлива, в процессах коррозии металлов и при электролизе. Благодаря окислительно-восстановительным реакциям происходит превращение химической энергии в электрическую в химических источниках тока. Список использованных источников Ахметов Н.С. Общая и неорганическая химия / Н.С. Ахметов. М.: Высшая школа, 2018. - 446 с. Богданова С.Е Окислительно-восстановительные реакции / СПбГМТУ. – СПб., 2017. – 22 с. Глинка Н.Л. Общая химия: учебное пособие / Н.Л. Глинка. М.: КНОРУС, 2016. - 752 с. Морозов И.В., Болталин А.И., Карпова Е.В. Окислительно-восстановительные процессы. Учебное пособие – М.: Издательство Московского университета, 2016. – 79 с. Наглядное пособие. Окислительно-восстановительные реакции. - М.: Дрофа, 2018. - 515 c. Рябухова Т.О. Окислительно-восстановительные реакции в растворах: учебно-методическое пособие для выполнения лабораторных работ и самостоятельной работы. - Энгельс: Изд-во ЭТИ (филиал) СГТУ имени Гагарина Ю.А., 2016 – 24 с. Степин Б.Д. Неорганическая химия: учебник/ Б.Д. Степин, А.А. Цветков М.: Высш. шк., 2016. – 608 с. Ангарск, 2021 г. |
