окислители. Окислительновосстановительные реакции Окислители и восстановители
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
Окислительно-восстановительные реакции 1. Окислители и восстановители 2. Классификация окислительно–восстановительных реакций 3. Основные правила составления ОВР 4. Общие закономерности протекания ОВР 5. Основные схемы ОВР 5.1. Схема восстановления перманганатов 5.2. Схема восстановления хроматов/бихроматов 5.3. Разложение нитратов 5.4. Окислительные свойства азотной кислоты 5.5. Взаимодействие металлов с серной кислотой 5.6. Пероксид водорода Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают. Окислители и восстановителиОкислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются. Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются. 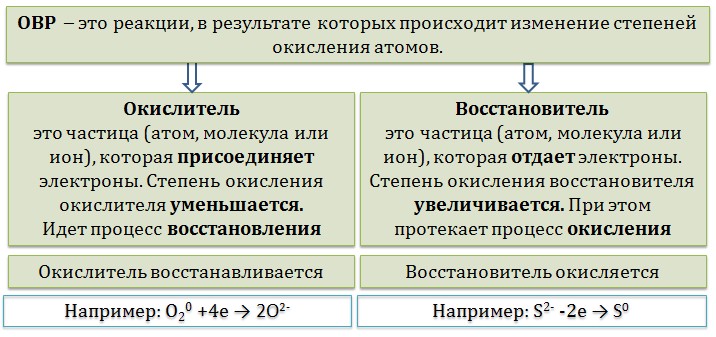 Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность. К типичным окислителям относят: простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2); сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3) соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др. Типичные восстановители – это, как правило: простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности); сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI); некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления; соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления. Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства. 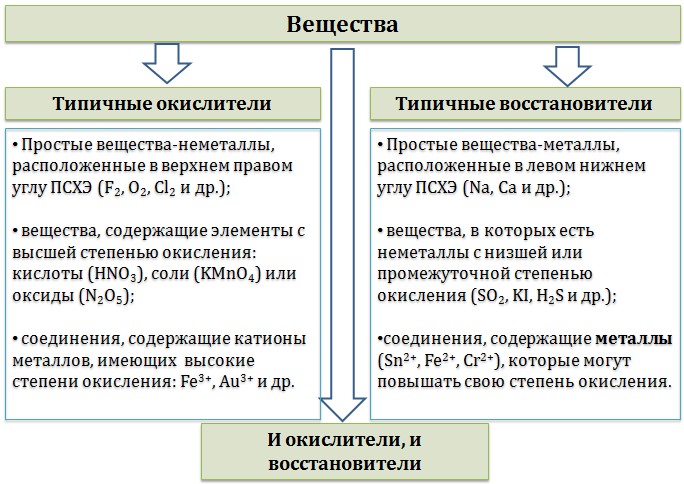 Типичные окислители и восстановители приведены в таблице. 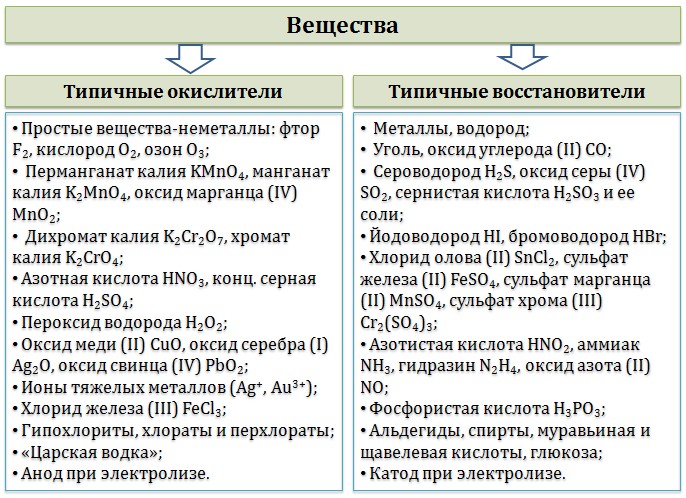 В лабораторной практике наиболее часто используются следующие окислители: перманганат калия (KMnO4); дихромат калия (K2Cr2O7); азотная кислота (HNO3); концентрированная серная кислота (H2SO4); пероксид водорода (H2O2); оксиды марганца (IV) и свинца (IV) (MnO2, PbO2); расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов . К восстановителям, которые применяются в лабораторной практике относятся: магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы; водород (Н2) и углерод (С); иодид калия (KI); сульфид натрия (Na2S) и сероводород (H2S); сульфит натрия (Na2SO3); хлорид олова (SnCl2). |
