окислители. Окислительновосстановительные реакции Окислители и восстановители
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
Основные правила составления окислительно-восстановительных реакцийОкислительно-восстановительные реакции сопровождаются процессами окисления и восстановления: Окисление — это процесс отдачи электронов восстановителем. Восстановление — это процесс присоединения электронов окислителем. Окислитель восстанавливается, а восстановитель окисляется. В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится. Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие. Рассмотрим подробно метод электронного баланса. «Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления: K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0 Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции. Степень окисления меняют атомы марганца и серы: S-2 -2e = S0 Mn+7 + 1e = Mn+6 Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами! Схема составления уравнений ОВР методом электронного баланса: 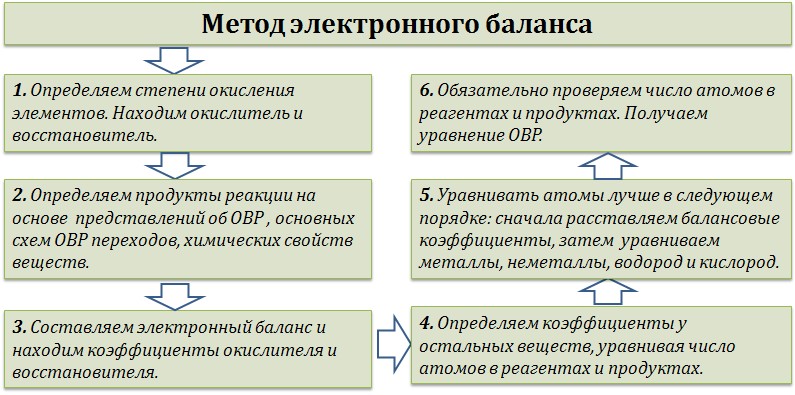 Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым. |
