S-элементы. ХИМИЯ. Реферат по дисциплине Общая и неорганическая химия
 Скачать 0.89 Mb. Скачать 0.89 Mb.
|
|
РЕФЕРАТ по дисциплине: «Общая и неорганическая химия» на тему: S-элементы. Выполнила студентка группы Ф-11/21 Проверил преподаватель: Нальчик 2022 Содержание
ВВЕДЕНИЕS Элементы в периодической таблице элементов — химические элементы, электронная оболочка которых включает в себя первые два s-электрона. Такие элементы объединяются в группу, называемую s-блок. К s-элементам относятся: щелочные металлы, щелочноземельные металлы, водород и гелий. 1.ОБЩАЯ ХАРАКТЕРИСТИКА S-ЭЛЕМЕНТОВ.К 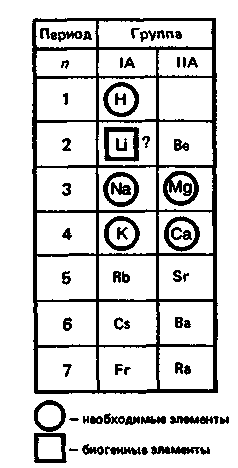 блоку s-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Электронная формула внешней оболочки элементов IА-группы и водорода ns1 блоку s-элементов относятся 13 элементов, общим для которых является застраивание в их атомах s-подуровня внешнего энергетического уровня. Электронная формула внешней оболочки элементов IА-группы и водорода ns1Как следует из электронных формул, элементы IА-группы имеют на внешнем энергетическом уровне по одному s-электрону, а элементы IIА-группы — по два электрона. Химические свойства s-элементов IА- и IIА-групп сходны. s-Элементы легко отдают валентные s-электроны, т. е. они представляют собой сильные восстановители. Элементные вещества — типичные металлы, обладающие блеском, высокой электрической проводимостью и теплопроводностью, химически весьма активны. s-Элементы имеют малые значения энергии ионизации при относительно больших радиусах атомов и ионов. Как правило, они образуют соединения с ионным типом связи, исключение составляет водород, для которого в соединениях даже с самыми электроотрицательными элементами (например, в воде) характерна преимущественно ковалентная связь. Частично ковалентный характер связи в соединениях в известной мере имеет место у лития, бериллия и магния. Большинство природных соединений натрия, калия, кальция, стронция растворимы в воде и слабых кислотах, и поэтому ионы этих металлов могут мигрировать из водных растворов в организм растений, животных и человека. Водород, натрий, калий, магний, кальций — жизненно необходимы для живых и растительных организмов. [1] 2.ЩЕЛОЧНЫЕ МЕТАЛЛЫ.Щелочными называются метаны, расположенные в первой главной (LА) группе периодической системы элементов К ним относятся литий Li, натрий Na, калин К. рубидии Rb, цезии Cs. франций Fr. Гидроксиды этих металлов называются щелочами . именно поэтому сами металлы получили название щелочные . Дэви Хэмфри (1778—1829)  Английский ученый. В 1808 г. путем электролиза солей и щелочей получил калий, натрий, барий, кальций, амальгаму стронция и магния. Имеет множество научных работ. Наиболее важные из них в практическом отношении — натрии и калий. Схема строения их атомов дана в таблице 20. Строение атомов остальных щелочных металлов аналогично. Щелочные металлы в своих соединениях проявляют степень окисления равную +1 их валентность также всегда равна 1. Они пластичны и легко режутся ножом. Щелочные металлы относятся к легким металлам, энергично взаимодействуют с кислородом (цезий со взрывом!), водой, кислотами и большинством неметаллов, поэтому их хранят под слоем керосина. При взаимодействии щелочных металлов с кислородом в зависимости от металла образуются оксиды состава  Знаешь ли ты? В современных сотовых телефонах батарея изготовлена m гндрошш лития, помешенного в алюминиевый каркас. При взаимодействии щелочных металлов, их оксидов и пероксидов с водой образуются гидроксиды общей формулы ROH. которые хорошо растворимы вводе, сильные основания (щелочи). Сила основании ROH возрастает от лития к цезию. Гидриды щелочных металлов соответствуют формуле RH. В этих соединениях степень окисления водорода равна -1. 3.НАХОЖДЕНИЕ В ПРИРОДЕ.Из-за своей активности металлы этой группы в свободном состоянии в природе не встречаются. Из соединении щелочных металлов широко распространены соединения калия и натрия, поэтому натрий и калин относятся к числу восьми наиболее распространенных элементов земной коры (2.64 и 2.41% по массе соответственно). Соединения других щелочных металлов встречаются редко. Франипи получен искусственно, радиоактивным металл мало исследован и не имеет практического применения. Соли калия имеют очень большое значение в жизни растений. 4.ИНТЕРЕСНЫЕ ФАКТЫ.Название щелочные произошло от латинского слова, означающего "растворимое, едкое вещество” Рубидий и цент — редкие элементы. Их соединения используются для изготовления фотоэлементов, в медицине и органической химии. Щелочными называют металлы, расположенные в первой главной (IA) группе периодической системы элементов. Гидроксиды этих металлов называются щелочами щ именно поэтому' сами металлы получили название щелочные . Все они имеют один s-электрон на наружном электронном слое, и электронная конфигурация может быть представлена как 5. 10 РЕКОРДСМЕНОВ СРЕДИ МЕТАЛЛОВ.Алюминий — самый распространенный Франций — самый редкий на Земле Осмий — самый плотный Литий — самый легкий Серебро — самый электропроводный Калифорний — самый дорогой Вольфрам — самый тугоплавкий Ртуть — самый легкоплавкий Иридий — самый стойкий к кислотам Хром — самый твердый НатрийНазвание элемента натрий Строение. Химическим элемент с порядковым номером 11. Атомная масса 22.98. Находится в 3-м периоде в главной подгруппе 1 группы Периодической системы Д. И. Менделеева. электронная формула Нахождение в природе . По распространенности в земной коре натрий занимает шестое место. Огромное количество солей натрия содержится в морской воде. Минералы натрия разнообразны. Наиболее важные из них— галит NaCI (поваренная, пли каменная, соль), мирабилит, или глауберова соль. Физические свойства. Натрий представляет собой серебристо-белый металл. Он мягок: легко режется ножом. Натрий относится к легким  металлам Натрий получают электролизом расплавленного хлорида натрия, реже гидроксида натрия: Химические свойства.По химическим свойствам натрии —активный металл. Его хранят под слоем керосина или машинного масла. 1. Взаимодействие с кислородом . При окислении натрия недостатке кислорода при умеренном нагревании образуется оксид натрия (рис. 43): 2. Натрий энергично взаимодействует со многими нем станами, причем взаимодействие со фтором и хлором сопровождается воспламинением , 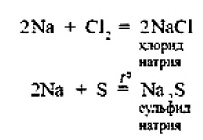  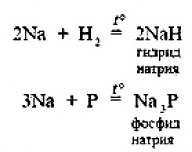 3. Натрии бурно взаимодействует с водой с образованием гидроксида натрия и выделением водорода 4. Активно происходит взаимодействие натрия с различными кислотами, например : Применение. Металлический натрий широко используется в препаративной химии н промышленности как сильный восстановитель, в т. ч. в металлургии. Натрий используется в производстве весьма энергоемких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрии применяется в качестве материала для электрических проводов, предназначенных для очень больших токов. Натрии также относится к жизненно важным элементам, ноны натрия участвуют в регуляции водного обмена и влияют на работу ферментов. Знаешь ли ты? Натрии является типичным представлением щелочных металлов. По химическим свойствам натрии — активный металл. Он энергично взаимодействует со многими неметаллами, с водой и кислотами. Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель. в т. ч. в металлургии. Натрий также относятся к жизненно важным элементам, ноны натрия участвуют в регуляции водного обмена и влияют на работу ферментов. Обнаружение ионов натрия Соли натрия окрашивают пламя в желтый цвет. Проверьте это взяв немного поваренной соли и поместив ее на пламя огня (будьте осторожны). Важнейшие соединения натрия В своих соединениях натрии проявляет степень окисления +1. Наиболее важными из этих соединений являются оксид натрия Оксид натрияявляется типичным основным оксидом. Он взаимодействует с водой с образованием гидроксида натрия, кислотами и кислотными оксидами, например: 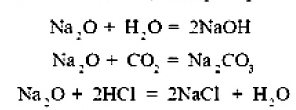 Гидроксид натрия (едкий натр. каустшеская сода) представляет собой белое гигроскотгчное твердое вещество (рис. 44). Если оставить кусочек едкого натра на воздухе, то он вскоре расплывается, так как притягивает влагу из воздуха. Едкий натр хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь  Батырбек Ахметович Беремжанов (1911—1985)  Доктор химических наук, профессор, член-корреспондент АН КазССР, заслуженный деятель науки КаэССР. Основное направление научной деятельности — исследование химии природных солей и путей их использования. Дал физико-химическую характеристику крупнейших водных бассейнов Казахстана. На основании исследований закономерностей солеобразования и соленакопления предложил теорию континентального солеобразования. Провел работу по изысканию рациональных способов термического, кислотного методов переработки каратауских и актюбинских фосфоритов. Гидроксид натрия — щелочь. Водный раствор гидроксида натрия окрашивает лакмус в синий а фенолфталеин — в малиновый цвет. Едкий натр сильно разъедает кожу и ткань: на коже могут появиться язвы а на ткани — дырки, поэтому при работе с ним или с его растворами нужно остерегаться чтобы они не попали на руки лицо или одежду. В 50-х голах XX в. профессор Б. А. Беремжанов руководи рядом экспедиций и провали фипико-химические исследования соленых озер Прибалхашья. Эти исследования имели прямой практический результат: для комбината "Аралсупьфат" разработан способ обогащения некондиционного мирабилита,на Кдошачансьтм сульфатном руднике внедрена переработка мирабилита по схеме: 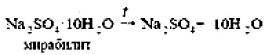 В 1952 г. на Балхашском металлургическом комбинате внедрен способ производства сульфида натрия восстановлением упем: Химические свойства. 1. Гидроксид натрия вступает в реакцию нейтрализации со всеми кислотами с образованием соответствующей соли и воды, например: 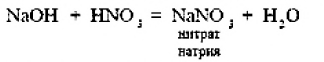 2, Он реагируем также со еселш кислотными оксидами, образуя соль и воду: 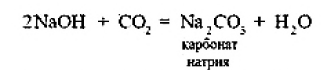 3. Едкий натр вступает в реакцию со многими салями, образуя новое основание и новую соль, например: 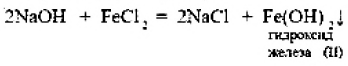 4. Гидроксид натрия также взаимодействует с амфотерным оксидам и амфотерным гидроксидам, например: 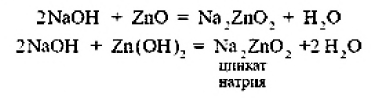 Пероксид натрия Применение соединений натрия.Гидроксид натрия применяется в качестве реагента в химической промышленности, в производстве бумаги. искусственных волокон, для очистки нефти, масел и т. д. Знаешь ли ты? Аппетитный розовый цвет колбасным изделиям придает нитрит натрия Карбонат Нитрат натрия Хюрид натрия NaCl (поваренная соль) применяется с древних времен как добавка к ганце к консервирующее средство. В наше время используется в технике; в медицине применяют растворы хлорида натрия различной концентрации для инъекций, промывания ран, компрессов н т. д. Цианид натрия NaCN применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при стали и в гальванотехнике (серебрение, золочение). Хюрат натрия Оксид натрия является типичным основным оксидом. Он взаимодействует с водой, кислотами и кислотными оксидами. Гидроксид натрия — щелочь. Водный раствор гидроксида натрия окрашивает лакмус в синий, а фенолфталеин — в малиновый цвет. Гидроксид натрия вступает в реакцию нейтрализации со всеми кислотами, кислотными оксидами, солями, а также амфотерными оксидами и амфотерными гидроксидами. Все соли натрия При работе с едким натром или с его растворами нужно остерегаться, чтобы они не попали на руки, лицо или одежду. Выводы Изучив подробно тему реферата, выделим основные моменты: В США, Великобритании, Нидерландах используется «англо-саксонская» модель учета, которая ориентирована на нужды инвесторов и кредиторов фирмы. С технической точки зрения она наиболее либеральна — каждая фирма формирует план счетов самостоятельно, отсутствует единая утвержденная нумерация счетов. Вместе с тем, существуют общие требования к организации бухгалтерского учета, описываемые системой «общепринятых принципов бухгалтерского учета» (generally accepted accounting principles — GAAP). Такие требования вырабатываются профессиональными ассоциациями бухгалтеров. Во Франции, Германии, Японии и некоторых др. странах применяется «континентальная модель», ориентированная на нужды налоговых органов. Она более формализована, поскольку опирается на единый утвержденный государством план счетов. В странах с высокими темпами инфляции используется «латиноамериканская модель», для которой характерна постоянная корректировка показателей на темпы инфляции. «Исламская модель» адаптирована к требованиям шариата. Например, в исламской модели бухгалтерского учета не существует термина дивиденды, поскольку ислам запрещает такого рода доходы (равно как и выплату процентов за кредит). Российская модель ведения бухгалтерского учета по своим принципам ближе всего к континентальной, однако российская практика учета существенно отличается от любой из используемых в мире. Это обусловлено тем, что изначально она формировалась для функционирования в условиях плановой экономики. Российская система бухгалтерского учета подвергается реформированию с целью ее приближения к принципам GAAP. В связи с глобализацией мировой экономики и выходом многих российских фирм на мировой рынок назрело время реформирования бухгалтерского учета и отчетности в России. Все больше организаций экспортирует товары, продукцию и услуги на мировой рынок, в условиях которого финансовая отчетность должна удовлетворять международным стандартам. В конце 1990-х - начале 2000-х гг. в области бухгалтерского учета и отчетности в Российской Федерации произошли значительные изменения. Эти изменения в системе бухгалтерского учета и отчетности были направлены на обеспечение формирования информации о финансовом положении и финансовых результатах деятельности хозяйствующих субъектов, полезной заинтересованным пользователям. В качестве основного инструмента реформирования бухгалтерского учета и отчетности были приняты Международные стандарты финансовой отчетности (МСФО). Заключение Как показывает отечественный и мировой опыт, развитие бухгалтерского учета и отчетности должно происходить в тесной связи с изменениями экономической ситуации в стране и отвечать характеру и уровню развития хозяйственного механизма. Недопустимо неоправданное затягивание процессов преобразования бухгалтерского учета и отчетности. В то же время форсирование изменений в бухгалтерском учете и отчетности вне связи с изменениями в хозяйственном механизме и реальным функционированием рыночных институтов может привести к снижению качества финансовой информации в экономике, дискредитации МСФО, а также ослаблению финансовой дисциплины. Суть дальнейшего развития модели бухгалтерского учета в России состоит в активизации использования МСФО для реализации этой функции путем создания необходимой инфраструктуры и построения эффективного учетного процесса. Дальнейшее развитие бухгалтерского учета и отчетности необходимо осуществлять по следующим основным направлениям: 1) повышение качества информации, формируемой в бухгалтерском учете и отчетности; 2) создание инфраструктуры применения МСФО; 3) изменение системы регулирования бухгалтерского учета и отчетности; 4) усиление контроля качества бухгалтерской отчетности; 5) существенное повышение квалификации специалистов, занятых организацией и ведением бухгалтерского учета и отчетности, аудитом бухгалтерской отчетности, а также пользователей бухгалтерской отчетности. Библиографический список 1. https://studfile.net/preview/2358899/ 2.Бухгалтерский учет / Безруких П.С.: учебник. -М.: Ред. журн. Бух. Учет, 2003. -527 с. 3.Библиотечка журналов // Бухучет по международным стандартам, часть 1, Социальная защита, 1998, № 9. 4.Библиотечка журналов // Бухучет по международным стандартам, часть 2, Социальная защита, 1998, № 10. 5.Курс экономической теории / Под ред. Чепурина. Киров 1999. 6.Маренков, Н. Л. Международные стандарты бухгалтерского учета, финансовой отчетности и аудита в российских фирмах / Н. Л. Маренков, Т. Н. Веселова. – М. : Едиториал УРСС, 2004. – 200 с. 7.Рыночная экономика. т.1. ч.2. /Под ред. Максимовой. М. 1992. 8.Соколов, Я. В. Бухгалтерский учет в зарубежных странах / Я. В. Соколов, Ф. Ф. Бутынец, Л. Л. Горецкая, Д. А. Панков. – М. : ТК Велби. Издательство Проспект, 2005. – 664 с. 9. Развитие бухгалтерского учета в условиях глобализации. Электронный источник- режим доступа :/work/work_47601.html |
