|
|
микробиология. Окраска мазков по ЦильНильсену
Государственное бюджетное профессиональное образовательное учреждение
«Дубовский зооветеринарный колледж
имени Героя Советского Союза А. А. Шарова»
КОНТРОЛЬНАЯ РАБОТА
По дисциплине «Основы микробиологии»
На тему: « Окраска мазков по Циль-Нильсену»
Выполнила студентка
1В УCО группы
ускоренному обучению по
индивидуальному плану
Севергина Тамара Владимировна
Проверила преподаватель
Самарский А.Н.
Оценка______________________
2021 г
Содержание:
Введение.
Определение метода окраски.
Этапы окраски и порядок проведения исследования.
Морфологические характеристики кислотоустойчивых микобактерий после окраски
Заключение.
Определение метода окраски.
Метод окраски по Цилю — Нильсену (по Цилю — Нельсену) — метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий (возбудителей туберкулёза, микобактериозов, лепры), актиномицетов и других кислотоустойчивых микроорганизмов. Кислотоустойчивость микроорганизмов обусловлена наличием в их клетках липидов, воска и оксикислот. Такие микроорганизмы плохо окрашиваются разведёнными растворами красителей. Для облегчения проникновения красителя в клетки микроорганизмов нанесённый на препарат карболовый фуксин Циля подогревают над пламенем горелки. Окрашенные микроорганизмы не обесцвечиваются слабыми растворами минеральных кислот и спирта.
Метод назван именами немецких медиков — микробиолога Франца Циля и патологоанатома Фридриха Нельсена (Нильсена), которые разработали его в 1882—1883 гг.
Этапы окраски и порядок проведения исследования.
Для начала фиксированный мазок, депарафинизированный срез, покрывают плоской фильтровальной бумагой и наливают на неё карболовый фуксин Циля. Мазок подогревают над пламенем горелки до появления паров, затем отводят для охлаждения и добавляют новую порцию красителя. Подогревание повторяют 2—3 раза. После охлаждения снимают фильтровальную бумагу и промывают препарат водой.
Препарат обесцвечивают путём погружения или нанесения на него 25%-го раствора серной кислоты или 3 % солянокислого спирта в течение 30 секунд, и промывают несколько раз водой.
Окрашивают препараты водно-спиртовым раствором метиленового синего 1 минуту, промывают водой и высушивают.
При окраске по этому методу кислотоустойчивые бактерии приобретают интенсивно красный цвет, остальная микрофлора окрашивается в светло-синий цвет.
При микроскопическом исследовании мазка следует просматривать не менее 100 полей зрения, чтобы дать количественную оценку препарату и обнаружить единичные микобактерии. В том случае, если результат такого исследования оказывается отрицательным, для подтверждения просматривают дополнительно 200 полей зрения. При значительном количестве кислотоустойчивых микобактерий достаточно исследовать 20 — 50 полей зрения как при окраске по Циль-Нильсену, так и при люминесцентной микроскопии. При микроскопическом исследовании препарата необходимо быть уверенным, что ни одно поле зрения препарата не просматривается повторно, поэтому рекомендуется просматривать препарат всегда по одной и той же схеме:
либо 3 параллельных прохода по длине препарата;
либо 9 параллельных проходов по ширине.
Просматривать препарат начинают с левого верхнего выбранного в мазке поля зрения, постепенно передвигаясь либо вдоль продольной оси препарата до конца мазка, либо смещаясь вниз и затем вновь поднимаясь вверх и т. д., проходя все поля зрения до границы мазка. При увеличении микроскопа 1000x, то есть 100x для масляно-иммерсионного объектива и 10x для окуляра, при исследовании одной длины мазка ( 20 мм) за один продольный проход просматривается около 100—120 полей зрения (диаметр поля зрения — 0,16 — 0,2 мм).
-Реактивы
спирт этиловый 96- марки ОП-2, ТУ 6-09-4512-77;
кислота соляная концентрированная, ГОСТ 3118-77;
кислота серная концентрированная, ГОСТ 4204-77;
фенол кристаллический (карболовая кислота), ГОСТ 6417-72;
фуксин основной, ТУ 6-09-3804-82;
метиленовый синий хлорид, ТУ 6-09-945-75;
глицерин, ЧДА, ГОСТ 6259-75;
вода дистиллированная, ГОСТ 6709-72.
-Приготовление растворов
Раствор 1. Насыщенный спиртовой раствор фуксина: растереть в ступке 0,3 г основного фуксина с 2 — 3 каплями глицерина, добавить по каплям 10 мл 96- этилового спирта.
Раствор 2. Рабочий раствор фенола (5 % водный раствор): расплавить 5 г кристаллического фенола путём лёгкого подогревания на водяной бане (температура плавления фенола 41 °C). Добавить слегка подогретую дистиллированную воду до объёма 100 мл.
Раствор 3. Рабочий раствор карболового фуксина: в 90 мл полученного раствора фенола (2) добавить 10 мл насыщенного раствора фуксина (1).
Раствор 4. Обесцвечивающие растворы:
Раствор серной кислоты. К 75 мл дистиллированной воды осторожно долить 25 мл концентрированной серной кислоты, постепенно наслаивая её по стенкам сосуда. Смешать. Содержимое нагреется. Никогда не добавляйте воду в кислоту!
Раствор солянокислого спирта. Вместо раствора серной кислоты для обесцвечивания можно использовать 3 % солянокислый спирт: Этиловый спирт 96 % — 97 мл, Концентрированная соляная кислота — 3 мл. К 97 мл спирта осторожно добавляют 3 мл концентрированной соляной кислоты. Всегда осторожно вливайте кислоту в спирт, но не наоборот.
Раствор 5. Рабочий раствор метиленового синего:
растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
Морфологические характеристики кислотоустойчивых микобактерий после окраски
Кислотоустойчивые микобактерии туберкулёза имеют в длину примерно 1 — 10 мкм, в ширину — 0,2 — 0,6 мкм. Обычно они видны в виде тонких изящных палочек, но иногда можно обнаружить изогнутые или извитые варианты. При окраске карболовым фуксином микобактерии туберкулёза выявляются в виде тонких, слегка изогнутых палочек малиново-красного цвета, содержащих различное количество гранул. Микроорганизмы, располагающиеся поодиночке, парами или в виде групп, хорошо выделяются на голубом фоне других компонентов препарата. Нередко бактериальные клетки могут располагаться в виде римской цифры «V».
Внутри отдельных микробных клеток могут обнаруживаться участки более интенсивного окрашивания, в результате чего они похожи на «бусы», а более слабо окрашенные участки могут быть видны в виде «полос». В препарате могут выявляться также изменённые коккоподобные кислотоустойчивые формы возбудителя, округлые сферические или мицелиеподобные структуры. Однако в случае обнаружения изменённых форм кислотоустойчивых микроорганизмов положительный ответ должен быть подтверждён дополнительными методами исследования.
Некоторые другие микроорганизмы, не относящиеся к М.tuberculosis, могут иметь различные формы — от длинных палочек до кокковидных форм с различной интенсивностью окрашивания. Различную степень кислотоустойчивой окраски можно наблюдать не только у микобактерий, но и у других микроорганизмов. Это могут быть Rhodococcus, Nocardia, Legionella, а также цисты Cryptosporidium и Isospora. Быстрорастущие микобактерии могут отличаться по степени кислотоустойчивой окраски — при частичной потере кислотоустойчивой окраски они приобретают фиолетово-малиновый цвет.
При культуральном исследовании ответ о выделении кислотоустойчивых микобактерий даётся только после микроскопии окрашенного по Ziehl-Neelsen мазка из выросших колоний. При приготовлении мазков для микроскопического исследования колонии микобактерий туберкулёза проявляют свои физико-химические особенности: они не эмульгируются в изотоническом растворе, а образуют зернистую крошковидную суспензию. Это обусловлено наличием в составе их клеточной стенки большого количества гидрофобных жировосковых субстанций. При микроскопическом исследовании мазков из выросших колоний, окрашенных по Циль-Нельсену, обнаруживаются яркие малиново-красные палочковидные бактерии, лежащие одиночно или группами, образующие скопления или переплетения в виде «войлока» или «кос». Микобактерии туберкулёза выглядят как тонкие, прямые или слегка изогнутые палочки длиной 1 — 10 (чаще 1 — 4) мкм, шириной 0,2 — 0,6 мкм, гомогенные или зернистые с незначительно закруглёнными концами. Чаще в препарате, особенно в длительно растущих культурах, видны скопления темно окрашенных зёрен. В молодых культурах, особенно выделенных от больных, длительно леченных противотуберкулёзными препаратами, микобактерии отличаются большим полиморфизмом, вплоть до появления коротких, почти кокковидных форм.
По Цилю-Нильсену
1. Фиксированный мазок окрашивают карболовым фуксином через
полоску фильтровальной бумаги с подогреванием над пламенем спиртовки
/до появления паров/ 2-5 мин.(см.рис 1)
2. Снимают бумагу, и после охлаждения стекла промывают мазок водой.
3. Обесцвечивают препарат 5% серной кислотой.
4. Промывают мазок водой.
5. Окрашивают метиленовым синим 3-5 мин.
6. Промывают водой, высушивают и микроскопируют.
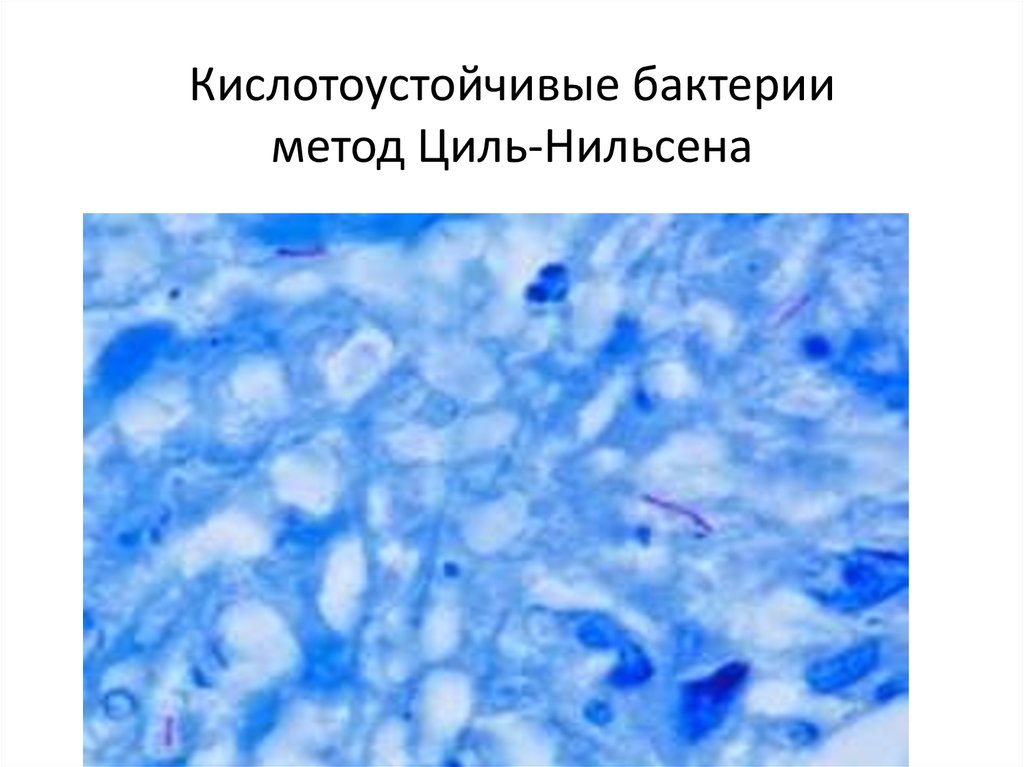
Рис1.
Заключение.
Анализ мокротыявляется жизненно необходимым для своевременного выявления заболеваний, затрагивающих дыхательные пути, в том числе и туберкулеза. Окрашивание по методу Циля-Нильсена помогает выявить микроорганизмы и возбудители подобных болезней. В том числе и в случаях, когда речь идет об атипичных бактериях. Тем самым позволяет производить более точную и качественную диагностику подобных болезней.
Список литературы:
Карышева В.И. - Инфекционные болезни животных 1989 г.
Колычев, Н.М., Госманов, Р.Г. — Ветеринарная микробиология и иммунология 2006г.
Мейер, Денни Ветеринарная лабораторная медицина. Интерпретация и диагностика / Денни Мейер , Джон Харви. - М.: Софион, 2007. |
|
|
 Скачать 100.82 Kb.
Скачать 100.82 Kb.