химиядан олимпиада есептері. Олимпиада есептері химия. Олимпиада есептері 10 сынып1 Кмірсутек. 5 балл
 Скачать 195.5 Kb. Скачать 195.5 Kb.
|
|
Олимпиада есептері 10 сынып-1 Көмірсутек. 5 балл. Өнеркәсіптік органикалық синтезде кеңінен қолданылатын газ тәрізді көмірсутектің үлгісі толық жанғанда түзілшен судың массасы бастапқы үлгінің массасына тең болады. Көмірсутектің құрылысын анықтаңыздар. Шешуі: газ тәтізді көмірсутектің жану теңдеуі: Cn Hm + Көмірсутектің үлгісінің массасы 12n + m, түзілген судың массасы Демек, көмірсутектің қарапайым формуласы: C2H3. Мұнда нақты қосылыс жоқ. Демек, көмірсутектің формуласы -C4 H6. Алкиндер мен алка- диендердің қатарынан есептің шартына ең сәйкес келетіні өнеркәсіпте каучук алу үшін кең қолданатын бутадиен - 1,3 (CH2 = CH - CH = CH2). 10 сынып-2 Қоспалар. 6 балл Массасы 50 г CaCO3, Ca3 (PO 4)2 және (NH4)2 CO3 қоспасын қақтағанда түзілген 25,2 г қалдыққа алдымен судың артық мөлшерін жіберген. Сонда ерімей қалған қалдықтың массасы 14,0 болған. Қоспадағы аммоний карбонатының массасын анықтаңыздар. Шешуі: қақтағанда кальций мен аммоний карбонаттары ғана ыдырайды: t0 CaCO3 100г/моль 56 г/моль t0 (NH4)2 CO3 Демек, 25,2 г қалдық CaO немесе Ca3 (PO4)2 қоспасы болғаны. m(CaO) + m(Ca3(PO4)2) = 25,2 г Кальций окциді мен фосфатының қалдығын сумен өңдегенде тек кальций оксиді ғана суда ериді: CaO + H2O = Ca (OH)2 Оған CO2 газының артық мөлшерін жібергенде: Ca (OH)2 + CO2 CaCO3 + CO2 + H2O Демек, кальций фосфатының массасы 14 г (2) теңдеу бойынша CaO массасын табамыз m(CaO) = 25,2 г - 14 = 11,2 г (1) теңдеуге сүйеніп, CaCO3 массасын табыңыз: n(CaCO3) = n (CaO) = m (CaCO3) = 0,2 моль * 100г/ моль = 20г Демек, m ((NH4)2 CO3) = 50г - (14г + 20г) = 16г 10 сынып - 3 Көмірсутек. 5 балл. Этан, пропилен және ацетиленнің 448 мл (қ.ж.) көлем алады және бромның тетрахлорметандағы 40 мл 5% - (тығыздығы 1,6 г/мл) түссіздендіре алады.Қоспа толық жанғанда түзілген көміртек (IV) толық жұту үшін қажетті калий гидроксидінің 40% - дық ерітінгдісінің (тығыздығы 1,4 г/ мл) минималь мөлшері - 5 мл . Қоспадағы газдардың көлемдік үлестерін анықтаңыздар (%, көлемдері бойынша). Шешуі: көмірсутектер қоспасының жалпы зат мөлшері: v (қоспа)= v (этан) =х,v (пропилен) = y,v (ацетилен) = z болсын делік. Онда: х+у+z= 0,02 Ерітіндідегі бромның массасы мен зат мөлшері: m(Br2)=Vp v(Br2) = Бром тек пропилен мен ацетиленмен әрекеттеседі: C3 H6 + Br2 = C3 H6 Br2 C2 H2 + 2Br2 = C1 H2 Br4 Демек : у +2z = 0,02моль Қоспа толық түзілген CO2 сіңіруге кеткен сілті мөлшері: v(KOH)= Титреуге кеткен КОН мөлшері минимал, демек ракция теңдеуі: KOH + CO2 = KHCO3 демек, v(CO2) = 0,05моль Көмірсутектің жану ракциялары: C2 H6 + 3,5O2 = 2CO2 + 3H2O C3 H6 + 4,5O2 = 3CO2 + 3H2O C2 H2 + 2,5O2 = 2CO2 + H2O Бұдан (коэффиценттерін ескере отырып): 2x + 2y + 2z = 0.05 моль (1), (2) және (3) теңдеулер жүйесін шешсек: x= 0.005 моль; у= 0,01 моль; z = 0,005 моль Онда: х:у:z = 1:2:1 (немесе 25% этан: 50% пропилен: 25% ацетилен). Екі тұз берілген – А және В. Оның бірі, А, оранж түсті, суда жақсы ериді, оның ерітіндісі жалынды жасыл түске бояйды. А тұзы тотықтырғыш, ол қышқыл ортада тотықсыздандырғышпен әрекеттескенде оның түсі жасылдау- күлгінге айналады. Екінші тұз, В – ақ түсті, қыздырғанда газ тәрізді өнімдерге ыдырайды. Тұздың ерітіндісі күміс нитратының ерітіндісімен ірімшік тәрізді ақ тұнба береді. А және В тұдары қыздырғанда бір – бірімен әрекеттеседі. Тұздардың құрамын анықтаңыздар. Егер А және В тұздары қоспасын қыздырғанда 2,24 л (қ.ж) газ бөлінсе, ал реакция өнімін сумен өңдегенде 15,2 г суда ерімейтін металл (ІІІ) оксиді алынған болса, онда қоспаның молярлық құрамы қандай болған? Шешуі: A – K2 Cr2O7 (0,1 моль – 29,4г); B – NH4 Cl (0,2 моль – 10,7). К2 Cr2 O7 + 4H2 SO4 +3H2S = Cr2 (SO4)3 + 3S К2 Cr2 O7 + 7H2 SO4 + 6 KI = Cr2(SO4)3 + 3I2 + K2 SO4 + 7H2O Әдетте үш валентті хромның тұздарының ерітінділері жасыл болады. NH4 Cl v (газ) = NH4Cl + AgNO3 = AgCl 2Cl(OH)3 = Cr2O3 + 3H2O 152моль v (Cr3 O3) = 10 сынып - 5 изотоптар. 9 балл. 12 CH4 пен 14CH қоспасындағы сутектің массалық үлесі 23%. Қоспадағы 12С изотобының массалық үлесін анықтаңыздар. Шешуі: қоспаның 100г үлгісін қарастырамыз: Үлгінің құрамындағы сутектің массасы: m(C) = m(үлгі) * Үлгінің құрамындағы көміртегінің массасы: m(C)=100-23 =77 г Қоспадағы сутек атомдарының мөлшері: n(H)= Үлгідегі көміртек атомдарының мөлшерін анықтаймыз. CH4 молекуласының формуласын көміртек атомдарының мөлшері сутек атомдарының мөлшерінен 4 есе аз екендігі көрініп тұр. n(C) = 0,25n(H) = 0,25 * 23 моль = 5,75 моль Егер үлгідегі 12 С изотопының массасын у г деп белгілесек, онда үлгідегі 14С изотобының массасы (77- у) г болады. Үлгідегі әр изотоптың мөлшерін табамыз: n(12C)= n(14C)= Көміртек атомдарының жалпы мөлшері көміртек изотоптарының мөлшерінің қосындысына те: n(C) = n(12C) + n(14C) = 5,75 моль немесе Теңдеуді шешсек: у= 21г, т.е m(12C ) =21г Қоспадағы 12C изотобының массалық үлесі: 11- сынып -1 Химиялық өзгерістер. 5 балл. Келесі сызбанұсқаға сәйкес химиялық реакцияларды жүзеге асырытын реакция теңдеулерін жазыңдар: ацетелин 11- сынып -2 Иондық тепе - теңдіктер. 6 балл. Сутектің көрсеткіші 4,18 болатын көмір қышқылының 0,01М ерітіндісіндегі H2 CO3, HCO3- немесе CO32- бөлшектерінің концентрацияларынан анықтаңыздар. Көмір қышқылы үшін K1= 4,45 * 10-7; K2 =4,69 * 10-11 Шешуі: ерітіндідегі сутек иондарының концентрациясы: -lg Көмір қышқылының бірінші сатыс бойынша диссоциялану константасы: K1= 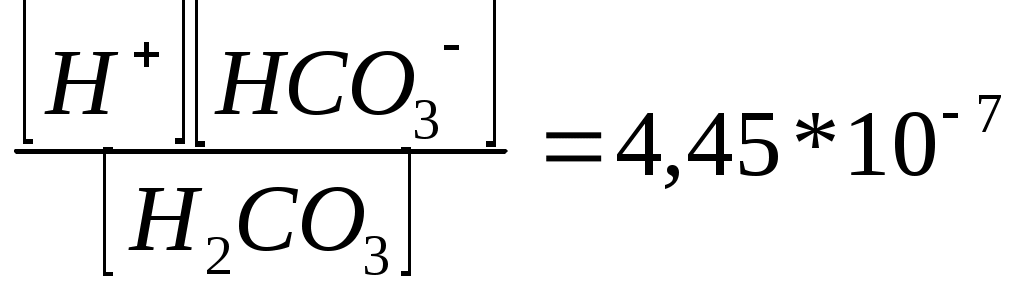 Сол сияқты, көмір қышқылының екінші саты бойынша диссоциациялану константасы: K2 = 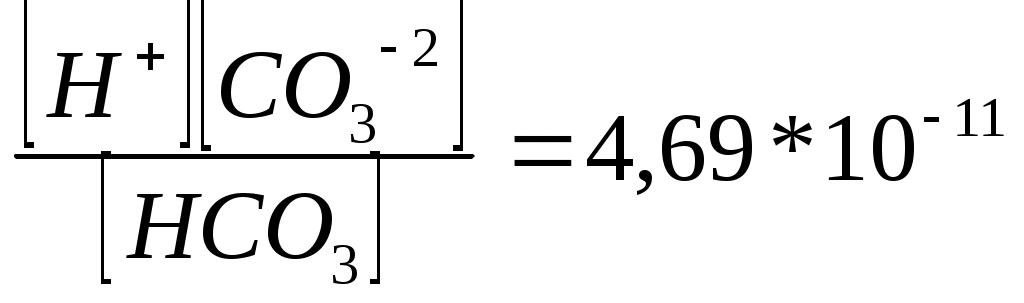 11- сынып – 3. Қоспалар. 7 балл А затын күкірт қышқылымен әсер еткенде түзілген өткір иісті Б газын жай сұйық В затының судағы түсті ерітіндісі арқылы өткізгенде ерітінді түссізденген. Алынған ерітіндідегі барий тұзын қосқанда қышқылдарда ерімейтін ақ тұнба түзіледі. Алынған ерітінді арқылы сары-жасыл түсті газды өткізгенде В заты түзіледі және бұрыңғы түсі қалпына келеді. А,Б,В және Г заттарын анықтаңыздар және тиісті реакция теңдеулерін жазыңыздар. Шешуі: өткір иісті түссіз газ күкірт (IV)оксиді болуы мүмкін. Сұйық күйде болатын жай заттар – бром мен сынап. Сынап күкіртті газбен Реакция теңдеулері: Na2SO3 + H2SO4 = Na2SO4 + SO2 SO2 +2H2O +Br2 = Na2SO4+ 2HBr BaCl2 + Na2SO4 = BaSO4 Cl2 + 2HBr = 2HCl +Br2 Демек, А- сульфит, Б- SO2, В- BaSO4, Г- Cl2. 11- сынып -4. белгісіз заттың формуласын анықтау. 8- балл 75 мл газ тәрізді органикалық затты 150 мл оттекпен араластырып, алынған қоспаны қопараған. Түзілген су буынан арылғаннан кейін көлем 150 мл дейін кеміген, ал қалған газды сілті ерітіндісінің артық мөлшері арқылы өткізгеннен кейін оның көлемі 75 мл болған. Осы қалған газды өте жоеғары температураға дейін қыздырылған металл күйіндегі мыс арқылы өткізгенде, ол толық жұтылған. Барлық өлшеулер 1100С температура мен атмосфералық қысымда жүргізілген. Заттың формуласын анықтаңыздар. Сөз болған реакция теңдеулерін жазыңдар. Шешуі: су буларының көлемі: V(H2) = 225 мл – 150 мл = 75 мл Көмір қышқыл газының сілтімен жұтылу ракцисы: CO2 + 2NaOH =Na2CO3 + H2O Көмір қышқыл газының көлемі: V(СО2) = 150 мл – 75 мл = 75 мл Жоғарғы температурада металл күйіндегі мыс арқылы өткізгенде жұтылған газ – артық мөлшерде алынған оттек: Cu + O2 = 2Cu O Оттектің артық мөлшерінің көлемі: V артық (O2) = 75 мл Оттектің әрекеттескен мөлшері: V рак (O2) = 150 мл – 75 мл = 75 мл Заттың құрамына оттек кіреді. Реакция схемасы: Cx Hy Oz + O2 = CO2 + H2 O Көлемдік қатынастар заңына сүйене отырып, коэффиценттерді анықтаймыз: V(Cx Hy Oz) : Vпрореаг (O2):V (CO2) : V(H2 O)г = 75:75:75:75 = 1:1:1:1. Бұдан:x =1, y =2, z = 1, ал заттың формуласы CH2 O 11 сынып -5. Изотоптар. 9 балл Хлорсутек пен дейтерий хлоридінің қоспасы берілген. Қоспадағы хлордың массалық үлесі 96,73 %.қоспадағы дейтерий хлоридінің массалық үлесін анықтаңыздар. Шешуі: қоспаның массасы 100 г үлгісін қарастырамыз. Қоспадағы атомдық хлордың массасы: m(Cl) = m Қоспадағы атомаралық сутек пен дейтерийдің массасын есептейміз: m(H) + m(D) = m – m((Cl) = 100 – 96,73 = 3,27 г немесе m(H) + m(D) = 3,27 г (1) Атомаралық хлордың массасы хлорсутектің құрамындағы m1(Cl) хлор мен дейтерий хлоридінің құрамындағы хлордың m2(Cl) массаларының қосындысынан тұрады: m(Cl) = m1(Cl) + m2(Cl) (2) m1(Cl) массасын табамыз: m1(Cl) = n(Cl) * M(Cl) = n1(Cl) * 35,5 (3) n1(Cl) – HCl құрамындағы атомаралық хлордың зат мөлшері. HCl құрамындағы атомаралық сутектің массасын табамыз: m(H) = n( H) * M(H) = n(H) *1 (4) n(H) – HCl. Құрамындағы атомаралық сутектің зат мөлшерін табамыз: Хлорсутектің формуласы бойынша: Демек, (3) и (4) теңдеулерден: Сол сияқты, дейтерий хлоридінің формуласы бойынша: m1(Cl) және m2(Cl) мәндерін (5) және (6) формуллаларға сүйене отырып, m(H) және m(D) арқылы өрнектелген атомаралық хлордың жалпы массасын табамыз: m(Cl)= 35,5 m(H)+35,5 немесе 35,5 m(H)+ 17,75m(D)= 96,73 Екі белгісізі бар (1) және (7) теңдеулер жүйесін аламыз: m(H)+ m(D) = 3,27 г 35,5 m(H)35,5 Оны шессек: m(D)= 1,09 г (6) теңдеуді пайдаланып, дейтерий хлоридінің құрамындағы хлордың массасын табымыз: m2(Cl) = 17,75 m(D)= 17,75Ч1,09=19,35 г Дейтерий хлоридінің массасын табамыз: m(DCl)=m(D)+m(Cl)= 1,09+1935 = 20,44 г. Қоспадағы дейтерий хлоридінің DCl массалық үлесі: W(DCl)= Олимпиада есептері 11 сынып 1-есеп. Өлшеніп алынған ашудас түзуге бейім белгісіз, сусыз тұз аммиак суында ерітілді. Алынған ерітіндіге көмір қышқыл газын жібергенде немесе оны көп уақыт бойы қайнатқанда ақ тұнба түзіледі. Азот ағынында қыздырылғаннан кейін тұнбаның массасы 9,37г болды. Егер тұнбаның осындай массасы сутегінің ағынында қыздырылса, 8,57г сұр түсті ұнтақ зат түзіледі. Аталған заттардың бәрін анықтағанда, реакция теңдеулерін жазыңдар, өлшеніп алынған белгісіз тұздардың массасын табыңдар. Шешуі: Белгісіз тұз І және ІІІ топтағы металдардың сульфаты болуы керек, себебі ашудастардың жалпы формуласы Шешуі: Белгісіз тұз І және ІІІ топтағы металдардың сульфаты болуы керек, себебі ашудастардың жалпы формуласы Me(I)ME(III)(So4)2*12H2O І топтың металының өкілдері болуы мүмкін емес, себебі олардың гидроксидтері ақ тұнба түзбейді. Me2(SO4)2+18NH4OH=3(NH4)2SO4+2[Me(NH3)]*(OH)3+12H2O t0 [Me(NH3)6](OH)3→6NH3+Me(OH)3 [Me(NH3)6](OH)3+3CO2+3H2O=3(NH4)2CO3+Me(OH)3 Бұл ақ түсті металл гидроксидінің қыздырғанда мынадай реакция жүреді t0 2Ме(ОН)3→Ме2О3+3Н2О Ал сутек ағынында тотықсыздану процесі жүруі мүмкін: Ме2О3+3Н2=2Ме+3Н2О Егер металдың эквиваленттік массасын Х деп белгілесек, онда эквивалент заңы бойынша теңдеу құрамыз. Х+Э0/Х+m(Me2O3)/m(Me) X+8/X=9.37/8.57 Бұдан Х=85.7 Ame=85.7*Z Ame=85.7*3=257.1 Бұл атомдық масса есептің шартына сәйкес келмейді. Демек тотықсыздану процесі металға дейін емес, оксидке дейін жүрген: Ме2О3+Н2=2МеО+Н2О (1) Ме2О3+Н2=Ме2О+2Н2О (2) Егер металдың атомдық массасын Х деп белгілесек, онда (1) реакция теңдеуі бойынша 2х+48/2х+32=9.37/8.57 x=A=69.7 Бұл Ga металы. Екінші теңдеу бойынша: 2х+48/2х+16=19.37/8.57 x=A=163.4 Бұл атомдық масса есептің шартына сәйкес келмейді. Сонымен бастапқы тұз Ga(SO4)3. Өлшеніп алынған тұздың массасын былай есептейміз: М(Ga2(So4)3)/y=M(Ga2O3)/m(Ga2O3) 427.4/y=187.4/9.37 y=21.37г. № 2-есеп. 100г этанолдың гександағы ерітіндісі 10,3г натриймен әрекеттеседі. Ерітіндінің осындай мөлшерін 1500С-та алюминий оксидінен өткізгенде ол толық әрекеттесті. Катализдік түтіктен шыққан қоспа қараңғыда 12г бромнан дайындалған, бром суымен реакцияға түседі. Түтіктен шыққан қоспаның сапалық және сандық құрамын анықтаңыздар. Шешуі: Жүретін реакция теңдеулерін жазайық. 2С2Н5ОН+2Na=2C2H5ONa+H2 (1) C2H5OH→CH2+H2O (2) 2C2H5OH→C2H5-O-C2H5+H2O (3) CH2=CH2+Br2=CH2Br-CH2Br (4) 1500С температурада (2) және (3) реакция жүреді. (1) және (4) реакция бөлме температурасындада жақсы жүреді. Енді 10,3г натрий массасын зат мөлшеріне (мольге) айналдырайық, VNa=mNa/mNa=10.3г/23г/моль=0,45моль (1) реакция бойынша 0,45 моль натриймен 0,45 моль этанол әрекеттеседі. mэт=Vэт*Мэт=0,45*46=20,7г Онда гексанның (еріткіш) массасы 79,3г (100г-20,7г) тең болады. 12г бромды мольге айналдырсақ, VBr=12г/80=0,15моль тең болады. (4) реакция бойынша 0,15 моль броммен 0,15 моль этилен әрекеттеседі. Демек, (2) реакция бойынша 0,15 моль су түзіледі. Енді (3) теңдеу бойынша реакцияға қатысқан этанолдың мөлшері 0,3 мольге тең болады. Осы реакция бойынша 0,3 моль этанолдан 0,15 моль жай эфир және 0,15 моль су түзіледі. (2) және (3) реакциялар бойынша барлығы 0,3 моль су түзіледі. Сонымен қоспаның массалық құрамы мынадай болады: Гексан – 79,3г Этилен – mэ=0.15 моль 28г/моль=4.2г Диэтилэфир mэф=0.15*74=11,1г Су- mсу=0.3моль*18г/моль=5,4 10 сынып № 1-есеп. Қанықпаған 4 көмірсутегінің проценттік құрамдары бірдей: 8,5,7 процент С және 14,3 процент Н. Олардың ауамен салыстырғандағы тығыздықтары 0,98; 1,5; 2,0; 2,43 болса, олар қандай көмірсутектер? Бұл көмірсутектердің алыну реакциялары теңдеулерін жаз. Структуралық (графикалық) формулаларын келтір. Шешуі: Ауамен салыстырмалы тығыздықтары негізінде көмірсутектердің жеке-жеке салыстырмалы молекулалық массаларын есептейік: Dауа= Mr(CxHy)/Mr(ауа) Mr(ауа)=29; M1(CxHy)=29*0.98=28.42; M2(CxHy)=29*1.5=43.5 M3(CxHy)=29*2.58 M4(MxHy)=29*2.43=70.47 Енді көмірсутектердің проценттік құрамы бойынша көміртегі мен сутегінің мөлшерін есептейік: 100г CxHy -85,7г С болса, 28,42г CxHy –х1 г. Х1=28,42* 85,7/100:=23,25г С; 23,25: 12≈2; екі атом С 100г CxHy -14,3г Н, 28,42г CxHy –х2 г; х2=28.42*14.3/100=4.1г Н сутегінің атом саны-4,1:1=47 Бірінші көмірсутегінің формуласы – С2Н4, бұл-этилен; СН2=CH2-этиленнің графикалық (структуралық) формуласы. Этиленнің алынуы: С2Н5ОН*Н2SO4/t0*C2H4↑+H2O немесе С2Н6→С2Н4+Н2; 100г СхНу – 85,7г С; 43,5г СхНу –х3г; х3=85.7*43.5/100=37.28г С 37,28:12=3 атом С. 100г СхНу –14,3г Н, 43,5г СхНу –х4; Х4=43,5*14,3/100=6,2г Н. 6,2:1=6 атом Н. Екінші көмірсутегі С3Н6-пропен, СН2=СН-СН3. Алынуы: С3Н8→С3Н6+Н2; 100г СхНу –85,7г С, 58г СхНу –х5 г; х5=85,7*58/100=49,7г С. 100г СхНу –14,3г Н бар 58г СхНу –х6 г; х6=58*14,3/100=8,3г Н 8,3:1=8 атом Н№ Үшінші көмірсутегі С4Н8-бутен. Н2С=СН-СН2-СН3 бутен-1 СН3-СН=СН-СН3 бутен-2 С4Н10→С4Н3+Н2 100г СхНу –85,7г С 100г СхНу –14,3г Н бар 79,47гт СхНу –х8 г х8=79,47*14,3/100=10,08г Н 10,08:1=10 атом Н№ Төртінші көмірсутегінің формуласы С5Н10-пентен. Кейбір изомерлерінің формуласы мен аттары: Н2С=СН-СН2-СН3 пентен-1 Н2С=СН-СН2-СН3-СН3 пентен-2 СН3-СН=С-СН3 2-метилбутен-2 | СН3 Жауабы: С2Н4-этилен, С3Н6-пропилен (пропен), С4Н10-пентен. Бәрі де қанықпаған көмірсутектерінің өкілдері. 9 – сынып № 1-есеп. 41,3г мыс пен мыс(ІІ) оксидінің 88 проценттік күкірт қышқылының біраз мөлшерінде ерітілген. Реакция нәтижесінде, 8,96л газ(қ.ж) бөлінген. Қоспаның алғашқы құрамын және түзілген тұздың мөлшерін есепте. Шешуі: Концентрлі күкір қышқылы қоспа құрамындағы екі затпен де әрекеттеседі Cu+2H2SO4=CuSO2+SO2↓+2H2O CuO+H2SO4=CuSO4+H2O Реакция нәтижесінде бөлінген газ күкірт (ІҮ) оксиді SO2. Бөлінген газдың көлемі бойынша әрекеттескен қоспадағы мыстың мөлшерін есептейміз: Х1 8,96 Cu+2H2SO4=CuSO4+SO2↓2H2O 64г 22,4 х1:8,96=64:22,4; х1=25,6г Cu. Қоспа құрамындағы мыс(ІІ) оксидінің мөлшері 41,3-25,6=15,7г болады. Есептің шартына сәйкес түзілген тұздың мөлшерін есептесек: 25,6 х2 Cu2H2SO4=CuSO4+SO2↓+2H2O 160 25.6:x2=64:160, бұдан х2=25.6*100/64=64г CuSO4 x3 CuO+H2SO4=CuSO4+H2O 80 160 15.7:x3=80:160, бұдан х2=15.7*160/80=31.4г CuSO4 Барлық түзілген тұздың мөлшері 64+31,4=95.4г. Жауабы 25,6г Cu 15,7г CuO, 95,4г Cu SO4 № 2-есеп. 81,95г калий хлориді, калий нитраты және бертолет тұздарының қоспасы массалары тұрақталғанда дейін қатты қыздырылған кезде газ бөлінген. Ол газды сутегімен әрекеттестіргенде, 14,4г су түзілген. Қатты қыздырылғаннан кейінгі өнім суда ерітіліп, күміс нитратының ерітіндісімен өңделген. Сонда 100,45г тұнба түзілген. Қоспаның проценттік құрамын анықтаңдар. Шешуі: Қатты қыздырғанда, калий нитраты мен бертолет тұзы айырылып, оттегі бөлінеді: 2КNO3=2KNO2+O2↑ (1) 2KCIO3=2KCI+3O2↑ (2) Бөлінген оттегінің сутегімен әрекеттесуі нәтижесінде түзілген судың мөлшерін біле отырып, оған кеткен оттегінің мөлшерін есептейміз: Х1 14,4 2Н2+О2=2H2O 36 x1:14.4=32:36, бұдан х1=14.4*32/36=12.8г О2; Оттегінің бұл мөлшері екі тұздың (КNO3 мен KCIO3) айыру нәтижесінде түзілгенін ескере осынша мөлшерде газ түзілу үшін қанша тұздар айырылғанын (1) және (2) теңдеулер бойынша есептейміз. Екі теңдеудің сол жақ бөлігін, оң жақ бөлігіне оң жақ бөлігін қосып, төмендегідей теңдеу құрайық: 2KNO3+2KCI3=2KNO3+2KCI+4O2↑ (3) Бұл теңдеудегі коэффициенттер жұп санды болғандықтан, екіге қысқартып, төмендегідей теңдеу аламыз: KNO3+KCIO3=KNO2+KCI+2O2↑ (4) Осы теңдеуді (4) пайдаланып, 12,8г О2 түзілу үшін қоспада KNO3 пен KCIO3 –тің мөлшері қандай екенін есептейміз: Х2 12,8 KNO3+KCIO3/223,5=KNO2+KCI+2O2↑ 64 x2:12.8=223.5:64, бұдан х2=12.8*223.5/64=44.7KNO3 пен KCIO3 Енді әуелгі қоспадағы калий хлоридінің мөлшерін табайық: 81,95-44,7=37,25г KCI Қатты қыздырғаннан кейінгі қалдық құрамындағы калий хлоридінің мөлшерін күміс нитратымен әрекеттескеннен кейінгі түзілген тұнбаның мөлшері бойынша табамыз: Х3 100,45 KCI+AgNO3=AgCI↓+KNO3 (5) 143.5 x3:100.45=74.5:143.5 бұдан х3=100.45*74.5/143.5=52.15г KCI Бертолет тұзы айырылуы кезінде түзілген калий хлоридінің мөлшері: 52,15-37,25=14,9г KCI 14,9г KCI түзілуі үшін айырылған KCIО3 мөлшерін есептейік: Х4 14,9 2KCIО3=2KCI+3О2↑ (6) 149 Х4:14,9=245:74,5 бұдан Х4=245*14,9/74,5=24,5 KCIО3 Қоспада 24,5г бертолет тұзы болған. Бұл мәлімет бойынша қоспадағы калий нитратының мөлшері 44,7-24,2г болады. Қоспадағы тұздардың проценттік мөлшері: С%ксе=37,25/81,95*100=45,45; С%ксIo3=24.5/81.95*100=29.9; C%kno3=20.2/81.95*100=24.65; Жауабы: 45,45%KCI; 8-сынып № 1-есеп. Азот қышқыл натрий мен натрий хлоридінің 3,72 қоспасы 21,28мл суда ерітілген. Осы ерітіндінің азот қышқыл күміс тұхымен әрекеттестіргенде 2,86г тұнба түзілген. Қоспаның проценттік құрамын және даярланған ерітіндідегі тұздардың проценттік мөлшерін есепте. Шешуі: Ерітіндінің мөлшерін есептейміз: 21,28мл немесе 21,28г су 21,28+3,72=25г ерітінді. Азот қышқыл күміс тұзымен ерітіндідегі натрий хлориді ғана реакцияланады: NaCI+AgNO3=AgCI↓+NaNo3 Түзілген тұнбаның мөлшері бойынша ерітіндіде қанша натрий хлориді болғанын есептейміз: Х1 2,86г NaCI+AgNO3=AgCI↓+NaNO3 143.5г Х1:2,86г=58,5г:143,5г бұдан Х1=2,86*58,5/143,5=1,17г NaCI Қоспадағы азот қышқыл натрий тұзының мөлшері: 3,72-1,17=2,55г. Қоспадағы тұздардың проценттік құрамын есептейміз. %NaCI=1.17/3.72*100≈4.68% %NaNO3=2.55/3.72*100≈68.55 Ерітіндідегі қоспаның жеке-жеке проценттік мөлшерін есептейміз: 25г ерітіндіде 1,17г NaCI, 100г ерітіндіде-Х2; бұдан Х2=1,17/25*10≈4,68% 25г ерітіндіде – 2,55г NaNO3, 100г ерітіндіде-Х3; Х3=2,55/25*100≈10,2% 2-есеп. Д.И.Менделеевтің периодтық системасында бір периодқа орналасқан екі элемент А2В2 қосылысын түзеді. А элементі оксидінің құрамында 47 процент оттегі бар, ал екінші элемент сутегімен қосылысының құрамында 94,1 процент В элементі бар. А және В элементтерін ата. Шешуі: Есептің шарты бойынша А2В3 қосындысында А элементі үш валентті, ал В элементі екі валентті. Оттегінің проценттік молшері бойынша А элементі оксидінің молекулалық массасын есептейміз: 100г оксидте (А2В3)-47г О бар, Х1 г оксидте -48 г О бар. (Мұндағы 48г – оттегінің үш атомының массасы) Х1=48*100/47=102г. Бұл оксидтің құрамына А элементінің 2 атомы кіретінін ескеріп, оның мөлшерін табамыз: 2А=102-48=54 А=54:2=27г. Бұл алюминийдің массасына сәйкес келеді де, оның оксидінің формуласы АІО3 болады. В элементі екі валентті болғандықтан, оның сутекті қосылысының Н2В молекулалық массасын есептеу үшін сутегінің проценттік мөлшері: 100-94,1=59% болатынын есептейміз. 100гН2В қосылысында 5,9гН, х2 қосылысында 2г Н бар (2 атомына сәйкес): х2=2*100/5,9=34г Н2В В элементінің массасы 34-2=32г болады, бұл-күкірт элементінің массасына сәйкес келеді. Күкірттің сутегімен қосылысының формуласы Н2S Жауабы: АІ және S |
