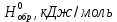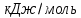фос. ФОС по дисциплине Химия Педиатрия. Омский государственный медицинский университет
 Скачать 68.33 Kb. Скачать 68.33 Kb.
|

СФОРМУЛИРУЙТЕ ВЫВОД О ТЕПЛОВОМ ЭФФЕКТЕ ХИМИЧЕСКОЙ РЕАКЦИИ.
ТЕСТ № 2 01. К КОЛЛИГАТИВНЫМ СВОЙСТВАМ РАСТВОРОВ НЕ ОТНОСЯТ 1) понижение давления насыщенного пара растворителя 2) понижение температуры замерзания и повышение температуры кипения раствора; 3) увеличение вязкости раствора 4) осмотическое давление 02. ИЗОТОНИЧЕСКИЙ КОЭФФИЦИЕНТ ВАНТ-ГОФФА ЭТО ПОПРАВКА, УЧИТЫВАЮЩАЯ 1) увеличение равновесного давления пара над чистым растворителем при нагревании 2) непостоянство давления при нагревании или охлаждении раствора 3) различие молярных масс растворителя и растворенного вещества изменение числа частиц в растворе при диссоциации или ассоциации молекул 03. ВЕЛИЧИНА ОСМОТИЧЕСКОГО ДАВЛЕНИЯ РАСТВОРА НИТРАТА КАЛЬЦИЯ ЗАВИСИТ ОТ давления концентрации электролита температуры константы диссоциации воды 04. ВЕЛИЧИНА ОСМОТИЧЕСКОГО ДАВЛЕНИЯ ПЛАЗМЫ КРОВИ РАВНА 240 кПа 780 атм 780 кПа 10 атм 05. КАКОЕ ЯВЛЕНИЕ ПРОИЗОЙДЕТ, ЕСЛИ КЛЕТКУ ПОМЕСТИТЬ В 5%-НЫЙ РАСТВОР ХЛОРИДА НАТРИЯ плазмолиз деплазмолиз лизис набухание 06. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ КРОВИ, СОЗДАВАЕМОЕ ЗА СЧЕТ БЕЛКОВ ПЛАЗМЫ, НАЗЫВАЕТСЯ ________________. 07. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРА РАССЧИТЫВАЕТСЯ ПО УРАВНЕНИЮ _____________________. 08. СРАВНИТЕ ВЕЛИЧИНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ РАСТВОРОВ ГЛЮКОЗЫ С6Н12О6, NACL, CACL2, ALCL3, ЕСЛИ В 1 ДМ3 КАЖДОГО РАСТВОРА СОДЕРЖИТСЯ 0,01 МОЛЬ ВЕЩЕСТВА ПРИ 270С (СТЕПЕНЬ ДИССОЦИАЦИИ СОЛЕЙ 1). 1) одинаковы 2) больше в растворе NaCl 3) больше в растворе глюкозы 4) больше в растворе AlCl3 09. ВЕЛИЧИНА ИЗОТОНИЧЕСКОГО КОЭФФИЦИЕНТА ПРИ РАСЧЕТЕ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ РАСТВОРА:
10. ВЫЧИСЛИТЕ ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРА, В 1 ДМ3 КОТОРОГО СОДЕРЖИТСЯ 0,05 МОЛЬ НЕЭЛЕКТРОЛИТА ПРИ 270С. 1) 1,25 ∙ 105 Па 2) 2,50 ∙ 105 Па 3) 0,75 ∙ 105 Па 4) 12,5 ∙ 105 Па ИНСТРУКЦИИ И МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ ПО ПРОЦЕДУРЕ ОЦЕНИВАНИЯ. Выполнение заданий теста оценивается следующей суммой баллов
Таблица перевода набранной суммы баллов в пятибалльную систему оценки
ИТОГОВЫЙ ТЕСТ ПО ДИСЦИПЛИНЕ «ХИМИЯ» Специальность 31.05.02 Педиатрия Часть 1. При выполнении тестовых заданий №1-14 выбрать ответ, номер которого внести в таблицу. 01. ЭНТРОПИЯ СИСТЕМЫ СЛУЖИТ МЕРОЙ 1) устойчивости системы к распаду 2) тепловой энергии системы 3) неупорядоченности и бесструктурности системы 4) температуры системы 02. КОЛИЧЕСТВЕННОЙ ХАРАКТЕРИСТИКОЙ МЕЖИОННЫХ ЭЛЕКТРОСТАТИЧЕСКИХ ВЗАИМОДЕЙСТВИЙ В РАСТВОРАХ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ ЯВЛЯЕТСЯ 1)осмотическое давление 2) ионная сила 3) ионное произведение воды 4) степень диссоциации 03. ИОНЫ NH4+ И Н3О+ ЯВЛЯЮТСЯ С ПРОТОННЫХ ПОЗИЦИЙ 1) анионными основаниями 2) нейтральными кислотами 3) не проявляют кислотных свойств 4) катионными кислотами 04. ТОЛЬКО ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА ПРОЯВЛЯЕТ ВЕЩЕСТВО 1) Na2O2 2) НClO3 3) H2S 4) KNO2 05. 16 ЭЛЕКТРОНОВ СОДЕРЖИТ ЧАСТИЦА 1) Cl - 2) S 2- 3) O 4) S 06. КОНСТАНТА ГИДРОЛИЗА СОЛИ ЗАВИСИТ ОТ 1) концентрации соли 2) давления 3) температуры 4) объема раствора 07. В СООТВЕТСТВИИ С ЗАКОНОМ СЕЧЕНОВА НА РАСТВОРИМОСТЬ ГАЗОВ В ЖИДКОСТЯХ ОКАЗЫВАЕТ ВЛИЯНИЕ 1)давление 3) присутствие электролитов в растворе 2) температура 4) природа компонентов 08. ЭНТРОПИИ ОБРАЗОВАНИЯ СACO3 СООТВЕТСТВУЕТ ЭФФЕКТ РЕАКЦИИ 1) Ca(т) +1/2О2(г) +СО2(г) = СaCO3(т) 2) Ca(т) +3/2О2(г) +С(графит) = СaCO3(т) 3) СаО(т) + СО2(г) =СaCO3(т) 4)СаО(т) + С (т) + О2(г) =СaCO3(т)   09. В ЦЕПИ ПРЕВРАЩЕНИЙ S +O2 X 1 +KOH X2 ВЕЩЕСТВОМ Х2 ЯВЛЯЕТСЯ 09. В ЦЕПИ ПРЕВРАЩЕНИЙ S +O2 X 1 +KOH X2 ВЕЩЕСТВОМ Х2 ЯВЛЯЕТСЯK2SO3 K2SO4 K2S K2O 10. В СОСТАВЕ ГЕМОГЛОБИНА КРОВИ КОМПЛЕКСООБРАЗОВАТЕЛЕМ ЯВЛЯЕТСЯ 1) Fе 2) Fе2+ 3) Fе 3+ 4) FеО+ 11. ВЕРНЫ ЛИ СЛЕДУЮЩИЕ УТВЕРЖДЕНИЯ О СТРОЕНИИ МОЛЕКУЛЫ ЭТАНОЛА? А) МОЛЕКУЛА ЭТАНОЛА СОДЕРЖИТ АТОМЫ УГЛЕРОДА ТОЛЬКО В SP3– ГИБРИДНОМ СОСТОЯНИИ Б) МОЛЕКУЛА ЭТАНОЛА СОДЕРЖИТ ТОЛЬКО σ- СВЯЗИ 1) верно только А 2) верно только Б 3) верно А и Б 4) неверны оба утверждения 12. ДЛЯ СМЕЩЕНИЯ РАВНОВЕСИЯ В СИСТЕМЕ CO(г) + Cl2(г) ↔ COCl2(г) , Δ H 0 0 , В СТОРОНУ ОБРАЗОВАНИЯ ПРОДУКТОВ НЕОБХОДИМО 1) понизить температуру и давление 2) повысить температуру и давление 3 )понизить температуру и повысить давление 4) повысить температуру и понизить давление 13. СРЕДИ СЛЕДУЮЩИХ ВЕЩЕСТВ УКАЖИТЕ ИЗОМЕР СОЕДИНЕНИЯ СНЗ–СН2–СН2–СН2–СООН 1) пентаналь 2) 2-метилпентанова кислота 3) гексановая кислота 4) 2-метилбутановая кислота 14. ОПРЕДЕЛИТЕ ЗАРЯД И НАЗОВИТЕ КОМПЛЕКСНОЕ СОЕДИНЕНИЕ [Тi4+(NO2)3(Cl)2(H2O)]х 1) –1; аквадихлоротринитратотитанат (IV) 2) +1; аквадихлоротринитротитан(IV) 3) –1; аквадихлоротринитротитанат (IV) 4) +1; аквадихлоротринитратотитан (IV) Часть 2. Решить задачи № 15,16; в таблицу внести номер, соответствующий полученному ответу задачи. 15. ОПРЕДЕЛИТЕ рН КИШЕЧНОГО СОКА, ЕСЛИ КОНЦЕНТРАЦИЯ ГИДРОКСИД- АНИОНОВ В ЭТОЙ БИОЛОГИЧЕСКОЙ ЖИДКОСТИ СОСТАВЛЯЕТ 2,3·10-6 моль·дм-3 1) 5,64 2) 9,2 3) 6,54 4) 8,36 16. РАССЧИТАЙТЕ МОЛЯРНУЮ КОНЦЕНТРАЦИЮ ЭКВИВАЛЕНТА РАСТВОРА ЖЕЛЕЗА (II) СУЛЬФАТА, СОДЕРЖАЩЕГО 1,52 Г СОЛИ В 200 СМ3 РАСТВОРА. КАКОЙ ОБЪЁМ РАСТВОРА КАЛИЯ ПЕРМАНГАНАТА С КОНЦЕНТРАЦИЕЙ С(1/5КMNO4) = 0,1 МОЛЬ·ДМ-3 ИЗРАСХОДУЕТСЯ НА ТИТРОВАНИЕ 20 СМ3 ЭТОГО РАСТВОРА? 1) 0,1 моль·дм-3 ;20 см3 3) 0,05 моль·дм-3;1 см3 2) 0,05 моль·дм-3 ;10 см3 4) 0,2 моль·дм-3; 40 см3 МАТРИЦА ОТВЕТОВ К ТЕСТОВЫМ ЗАДАНИЯМ
ИНСТРУКЦИИ И МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ ПО ПРОЦЕДУРЕ ОЦЕНИВАНИЯ Выполнение заданий теста оценивается следующей суммой баллов
Таблица перевода набранной суммы баллов в пятибалльную систему оценки
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||