Химия. 05.11. Химия ПБ-11 - копия (2). Внутренняя энергия и энтальпия. Закон Гесса. Энтропия. Свободная энергия Гиббса
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
Инструкция для самостоятельной работы студента группы ПБ-11 по химии I семестр. Номер пары: 14 Дата: 05.11.2020г Тема урока: Внутренняя энергия и энтальпия. Закон Гесса. Энтропия. Свободная энергия Гиббса. Цель:Классифицировать химические реакции по тепловому эффекту; Объяснять значимость теплового эффекта химических реакций; Поясняет процессы разрыва и образования новых химических связей Объясняет физический смысл закона Гесса; Использует закон Гесса для расчета изменения энтальпии химических реакций; Характеризует энтропию как меру беспорядка в системе; Определять значения энтальпии и энтропии по справочным данным. Ссылки на страницу учебника: учебник «Химия» издательство «Мектеп», параграф 28-32 Краткий тезисный конспект Все химические реакции сопровождаются выделением или поглощением тепла. Реакции первого типа называются экзотермическими, реакции второго типа — эндотермическими. Мерой теплоты реакции служит изменение энтальпии ΔН, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная. У многих химических реакций ΔG и ΔН имеют близкие значения. Это обстоятельство позволяет определять энергетическую ценность пищевых продуктов. В живых организмах пища обычно окисляется кислородом до СО2 и H2O . Максимальную химическую работу, которую питательные вещества могут совершить в организме, т. е. ΔG реакции окисления компонентов пищи, определяют путем сжигания взятой навески соответствующего вещества в калориметре в атмосфере кислорода. Выделившееся тепло повышает температуру воды в калориметре. По разности температур рассчитывают теплоту реакции (энтальпию сгорания). Энтальпия и энтропия Теплота реакции ΔН и изменение свободной энергии ΔG не всегда имеют сравнимые значения. В действительности известны реакции, протекающие спонтанно (ΔG < 0) несмотря на то, что являются эндотермическими (ΔΗ > 0). Это происходит потому, что на прохождение реакции оказывает влияние изменение степени упорядоченности системы. Мерой изменения упорядоченности системы служит изменение энтропии ΔS. Энтропия системы тем выше, чем больше степень неупорядоченности (беспорядка) системы. Таким образом, если процесс идет в направлении увеличения неупорядоченности системы (а повседневный опыт показывает, что это наиболее вероятный процесс), ΔS — величина положительная. Для увеличения степени порядка в системе (ΔS > 0) необходимо затратить энергию. Оба этих положения вытекают из фундаментального закона природы — второго закона термодинамики. Количественно зависимость между изменениями энтальпии, энтропии и свободной энергии описывается уравнением Гиббса-Гельмгольца: ΔG = ΔH - T · ΔS Поясним зависимость этих трех величин на двух примерах. Взрыв гремучей смеси — это взаимодействие двух газов — кислорода и водорода — с образованием воды. Как и многие окислительно-восстановительные реакции. это сильно экзотермический процесс (т. е. ΔН << 0). В то же время в результате реакции возрастает степень упорядоченности системы. Газ с его хаотически мигрирующими молекулами перешел в более упорядоченное состояние -- жидкую фазу, при этом число молекул в системе уменьшилось на 1/3. В результате увеличения степени упорядоченности (ΔS < 0) член уравнения -T · ΔS — величина положительная, однако это с избытком компенсируется ростом энтальпии: в итоге происходит высоко экзергоническая реакция (ΔG <<0). При растворении в воде поваренной соли ΔН — величина положительная, температура в сосуде с раствором, т. е. в объеме раствора, снижается. Тем не менее процесс идет спонтанно, поскольку степень упорядоченности системы уменьшается. В исходном состоянии ионы Na+ и Сl- занимали фиксированные положения в кристаллической решетке. В растворе они перемещаются независимо друг от друга в произвольных направлениях. Снижение упорядоченности (ΔS > 0) означает, что член уравнения -T · ΔS имеет знак минус. Это компенсирует ΔН и в целом ΔG — величина отрицательная. Подобные процессы принято называть энтропийными. Пользуясь табличными значениями Анализ закона Гесса позволяет сформулировать следующие следствия: Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества. При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
Энтальпия гидратации равна разности энтальпий растворения безводной соли План действий: Прочитать текст учебника параграф 28-32 2. Составь тезисный конспект Используя справочные данные выполни задание: А) Найдите энтальпию реакции NH3+ HCl = NH4Cl Все вещества газообразные, запишите термохимическое уравнение, Б) Определите объем хлорида аммония (при н.у.), если для реакции взяли 2,5 л. аммиака. В) Рассчитайте какое количество теплоты выделится или поглотится при вступлении в реакцию данного объема аммиака. 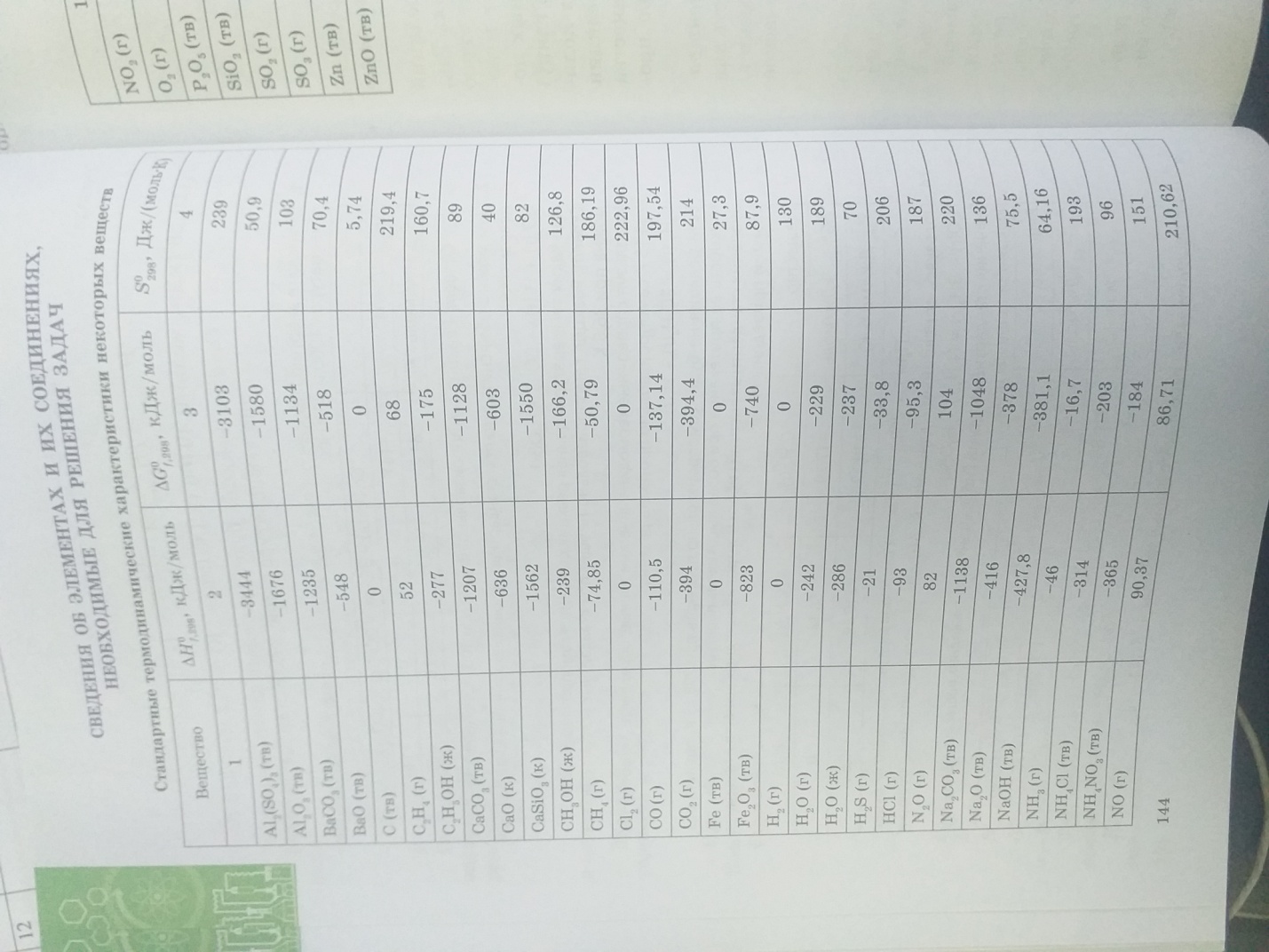 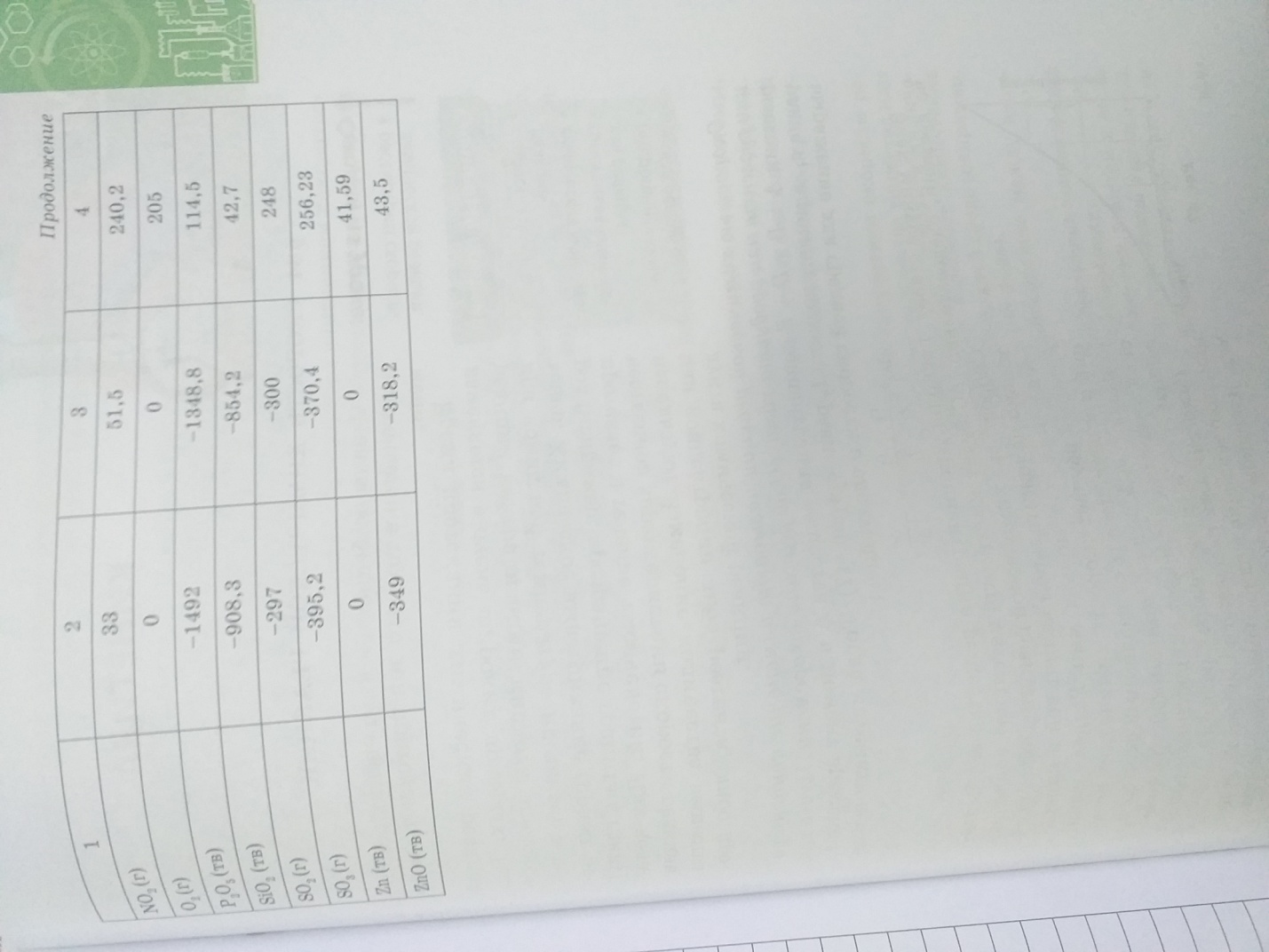 Ответы прикрепить в система параграф (или классрум) |
