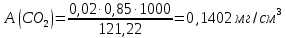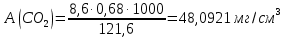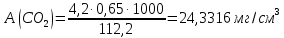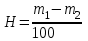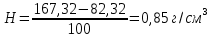Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Уфимский государственный нефтяной технический университет»
Кафедра: «Газохимия и моделирование химико-технологических процессов»
Отчет
по лабораторной работе №1
на тему:
«Определение динамической емкости гранулированных цеолитов по углекислому газу»
Вариант №7
Выполнил: Маликова И.М.
студент группы БТГ-17-01
Принял: Хафизова С.Р.
Уфа-2021
1 Литературный обзор
Адсорбционные методы осушки и очистки газовых сред
Адсорбционная очистка веществ представляет собой физический процесс и характеризуется невысокими тепловыми эффектами (10-30 кДж/моль). При физической адсорбции адсорбируемая молекула может обратно переходить в газовую фазу при определенных внешних условиях. Факторы, влияющие на физическую адсорбцию – это температура, общее давление и парциальное давление адсорбата в газе. Причиной возникновения адсорбции является не скомпенсированное состояние атомов на поверхности. При адсорбции молекулы вступают во взаимодействие с поверхностными атомами, при этом они сохраняют свою химическую природу. Физическая адсорбция происходит на границе раздела поверхность и адсорбционная фаза с образованием монослоя адсорбата. На результаты адсорбции влияют как адсорбционные свойства поверхности твердого тела, так и природа адсорбируемой молекулы [12-14].
Процесс осушки различных веществ с использованием адсорбентов основан на способности твердых тел определенной структуры поглощать влагу из ее смеси с другими соединениями, находящимися в газовой фазе, при сравнительно низких температурах и выделять при высоких температурах. В первом случае происходит адсорбция, или поглощение влаги, во втором – десорбция. Сочетание этих двух процессов на одной установке позволяет организовать непрерывное извлечение влаги из осушаемой смеси. Также адсорбционным способом очищают природный газ от других нежелательных примесей, таких как сероводород, меркаптаны и углекислый газ [8-11, 15]. Недостатки адсорбционных методов – периодичность процесса очистки, необходимость и высокая стоимость регенерации адсорбентов. Существенным недостатком адсорбентов является снижение поглотительной способности в процессе эксплуатации, особенно при очистке газа, содержащего большое количество примесей [8, 11]. В то же время применение трех адсорберов при адсорбционной очистке газа, позволяет проводить процесс осушки и очистки непрерывно. В циклограмме работы адсорберов первый адсорбер в режиме адсорбции, второй – регенерации и третий - охлаждения.
Принципиальная схема установки адсорбционной очистки и осушки газа представлена на рисунке 1.1.
1,2,3 - адсорберы, 4 - сепаратор, 5, 6, 7 - емкостное оборудование;
9 - топочная печь
Рисунок 1.1 - Принципиальная схема установки адсорбционной очистки и осушки газа
Классификация адсорбентов и адсорбатов
В [16] на основе известных фактов и обобщений, накопленных в области адсорбции молекул разной геометрической и электронной структуры на твердых телах с различными химическими свойствами поверхности, предложена классификация, которая учитывает природу межмолекулярных взаимодействий на коротких расстояниях. В ней выделены три типа адсорбентов и четыре группы адсорбатов.
Первый тип адсорбентов – это «не специфические адсорбенты», на поверхности которых отсутствуют ионы или функциональные группы, а также звенья с электронно-донорными или электронно-акцепторными свойствами, или с π-электронными связями. Примером таких адсорбентов служат: графитированная сажа, сильно дегидроксилированный кремнезем и адсорбенты, поверхность которых достаточно полно химически модифицирована прививкой насыщенных групп.
Второй тип адсорбентов – это «специфические адсорбенты», на поверхности которых присутствуют сосредоточенные положительные заряды. В этих случаях резко проявляется специфические взаимодействия между сосредоточенными положительными зарядами поверхности адсорбента и теми звеньями молекул адсорбата, которые обладают полярностью или π-связями. Примером таких адсорбентов служат цеолиты в различных катионных формах и гидрооксилированный кремнезем.
Третий тип это «специфические адсорбенты» (сравнительно мало изученные), на поверхности которых присутствуют отрицательные заряды (π-связи, отрицательные и имеющие малые размеры ионы диполей, анионы и другие электронно-донорные центры). Такие адсорбенты получаются модифицированием поверхности путем прививки тех или иных функциональных групп. Эти адсорбенты используются в хроматографии в качестве адсорбционной фазы.
В промышленной практике широко представлены адсорбенты первых двух типов.
При совместном присутствии в газе молекул разной химической природы, наблюдается избирательная адсорбция. Так, присутствие паров воды, приводит к снижению адсорбции молекул углекислого газа в цеолите. Согласно [16], молекулы адсорбатов по своей химической природе выделены в 4 группы.
В первую группу выделены неполярные молекулы благородных газов и насыщенных углеводородов (УВ), атомы в которых связаны только σ-связями. Межмолекулярные взаимодействия молекул этой группы с любыми другими молекулами или адсорбентами (в отсутствие химических реакций) обусловлены, в основном, неспецифическим дисперсионным притяжением. Примерами таких молекул являются метан, этан, н-гексан, аргон и четыреххлористый углерод.
Ко второй группе относятся полярные молекулы, содержащие фрагменты с неподеленными электронными парами или π-связями. Примерами таких молекул являются азот, ненасыщенные углеводороды. Взаимодействия последних с адсорбирующей поверхностью могут быть специфическими или неспецифическими в зависимости от химической природы адсорбента.
К третьей группе относятся молекулы, на периферических фрагментах которых сосредоточен положительный заряд. Примером такой молекулы является LiCH3
К четвертой группе относятся молекулы, в функциональных группах которых электронная плотность сконцентрирована на одном из центров и понижена на другом. К ним относятся молекулы Н2О, H2S, CO, CO2, ROH, первичные и вторичные амины.
Из выше сказанного следует, что молекулы вторых, третьих и четвертых групп будут специфически взаимодействовать с поверхностью адсорбента второго типа.
Данная классификация адсорбентов и адсорбатов, основанная на их химической природе, позволяет определить характер взаимодействия при адсорбции. Эта классификация удобна для качественного описания адсорбции и мало информативна для количественного описания адсорбции, так как не рассматривает количество адсорбата в газовой фазе, строение поверхности адсорбента.
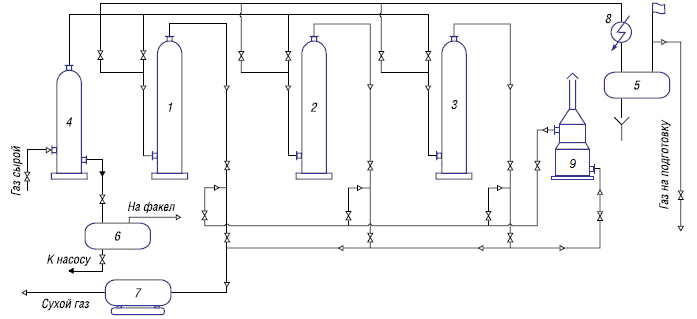
Многочисленные экспериментальные данные по физической адсорбции указывают на то, что при увеличении давлении пара адсорбция не ограничивается одним слоем адсорбированных молекул, а продолжает расти, переходя в итоге в объемную конденсацию. Брунауэр [17] выделил 5 основных типов изотерм, каждая из которых описывает поведение адсорбции в зависимости от природы взаимодействующих пар адсорбента и адсорбата, приведенных на рисунке 1.2.
Тип I. Изотерма описывается теорией монослоя и уравнением Ленгмюра при асимптотическом приближении количества адсорбированного газа к емкости монослоя.
Тип II. Наиболее общий тип изотермы, соответствующий формированию полислоя на поверхности с высоким адсорбционным потенциалом.
Тип III. Сравнительно редко встречающийся тип изотерм образования полислоя из газовой среды на твердом адсорбенте, для тел, потенциал монослоя которых мал и имеет тот же порядок, что и теплота конденсации адсорбтива.
Типы IV и V аналогичны типам II и III и характерны для пористых сорбентов, где адсорбция ограничивается объемом мезопор (2-50 нм), а предельная адсорбция достигается при давлениях Р/Рs << 1. Часто такие изотермы имеют петлю гистерезиса, что указывает на дополнительное поглощение пара в результате капиллярной конденсации.
Следует отметить, что существует ряд изотерм адсорбции, которые трудно отнести к какому-либо из типов выделенных в классификации по Брунауэру.
Рисунок 1.2 - Основные типы изотерм адсорбции по классификации Брунауэра [17]
На практике адсорбент - это пористое тело с развитой удельной поверхностью. Характер пористой структуры сильно влияет на общую форму изотермы адсорбции и на форму гистерезисной петли. Поры характеризуются различными формами и размерами. Для качественного и количественного описания адсорбции рассматривают модель пор цилиндрической формы. В зависимости от размеров пор они разделяются на микропоры (<2 нм), мезопоры (2-50 нм) и макропоры (>50 нм). Адсорбция одних и тех же молекул в указанных порах отличаются. Так адсорбция в макропорах соответствует адсорбции молекулы на ровной поверхности. Адсорбция в мезопорах характеризуется тем, что в ряде случае при десорбции на изотерме наблюдается петля гистерезиса.Указанную особенность адсорбции на мезопорах объясняет теория капиллярной конденсации, в которой рассматриваются модели адсорбции газа в одиночной цилиндрической поре двух видов - закрытой с одного конца и открытой с обоих концов (полая трубка). Эта теория постулирует, что дополнительное поглощение пара пористыми телами происходит в порах адсорбента вследствие объемной конденсации на вогнутой поверхности твердого тела, покрытой адсорбированной пленкой. Давление пара над ней станет насыщенным еще до того, как оно примет значение давления насыщенных паров при данной температуре и давлении в объеме газа. Чем больше кривизна пленки, тем раньше пар будет насыщенным и тем раньше начнется его конденсация в порах твердого тела. Адсорбция различных молекул в таких порах не сильно отличается друг от друга. При десорбции в мезопорах, закрытыми с одного конца, на изотерме наблюдается петля гистерезиса в отличие от открытых мезопор. То есть изотерма десорбции отличается от изотермы адсорбции. Теплота адсорбции на макро- и мезопористых адсорбентах в области монослоя практически не отличается от теплоты адсорбции на гладкой поверхности.
Изотерма адсорбции в микропористых телах резко отличается от двух предыдущих примеров [18]. При малых парциальных давлениях наблюдается достижение предельной емкости адсорбента, которое обусловлено особенностью адсорбции в микропорах. В них расстояние между противоположными стенками меньше 2 нм. Каждая из противоположных стенок микропор имеет своё распределение сил притяжения и отталкивания. В пространстве поры эти силы будут накладываться друг на друга. Наложение сил имеет два следствия. Первое: результирующая сила в микропорах выше, чем над плоской поверхностью. Второе: в пространстве микропоры имеется область, в которой значение результирующей силы почти постоянно. Молекулам адсорбата, попавшим в “пору-ловушку” почти безразлично, где находиться в зонах расположения бывших потенциальных ям или в центре микропоры. Пространство внутри микропоры существенно однороднее, чем пространство над плоской поверхностью и поверхность микропор, как исключительное место адсорбции, теряет своё значение. Местом адсорбции в них становится объём микропор.
Важнейшие физико-химические характеристики адсорбентов
В качестве адсорбентов применяются твердые вещества, имеющие большую удельную поверхность, отнесенную обычно к единице массы вещества. В зависимости от вида и сорта адсорбента его удельная поверхность изменяется от десятков до сотен квадратных метров на грамм. В промышленности широко применяются адсорбенты с удельной поверхностью 600-800 м2/г [9, 14].
Одна из важнейших характеристик адсорбента – его адсорбционная емкость, т.е. количество вещества, которое может быть поглощено единицей массы или объема адсорбента при данных условиях адсорбции. Величина адсорбционной емкости может иметь единицы измерения (%масс.), (г/г), (г/100г) и т. п. Адсорбционную емкость в некоторых источниках литературы называют активностью адсорбента.
Промышленные адсорбенты должны: иметь большую адсорбционную емкость, высокую селективность и механическую прочность; быть способными к регенерации, обладать стабильностью адсорбционных свойств в условиях длительной эксплуатации; быть нетоксичными и не вызывать коррозию; иметь низкую стоимость. Поэтому выбор адсорбента для промышленного использования всегда является поиском компромиссов и приходится отдавать предпочтение тем или иным из перечисленных требований.
Цеолиты являются микропористыми материалами с предельно узким распределением пор, поэтому для них характерно объемное заполнение внутрикристаллического пористого пространства при сорбции различных молекул. Кроме того, наличие катионов в полостях пористой структуры цеолитов обуславливает следующие дополнительные особенности последних как адсорбентов [19,20]:
- влияние химической природы и содержания обменных катионов на размеры входных окон в полости цеолитов;
- при обмене катионов Na+ на другие катионы возможно изменение положения последних в полостях, которое приводит к изменению предельного объема для заполнения;
- специфическое взаимодействие молекул с обменными катионами при малых степенях заполнения адсорбционного объема.
1.4 Методы синтеза гранулированных цеолитов
В производстве синтетических цеолитных адсорбентов различного типа существует два основных направления. Первое направление – производство гранулированных цеолитов с применением связующих веществ, главным образом, глин. В этом случае процесс получения цеолитов состоит из двух основные стадий: приготовления высокодисперсного цеолитного порошка и грануляции его с применением связующего [21].
Вторым направлением в производстве цеолитных адсорбентов является получение их в виде гранул, не содержащих связующих веществ и представляющих собой единый поликристаллический сросток. В этом случае формовка гранул из аморфного исходного материала производится до кристаллизации в щелочных растворах. Готовые гранулы сохраняют размеры, форму и приобретают необходимую прочность.
Принципиальная технологическая схема получения гранулированных цеолитов представлена на рисунке 1.3.
Сырьем для получения натриевой формы цеолитов являются силикат-глыба, гидроксид алюминия и едкий натр. Гидроксид алюминия растворяют в кипящем растворе едкого натра, разбавляют и таким образом получают рабочий раствор алюмината натрия. Силикат-глыбу разваривают острым паром, после чего раствор жидкого стекла разбавляют водой для получения требуемой концентрации.
При получении калиевой или кальциевой формы цеолита кристаллит с фильтра 3 направляют в реактор 10, где происходит катионный обмен в среде раствора хлористого калия. Кристаллит, после обмена выделяют на фильтре 11, затем гранулируют со связующим по обычной схеме.
Методы синтеза гранулированных цеолитов со связующим достаточно хорошо разработаны и внедрены в промышленности, как в нашей стране, так и за рубежом. Возможность варьирования типом и количеством цеолита и связующего, введение различных добавок в состав формуемой массы позволяет без существенных изменений технологической схемы получать адсорбенты с желаемыми потребительскими свойствами. Однако введение в состав гранул 20-25% мас. связующего снижает адсорбционную ёмкость этих адсорбентов на указанную величину в сравнении с цеолитами без связующего.
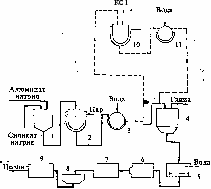
1 – смеситель; 2 – кристаллизатор; 3, 11 – фильтры; 4 – бегуны; 5 – увлажнитель; 6 – гранулятор; 7 – сушилка; 8 – сито; 9 – печь; 10 – реактор
Рисунок 1.3 – Схема получения гранулированных цеолитов со связующим
Гранулированные цеолиты типа А без связующего в виде поликристаллических сростков получают путём кристаллизации в щелочных (щелочных-алюминатных) растворах предварительно сформованных различными способами из различного Аl, Si-содержащего сырья, механически прочных, как правило, рентгеноаморфных гранул. Цеолитная гранула при этом сохраняет первоначальный размер и форму и за счёт образования единого поликристаллического сростка приобретает дополнительную механическую прочность.
Синтез цеолитов в виде поликристаллических сростков направлен на получение гранулированных продуктов, обладающих максимально возможной адсорбционной ёмкостью, сопоставимой с ёмкостью высокодисперсных цеолитов тех же структурных типов. В этом случае, в цеолитных гранулах, при степени кристалличности близкой к 100%, отсутствует связующий (аморфный, нецеолитный) материал. Гранула - это единый сросток кристаллов, что и обеспечивает её высокую механическую прочность. Связи, возникшие в процессе кристаллизации между отдельными кристаллами, всегда прочнее, чем связи между изначально разнородными по природе кристаллами высокодисперсного цеолита и связующим материалом (в случае формования цеолитов со связующим).
Природными материалами, представляющими наибольший интерес в качестве сырья для производства цеолитов, являются каолины. Величина соотношения кремнезёма и глинозёма в каолине примерно такая же, как в цеолите типа А. Термическая аморфизация каолина при температурах 600-700°С в течение 6-8 ч приводит к образованию дисиликата алюминия, способного при взаимодействии со щёлочью в гидротермальных условиях практически полностью кристаллизоваться в цеолит типа А. Однако известно, что синтез гранулированных цеолитов типа А без связующего только из каолина невозможен из-за чрезвычайно плотной пористой структуры прокалённых рентгеноаморфных гранул, внутрь которых диффузия компонентов щелочного раствора затруднена.
Разработаны способы улучшения (разрыхления) пористой структуры прокалённых гранул за счёт введения в процессе формования в их состав различных порообразующих (разрыхляющих) добавок.
Один из разработанных способов [22] предусматривает использование в качестве добавки, разрыхляющей структуры гранул, метакаолина. Сущность этого способа заключается в следующем. Смешивают в соотношении 90-10% мас. – 10-90% маc. сухие порошки каолина и метакаолина. В качестве метакаолина используют каолин, предварительно прокалённый при 550-800°С в течение 2-6 ч. В данных условиях происходит термическая аморфизация каолина.
Полученную однородную смесь увлажняют водой и гранулируют (формуют) методом экструзии. Сформованные гранулы высушивают, а затем прокаливают при 550-800°С в течение 2-6 ч с целью аморфизации каолина в составе гранул. В результате получают механически прочные, рентгеноаморфные гранулы с разрыхленной пористой структурой, способные кристаллизоваться в щелочном алюминатном растворе в цеолит типа А. Состав реакционной смеси должен соответствовать следующему соотношению: кристаллообразующих компонентов (1,2 - 1,4) Na2O • Аl2О3 • (1,8 - 2,0) Si02 • (40-50) H20. Кристаллизацию проводят по ступенчатому температурному режиму: сначала при 20- 30°С в течение 12–14 ч, затем при 60°С – 12–24 ч и, наконец, при 95- 98°С – 12–24 ч. Гранулы цеолита отмывают водой от избытка гидроксида натрия до рН 10,5-11,5 и высушивают при 100-200°С в течение 4–12ч.
Разработанный метод синтеза (рисунок 1.4, вариант I) позволяет получить гранулированный цеолит типа А в виде поликристаллических сростков с использованием сырья только природного происхождения (каолина).
Однако, достичь в рамках данного способа максимальной близкой к 100% степени кристалличности гранул не удается.
Поэтому авторами [22] был разработан другой способ (рисунок 1.4, вариант II) приготовления гранулированного цеолита типа А.
Этот способ предусматривает для увеличения степени кристалличности цеолита типа А без связующего до 100% применение в качестве разрыхляющей добавки высокодисперсного цеолита того же типа в смеси с каолином в соотношении 40-60 / 60-40 % мас., соответственно. Введение цеолита не только повышает фазовую чистоту, но и позволяет значительно сократить продолжительность синтеза.
Кристаллизация из реакционных масс состава (2,0 - 3,4) Na2O • Аl2О3• (1,8 - 2,0) SiO2• (40 - 60) Н2О завершается после выдерживания гранул в растворе в течение, последовательно: 2; 6; 2 ч при 30; 60; 80°С, соответственно, с образованием гранул, обладающих 100 % степенью кристалличности.
Существенного ускорения кристаллизации достигается, по-видимому, вследствие того, что высокодисперсный цеолит типа А, предварительно введённый в состав гранул ксерогеля, выступает в роли кристаллической затравки. Высокая щёлочность реакционной массы вызывает интенсивную перестройку структуры рентгеноаморфной части гранул, приводящую к росту цеолитной фазы и образованию поликристаллического сростка по механизму «переконденсации» и ориентированного наращивания на гранях «подложки»-затравки.
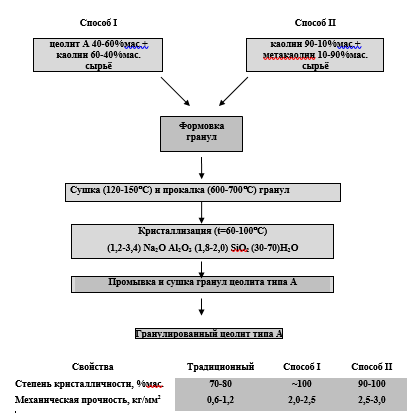
Рисунок 1.4 – Методы синтеза гранулированных цеолитов типа А
в виде поликристаллических сростков
Лабораторная работа №1.1
«Определение насыпной плотности гранулированных цеолитов»
Цель работы: Определение насыпной плотности гранулированных образцов адсорбентов №6, №7 и №8. Величина насыпной плотности характеризуется содержанием данного вещества в единице объёма и выражается в г/см3.
Задачи работы:
1 Ознакомиться с содержанием лабораторной работы: методикой и условиями проведения эксперимента.
2 Изучить основные правила техники безопасности при проведении лабораторной работы по определению насыпной плотности адсорбента.
3 Проведение лабораторной работы в соответствии с заданием. При выполнении работы необходимо соблюдать последовательность операций, количественные соотношения веществ, указанные в методике, следить за параметрами процесса. Наблюдения во время эксперимента, промежуточные и окончательные расчеты должны быть отражены в отчете.
4 Полученные результаты использовать для расчетов в лабораторных работах №2 и №3.
Аппаратура и материалы
- весы лабораторные общего назначения 2 или 4 класса точности;
- мерный цилиндр вместимостью 100 см3;
- герметичная тара (колба) вместимостью 200 см3.
Подготовка к испытанию
Если массовая доля потерь при прокаливании выше 2%, то пробу цеолита в количестве 150 см3 помещают в тигель, прокаливают в печи при температуре 450-5000С в течении 4 часов, после чего выгружают при температуре 200-250°С в герметичную тару и охлаждают до комнатной температуры.
Проведение испытания
Насыпную плотность определяют для уплотнённого образца. Гранулы цеолита засыпают в предварительно взвешенный мерный цилиндр, установленный на лабораторном столе, порциями не более 20 см3 с паузами не менее 20 сек. Сразу после засыпки первой порции начинают равномерно встряхивать цилиндр в течение 5 мин (или уплотняя слой цеолита постукиванием по цилиндру деревянной палочкой). Слой цеолита доводят до метки 100 см3 и уплотняют его до тех пор, пока объём не перестанет изменяться (продолжительность уплотнения 20-30 мин), после чего, мерный цилиндр с цеолитом взвешивают на весах с погрешностью не более 0,01 г.
Обработка результатов
Насыпную плотность вычисляют по формуле
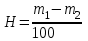
где Н - насыпная плотность, г/см3;
m1- масса цилиндра с цеолитом, г;
m2- масса пустого цилиндра, г;
100 - объём загрузки цеолита, см3.
За результат испытания принимают среднее арифметическое результатов двух последовательных измерений, абсолютное расхождение между которыми не превышает 0,03 г/см3 при доверительной вероятности р=0,95.
Рассчитаем насыпную плотность для образца №6:
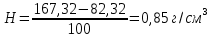
В таблице 1 представлены результаты проведенных экспериментов
Таблица 1
№
|
Образец
|
Масса цилиндра m2, г
|
Масса цилиндра с цеолитом m1, г
|
Насыпная плотность
г/см3
|
6
|
КА2
|
82,32
|
167,32
|
0,85
|
7
|
СаА
|
-
|
-
|
0,68
|
8
|
СаХ
|
-
|
-
|
0,65
|
Лабораторная работа №1.2
«Определение динамической емкости гранулированных цеолитов по углекислому газу»
Цель работы: Исследование процесса очистки природного газа на синтетических цеолитах при атмосферном давлении и заданных преподавателем условиях (температура в адсорбере, время проведения опыта, количество адсорбента), определение динамической емкости цеолита.
Задачи:
1 Изучить теоретические основы очистки от кислых газов цеолитами. Влияние различных факторов на процесс очистки газов цеолитами.
2 Изучить основные правила техники безопасности при проведении лабораторных работ по очистке газа.
3 Ознакомиться с содержанием лабораторной работы: методикой и условиями проведения эксперимента.
4 Проведение лабораторной работы в соответствии с заданием. При выполнении работы необходимо соблюдать последовательность операций, количественные соотношения веществ, указанные в методике, следить за параметрами процесса. Наблюдения во время эксперимента, промежуточные и окончательные расчеты должны быть отражены в отчете.
5 Проведение расчетов, требуемых для проведения лабораторной работы.
Адсорбционные методы очистки газов основаны на селективном извлечении кислых компонентов твердыми поглотителями – адсорбентами. В том случае, когда извлекаемый компонент удерживается адсорбентом (активированный уголь, цеолиты) только физическими силами, имеет место физическая адсорбция. Если извлекаемый компонент вступает с адсорбентом (оксиды железа, цинка, молибдена) в химическое взаимодействие говорят о химической адсорбции.
Эффективные адсорбенты диоксида углерода — цеолиты. Молекулы диоксида углерода достаточно малы. Их диаметр составляет около 0,31 нм (3,1 А), что позволяет им проникать во внутреннюю структуру большинства цеолитов. Десорбцию поглощенных компонентов осуществляют понижением давления и повышением температуры.
По сравнению с другими адсорбентами молекулярные сита имеют большую поглотительную способность, менее подвержены загрязнению и закоксовыванию, лучше извлекают примеси и, благодаря наличию регулируемого размера пор, обладают уникальной селективностью адсорбции в зависимости от размеров молекул. Их использование позволяет снизить удельный объем адсорбента, работать при более низком перепаде давлений на слое адсорбента, исключить потери газа из-за адсорбции ряда его компонентов, обеспечить более длительную и надежную работу установки.
Наиболее часто для адсорбции используют цеолит СаА. Процесс идет под давлением 1,7-5 МПа. Вместе с диоксидом углерода цеолиты поглощают и пары воды. Поэтому одновременно с очисткой газов от диоксида углерода происходит их осушка.
Условия проведения эксперимента
Определение динамической емкости проводят при следующих условиях:
1 Диаметр адсорбера, 25мм.
2 Длина слоя цеолита, 300мм.
3 Скорость газовой смеси, 6,0±0,025л/мин.
4 Концентрация углекислого газа – (10 0,5) %
5 Концентрация Ba(OH)2 – (10 1) %;
6 Концентрация влаги, 13-15мг/л.
7 Температура в адсорбере 23±3(оС).
8 Масса пустого адсорбера (М0)
9 Масса адсорбера с цеолитом (М2).
Подготовка образца к испытанию аналогична подготовке образца при определении динамической емкости по воде.
Порядок проведения эксперимента
Определение динамической ёмкости по углекислому газу проводили на лабораторной установке, схема которой приведена на рисунок 3.1. Воздух из баллона через патрон, заполненный активированным углем для очистки газа от механических примесей, реометр и кран поступает в патрон-осушитель, заполненный предварительно регенерированным в муфельной или трубчатой печи цеолитом КА. Вместо склянки для увлажнения газа, медная трубка смеситель для газа. Склянка для увлажнения газа устанавливается после выхода из адсорбера.
Из патрона осушенный газ краном направляли по медной трубке через тройник на прибор определения точки росы. Для определения степени осушки газа использовали прибор определения точки росы с установки по определению динамической ёмкости цеолитов по парам воды. Скорость потока через прибор регулировали зажимом по реометру.
Осушенный до точки росы не выше минус 70 0С воздух направляли по медной трубке в смеситель, где он смешивался с углекислым газом, поступающим из баллона через реометр, краны и патрон. Патрон-осушитель заполняли регенерированным цеолитом КА, не поглощающим углекислый газ. Смесь воздуха и углекислого газа поступала через кран в адсорбер на очистку, далее через кран в склянку, заполненную на ¼ баритовой водой, для определения проскоковой концентрации углекислого газа и через газовый счетчик сбрасывали в вентиляцию.
Определение динамической ёмкости по углекислому газу проводили при следующих постоянных условиях испытания.
Адсорбер с прокаленным при 350 0С 4 ч цеолитом, подключили к кранам, присоединили вначале входной штуцер, затем выходной. При открытом в вентиляцию кране по реометру установили расход воздуха 5,4л/мин и по реометру – расход углекислого газа 0,6 л/мин. Установили краны в такое положение, чтобы очищенный в адсорбере газ поступал на склянку с баритовой водой. С этого момента записывали время начала испытания и показание газового счетчика. Проскок углекислого газа определяли по помутнению баритовой воды, после чего испытание прекращали, адсорбер отсоединяли, закрывали пробками и взвешивали с погрешностью не более 0,01 г (качественный цеолит КА не поглощает углекислый газ и баритовая вода мутнеет сразу же в начале опыта).
Регенерация цеолита:
Регенерацию цеолита проводят при следующих постоянных условиях:
- температура регенерации 500 ±20 оС;
- время регенерации 4-5 часов с момента достижения необходимой температуры в печи;
- скорость продувки 0.1-0.2 л/мин.
Обработка экспериментальных данных
Динамическую ёмкость по углекислому газу рассчитывали по формуле:
А(CO2)=(М1×Н)/М
где А(CO2) – динамическая емкость в момент проскока СО2, мг/см3;
М – навеска цеолита, мг;
М1 – масса адсорбированного углекислого газа, мг;
Н – насыпная плотность, мг/см3;
М = М2 – М0;
М1 = М3 – М2
где М2 – масса адсорбера с цеолитом до испытания, мг;
М0 – масса адсорбера без цеолита, мг;
М3 – масса адсорбера с цеолитом после испытания, мг.
За результат испытания принимали среднее арифметическое результатов двух последовательных измерений абсолютное расхождение между которыми не превышает 10 мг/см3.
Рассчитаем массу навески цеолита М:
-для образца №6: M = 220,44 – 99,22 = 121,22 г
-для образца №7: M = 224,8 – 103,2 = 121,6 г
-для образца №8: M = 218,3 – 106,1 = 112,2 г
Рассчитаем массу адсорбированного углекислого газа М1:
-для образца №6: M = 220,46 – 220,44 = 0,02 г
-для образца №7: M = 233,4 – 224,8 = 8,6 г
-для образца №8: M = 222,5 – 218,3 = 4,2 г
Рассчитаем динамическую ёмкость по углекислому газу А(CO2) :
-для образца №6: 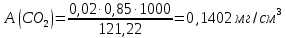
-для образца №7: 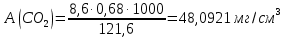
-для образца №8: 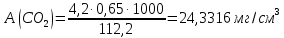
В таблице 2 представлены результаты проведенных экспериментов
Таблица 2
№
|
Образец
|
*Насыпная плотность
ρ, г/см3
|
*Масса адсорбера без цеолита М0, г
|
Масса адсорбера с цеолитом до испытания М2, г
|
Навеска цеолита М, г
|
Масса адсорбера с цеолитом после испытания М3, г
|
Масса адсорбированного углекислого газа М1, г
|
Динамическая емкость
А, мг/см3
|
6
|
КА2
|
0,85
|
99,22
|
220,44
|
121,22
|
220,46
|
0,02
|
0,1402
|
7
|
СаА
|
0,68
|
103,2
|
224,8
|
121,6
|
233,4
|
8,6
|
48,0921
|
8
|
СаХ
|
0,65
|
106,1
|
218,3
|
112,2
|
222,5
|
4,2
|
24,3316
|
ВЫВОД: в ходе данной лабораторной работы были рассчитаны насыпная плотность, масса навески цеолита до испытания, масса адсорбированного углекислого газа после испытания, значение динамической емкости по углекислому газу для трех образцов №6, №7, №8. Диаметр молекул диоксида углерода составляет 3,3 Å, диаметры входных окон представленных образцов №6 KA2, №7 СаА, №8 СаХ равны 3,0 Å, 5,0 Å, 8,0 Å соответственно. Следовательно, подходящими образцами являются №7 и №8, так как диаметр их входных окон больше, чем размер молекул диоксида углерода.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1
|
Грунис Е.Б. Современные проблемы геологии нефти и газа: монография/ Грунис Е.Б., Крылов Н.А. - М.: Научный мир, 2001. -372с.
|
2
|
Балыбердина И.Т. Физические методы переработки и использования газа: монография/ Балыбердина И.Т. - М.: Недра, 1998. - 248 с.
|
3
|
Бекиров Т.М. Первичная переработка природных газов: монография/ Бекиров Т.М. - М.: Химия, 1987. - 256 с.
|
4
|
Жданова Н. В. Осушка углеводородных газов: монография/ Жданова Н. В., Халиф А. Л. - М., 1984
|
5
|
Настека В. И. Научные основы и технология очистки высокосернистых природных газов и газовых конденсатов жидкими поглотителями/Докт. дис. - М.: изд-во ГАНГ им. И.М. Губкина. - 1995
|
6
|
Берлин М. А. Переработка нефтяных и природных газов: монография/ Берлин М. А., Горечейков В. Г., Волков Н. П. - М., 1981
|
7
|
Гуревич И.Л. Технология переработки газа. Ч. 1. Общие свойства и первичные методы переработки нефти / Гуревич И.Л. - М.: Химия, 1972. - 360с.
|
8
|
Кельцев Н.В. Основы адсорбционной техники: монография / Кельцев Н.В. - 2-е изд., перераб. и доп. - М.: Химия, 1984. - 592 с.
|
9
|
Неймарк А.В. Адсорбция и адсорбенты: монография/ Неймарк А.В. – М.: Наука, 1987. –236 с.
|
10
|
Шумяцкий Ю.И. Адсорбция: процесс с неограниченными возможностями: монография / Шумяцкий Ю.И., Афанасьев Ю.М. - М.: Высш. шк., 1998. - 78с.
|
11
|
Шумяцкий Ю.И. Промышленные адсорбционные процессы. – М.:КолосС, 2009. – 183с.
|
12
|
Грег С. Адсорбция, удельная поверхность, пористость: монография / Грег С., Синг К. - М.: Мир, 1984. - 310с.
|
13
|
Карнаухов А.П. Современные проблемы теории адсорбции: монография/ Карнаухов А.П. – М.: ПАИМС, 1995. –273 с.
|
14
|
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов: монография / Карнаухов А.П. – Новосибирск: Наука. Сиб. Предприятие РАН, 1999. - 470 с.
|
15
|
М.Б. Алехина. Свойства и особенности поведения микропористых адсорбентов (цеолитов и активных углей) предназначенных для новых процессов очистки и разделения газов / Докт.дис. 05.17.01. – М.: РГБ.-2006.-310с.
|
16
|
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии / Киселев А.В. // Учебн.пособие для хим., биолог. И химико-технолог. Спец.вузов. – М.:Высш. школа, 1986. – 360с.
|
17
|
Брунауэр С. Адсорбция газов и паров: монография / Брунауэр С. - М.: Изд-во ИЛ, 1948. - Т. 1. - 781 с.
|
18
|
Фенелонов В.Б. Введение в физическую химию формирования молекулярной структуры адсорбентов и катализаторов: монография / Фенелонов В.Б. - Новосибирск: изд. СО РАН, 2004. - 442 с.
|
19
|
Брек Д. Цеолитные молекулярные сита: монография / Брек Д. - М.: Мир, 1976. - 781 с.
|
20
|
Жданов С.П. Синтетические цеолиты: Кристаллизация, структурно-химическое модифицирование и адсорбционные свойства: монография / Жданов С.П., Хвощев С.С., Самулевич Н.Н. - М.: Химия, 1981. - 264 с.
| |
 Скачать 135.02 Kb.
Скачать 135.02 Kb.