х лаб2. Определение молярной массы эквивалента металла. Цели работы
 Скачать 25.22 Kb. Скачать 25.22 Kb.
|
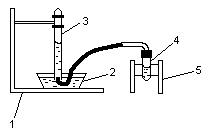
      Определение молярной массы эквивалента металла. Определение молярной массы эквивалента металла.Цели работы: определить молярную массу эквивалента металла методом вытеснения водорода из раствора кислоты; установить, какой это металл. Схема прибора для определения молярной массы эквивалента металла методом вытеснения водорода из раствора кислоты приведена на рис. Основными структурными единицами вещества являются атомы, молекулы, ионы, эквиваленты. Эквивалент – реальная частица (атом, молекула, ион) или условная частица (доля атома, молекулы, иона), равноценная одному иону водорода Н в кислотно-основных реакциях или одному электрону е в окислительно-восстановительных реакциях. Обозначается Э (вещество). Молярная масса эквивалента вещества – масса 1 моль (610)²² эквивалентов данного вещества. Обозначается М эк (вещество). Выражается в граммах на моль [г/моль]. Для окислительно-восстановительной реакции, идущей в работе, закон эквивалентов можно записать как: m1/М эк1 V2 /Vэк 2, где m1 и М эк1 масса и молярная масса вещества 1; V2 иVэк 2 объем и молярный объем эквивалентов газообразного вещества 2. Молярная масса эквивалента металла-восстановителя имеет вид М эк М ат / z , где М ат молярная масса атомов металла, г/моль; z – число электронов, отданных атомом металла в ходе окислительно-восстановительной реакции Ме0 z е МеZ. Методика эксперимента.
Экспериментальные результаты:
Обработка результатов. Приведите объем выделившегося водорода к нормальным условиям (н. у.): p0 V0 / T0 = p1 V1 / T1; V0 = p1 V1 / T1 T0 / p0, гдеV0 – объем выделившегося водорода (н. у.); 2. Рассчитайте молярную массу эквивалента металла, используя закон эквивалентов: М эк = mVэк (Н 2 ) /V0 , где М эк – молярная масса эквивалента металла, г/моль;m – навеска мета ( Vэк= 11,2 л/моль): 3. Определите молярную массу атомов металла: М ат = zМ эк . 4. Вычислите абсолютную ( М эк теор М эк пр ) [г/моль] и относительную | М эк теор М эк пр | / М эк теор 100 [%] погрешности определения, где М эк теортеоретическая молярная масса атомов металла. В таблице Менделеева нашли соответствующий элемент в нашем случае это Al. 5. Приведите уравнение окислительно-восстановительной реакции. Уравнение реакции: 0 +1 +3 0 2Al+6HCl 2AlCl3+3H2 0 - +3 Al-3e Al +1 -1 0 6H + 6e 3 H2 Вывод: В процессе выполнения лабораторной работы была достигнута цель работы, то есть мы определили химический эквивалент металла, использованного в эксперименте (≈ 27 г/моль.). Кроме того, по данным опыта и по теоретическим расчётам была найдена погрешность , и определено название металла . В таблице Менделеева нашли соответствующий элемент в нашем случае это Al. | ||||||||||||||||||||||||