лабораторная 1.2. Определение теплового эффекта реакции гидратации соли
 Скачать 82.72 Kb. Скачать 82.72 Kb.
|
|
ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ГИДРАТАЦИИ СОЛИ Цель работы: экспериментальным методом определить тепловой эффект химической реакции гидратации сульфата меди, пользуясь первым следствием из закона Гесса. Оборудование и материалы 1. Калориметр. 2. Технические весы. 3. Мерный цилиндр. 4. Дистиллированная вода. 5. Сульфат меди (СuSO4·5H2O). 6. Безводный сульфат меди (СuSO4). Порядок выполнения работы Опыт 1. Определение постоянной калориметра Для того, чтобы определить постоянную калориметра, можно провести растворение вещества с известным значением теплоты растворения и измерить тепловой эффект данной реакции по уравнениям 1.2 и 1.3. –∆rН0298= Cк ∆Т, (1.2) Cк = –∆rН0298/ ∆Т, (1.3) –∆rН0298= Cк ∆Т -41,8*103=Ск*5 Ск=-8360 таблица 1.2
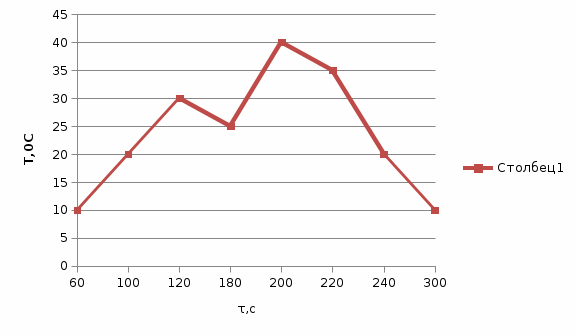 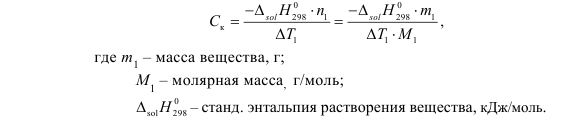 Ск=-41,8*103*10/20*122=171 Опыт 2. Определение теплоты растворения CuSO4·5H2O Взвесьте CuSO4·5H2O, так чтобы концентрация его составила 0,1 моль/л. Опыт 2 проведите так же, как опыт 1, вводя в калориметр с водой сульфат меди. KCl g3 1,5 г., 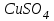 безводный g2 1 г., безводный g2 1 г.,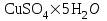 g1 2 г. g1 2 г.H2O 80 г. Результаты изменения температуры при растворении соли занесите в табл. 1.3. таблица 1.3
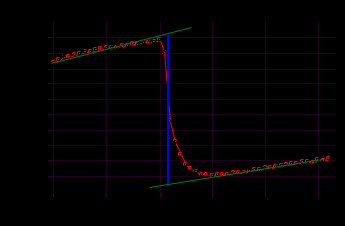 T t l Теплоту растворения соли рассчитывают по формуле: Опыт 3. Определение теплоты растворения CuSO4 Взвесьте CuSO4 так, чтобы концентрация его составила 0,1 моль/л. Опыт 3 проведите так же, как опыт 1, вводя в калориметр с водой безводный сульфат меди. 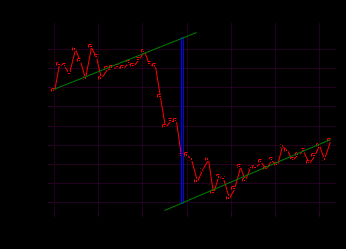 Т t Определение постоянной калориметра 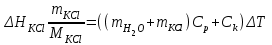 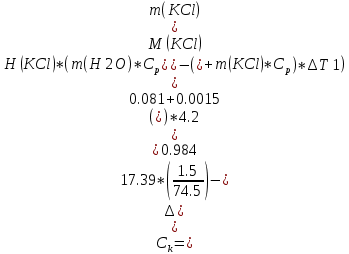 кДж/моль кДж/мольОпределение теплоты растворения CuSO4 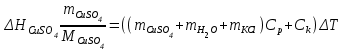 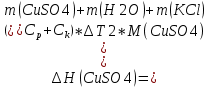 Определение теплоты растворения CuSO4*5H2O 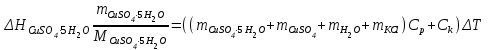 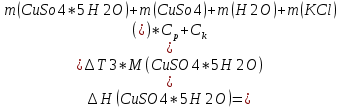 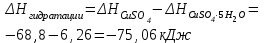 Расчет погрешности Теплота гидратообразования табличное значение: CuSO4 ∆Н1= -78 кДж/моль. 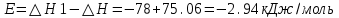 Вывод: в результате лабораторной работы мы получили значение теплоты растворения гидратообразования CuSO4 = -75.06кДж. Она отличается от табличного значения на 2.94кДж/моль. Это можно объяснить случайными погрешностями при проведении эксперимента, неточностью навески материалов и т.д. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
